Resumo
A rapid analytical approach, suitable to characterize the compounds present in the aqueous and methanol extracts prepared from the aerial parts of Indigofera hirsute, was developed. The method based on high-performance liquid chromatography coupled to mass spectrometry, electrospray positive ionization and detection by time of flight (HPLC-ESI-MS-TOF) identified, tryptophan, uracil, rutin, kaempferol-3-O-β-D-glucopyranoside, gallic acid and methyl gallate. The antiradical activity of this extract was evaluated using DPPH assay, with gallic acid as antiradical pattern. The study revealed the antiradical activity of methyl galatte (EC50 = 5 ± 0.3 µg mL-1) galic acid (EC50 = 5 ± 0.2 µg mL-1) and rutin (EC50 = 21.6 ± 0.6 µg m L-1), isolated from methanol extract (EC50 = 67.7 ± 0.9 µg mL-1), which showed strong antiradical activity.
Indigofera hirsuta; mass spectrometry; antiradical activity
Indigofera hirsuta; mass spectrometry; antiradical activity
ARTIGO
Identificação de alguns constituintes químicos de Indigofera hirsuta Linn. (Fabaceae) por CLAE-IES-EM (TOF) e avaliação da atividade antirradicalar
Identification of some chemical constituents of Indigofera hirsuta Linn. (Fabaceae) by HPLC-ESI-MS (TOF) and evaluation of the antiradical activity
Adriana Candido da Silva Moura* * e-mail: adrianacsmoura@yahoo.com.br ; Wagner Vilega; Lourdes Campaner dos Santos
Departamento de Química Orgânica, Instituto de Química, Universidade Estadual Paulista, CP 355, 14800-900 Araraquara - SP, Brasil
ABSTRACT
A rapid analytical approach, suitable to characterize the compounds present in the aqueous and methanol extracts prepared from the aerial parts of Indigofera hirsute, was developed. The method based on high-performance liquid chromatography coupled to mass spectrometry, electrospray positive ionization and detection by time of flight (HPLC-ESI-MS-TOF) identified, tryptophan, uracil, rutin, kaempferol-3-O-β-D-glucopyranoside, gallic acid and methyl gallate. The antiradical activity of this extract was evaluated using DPPH assay, with gallic acid as antiradical pattern. The study revealed the antiradical activity of methyl galatte (EC50 = 5 ± 0.3 µg mL-1) galic acid (EC50 = 5 ± 0.2 µg mL-1) and rutin (EC50 = 21.6 ± 0.6 µg m L-1), isolated from methanol extract (EC50 = 67.7 ± 0.9 µg mL-1), which showed strong antiradical activity.
Keywords:Indigofera hirsuta; mass spectrometry; antiradical activity.
INTRODUÇÃO
Muitos dos benefícios proporcionados pelas plantas medicinais são atribuídos a substâncias com propriedade antirradicalar, principalmente substâncias fenólicas encontrados em inúmeras plantas.1 Essas substâncias protegem o organismo de reações oxidativas que podem desencadear uma série de doenças no organismo humano.2
A família Fabaceae, também conhecida como Leguminosae, possui ampla distribuição nas regiões temperadas e tropicais. É subdividida em 3 subfamílias muito distintas: Faboideae, Caesalpinioideae e Mimosoideae.3
Para a subfamília Faboideae estão descritos aproximadamente 482 gêneros e cerca de 12000 espécies de ampla distribuição nas regiões temperadas e tropicais, sendo que algumas dessas espécies tem grande importância medicinal, como as pertencentes ao gênero Indigofera.4
O gênero Indigofera apresenta cerca de 700 espécies herbáceas e arbustivas que ocorrem em regiões tropicais e subtropicais, principalmente na África, ocorrendo na Austrália, Argentina, China, Índia, Panamá, sudeste asiático e Tailândia. No Brasil foram identificadas 11 espécies, sendo algumas delas amplamente distribuídas no estado de São Paulo.5,6
Espécies de Indigofera apresentam uma diversidade de classes de substâncias, sendo encontrados flavonoides derivados do kaempferol em I. hebepetala7,8 e rotenoides em I. tictoria.9 Ácidos fenólicos e flavonoides foram encontrados em I. mysorensis10 e em I. heterantha.11-13 De I. microcarpa foram isolados dois arilbenzofuranos.14 Nitrocompostos alifáticos ocorrem em mais de 60 espécies de Indigofera.15 São também encontrados glicosídeos do ácido 3-nitropropanoico (NPA),16 bem como seus ésteres mono-, di-, tri- e tetrassubstituídos.17-19 De Indigofera hirsuta foi isolado o kaempferol 3,5-digalactosídeo,20 com atividade antiparasitária.21
O presente trabalho foi realizado com o objetivo de determinar a composição química do extrato aquoso e do extrato metanólico das partes aéreas de Indigofera hirsuta por CLAE-IES-EM (TOF), bem como avaliar a atividade antirradicalar do precipitado (obtido da centrifugação do extrato aquoso), dos extratos aquoso e metanólico e das substâncias isoladas.
PARTE EXPERIMENTAL
Procedimentos cromatográficos
Para os procedimentos cromatográficos foram utilizados: placas preparadas de sílica gel 60 (Merck®) (20 x 20 cm x 0,2 mm); coluna de vidro preenchida com Sephadex LH-20 (70 cm x 3,0 cm d.i.), acoplada a uma bomba peristáltica modelo P1 18-1110-91 (Pharmacia®) e a um coletor automático Redifrac (Pharmacia®); cromatógrafo líquido de média pressão Büchi Pump Manager C-615; cromatógrafo líquido de alta eficiência (analítico) modelo PU-2089 (Jasco®), acoplado a detector de arranjo de foto diodos com faixa de varredura de 195-650 nm e intervalo mínimo de 1 nm, modelo MD-20140 (Jasco®), com coluna de fase reversa RP18 imobilizadas com octadecilsilano, modelo Luna 2 (Phenomenex®) (250 x 4,6 mm d.i.) com partículas de tamanho médio de 5 µm e softwares Star Chromatography Workstation versão 5.31 (Varian®) e EZChrom Elite Client/Server versão 3.1.7 (Chromatec®) para o processamento dos dados cromatográficos; cromatógrafo líquido de alta eficiência (semipreparativo) modelo ProStar 210/330 (Varian®) acoplado a detector de arranjo de foto diodos, com coluna de fase reversa RP18 imobilizadas com octadecilsilano, modelo Luna 2 (Phenomenex®) (250 x 10,0 mm d.i.) com partículas de tamanho médio de 10 µm.
Determinação estrutural
Para obtenção dos dados espectroscópicos e espectrométricos foram utilizados: espectrômetro de ressonância magnética nuclear de 11,7 T (VarianÒ Inova), operando a 500 MHz para 1H e 125 MHz para 13C, TMS foi usado como padrão interno para determinação dos deslocamentos químicos; espectrofotômetro de infravermelho Jasco®, modelo FT/IR - 4100; espectrofotômetro de ultravioleta/visível (Hach®), modelo DR/4000 U; espectrômetro de massas de alta resolução (EM-IES-QTOF) (FCF-USP-RP) ultrOTOFQ-ESI-TOF Bruker Daltonics® (Billerica, MA - USA) acoplado ao cromatógrafo líquido de alta eficiência Shimadzu® equipado com detector de arranjo de foto diodos e coluna de fase reversa C18 Shimadzu® (250 x 4,6 mm d.i.) com partículas de tamanho médio de 5 µm.
Material vegetal
As partes aéreas de Indigofera hirsuta Linn. foram coletadas em dezembro de 2007 no Estado do Tocantins, Brasil, pelo botânico E. R. dos Santos. Uma exsicata, de número 389, foi depositada no herbário da Universidade Federal do Tocantins (UFT).
Extração e isolamento
Após a coleta, o material vegetal foi seco em estufa a 40 ºC e triturado em moinho de facas. O extrato aquoso foi preparado utilizando-se 400 g desse material e 4 L de água a 80 ºC em erlenmeyer durante 24 h. A solução foi filtrada e armazenada a 10 ºC, ocorrendo formação de precipitado, o qual foi separado por centrifugação (1 g). O sobrenadante foi em seguida concentrado e liofilizado, resultando em 99 g de extrato aquoso. O extrato metanólico (40 g) foi obtido a partir de 200 g do material vegetal por percolação com metanol seguido de destilação do solvente sob pressão reduzida.
O extrato aquoso (3 g, 4 x) foi solubilizado em metanol e fracionado por cromatografia de permeação em gel (CPG) em coluna de Sephadex LH-20 eluída com MeOH. As frações obtidas foram analisadas por cromatografia em camada delgada comparativa (CCDC) [placas de sílica gel, eluídas em CHCl3/MeOH/n-PrOH/H2O, (5:6:1:4, fase orgânica), reveladas com solução de anisaldeído/H2SO4]22 e agrupadas, resultando em 7 frações.
A fração 3 (241 mg) foi purificada por cromatografia líquida média pressão (CLMP) (C18, 15 x 1,5 cm, gradiente: H2O/MeOH; 2,5 mL min-1), resultando nas substâncias: triptofano (1, 18 mg) e uracila (2, 12 mg).
O extrato metanólico (1,5 g) foi fracionado por cromatografia líquida de alta eficiência (CLAE) (coluna Luna 2 (Phenomenex®) 10 µm (250 x 10,0 mm), 254 nm, 4 mL min-1, gradiente: solvente A: H2O acidificado com 0,05% de TFA, solvente B: MeOH acidificado com 0,05% de TFA, 10% B - 40% B (10 min), 40% B - 60% B (30 min), 60% B - 100% B (35 min); 100 mg mL-1; injeções de 80 µL). Este fracionamento resultou no isolamento dos flavonoides rutina (3, 12 mg) e kaempferol-3-O-β-D-glucopiranosídeo (4, 9 mg), além de ácido gálico (5, 15 mg) e galato de metila (6, 10 mg).
O precipitado (1 g) foi fracionado por CPG, fornecendo 10 frações, que foram analisadas por CCDC (eluídas e reveladas nas mesmas condições que o extrato aquoso), resultando no isolamento do flavonoide kaempferol (7, 100 mg). A purificação por CLAE da fração 9 permitiu o isolamento do ácido protocatecuico (8, 7 mg) [coluna Luna 2 (Phenomenex®) 10 µm (250 x 10 mm), 254 nm, 4,8 mL min-1, gradiente: solvente A: H2O acidificado com 0,05% de TFA, solvente B: ACN acidificado com 0,05% de TFA, 5% B - 10% B (30 min), 10% B - 100% B (50 min); 80 mg mL-1; injeções de 80 µL].
Análise dos extratos por CLAE-DAD-IES-EM (TOF)
Os extratos metanólico e aquoso foram, separadamente, solubilizados em MeOH/H2O (5:95, v/v) (20 mg mL-1), filtrados em membrana de PTFE (politetrafluoretileno) e submetidos à análise por cromatografia líquida de alta eficiência acoplada a detector de arranjos de diodos e espectrômetro de massas - ionização por electrospray e detecção de íons por tempo de vôo [CLAE-DAD-IES-EM (TOF)]. Foi utilizado sistema CLAE-DAD (Shimadzu®) (Coluna Shimadzu® NST18 5 µm (250 x 4,60 mm), 254 nm, 1 mL min-1, gradiente: solvente A: H2O acidificado com 0,05% de TFA, solvente B: MeOH acidificado com 0,05% de TFA, 5% B - 100% B (60 min). Os extratos foram analisados no modo positivo de ionização.
Atividade antirradicalar
A atividade sequestradora de radicais livres dos extratos e das substâncias isoladas foi determinada utilizando DPPH (2,2-difenil-1-picrilidrazila).23-25
Para avaliar a atividade sequestradora de radicais livres foi utilizada uma solução 0,04 mg mL-1 de DPPH em metanol. Foram adicionados 2 mL desta solução a 1 mL da solução de cada amostra em diferentes concentrações (5, 10, 20, 40, 80 e 160 µg mL-1). Após 30 min foram medidas as absorbâncias das soluções resultantes em 517 nm. O teste foi realizado em triplicata. O ácido gálico comercial (Sigma®) foi utilizado como padrão26 (CE50 = 5 ± 0,2 µg mL-1). As porcentagens de absorbância foram medidas pela equação (%Δ0) = 100 x (A0 - A)/A0. A capacidade de doar um hidrogênio radicalar das amostras foi estabelecida por análise de regressão linear no intervalo de confiança de 95% (P<0,05) pelo programa Excel 2007, expressando a concentração eficiente (CE50) das amostras capaz de reduzir o DPPH em 50% em 30 min.
RESULTADOS E DISCUSSÃO
Composição química
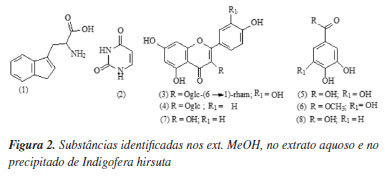
As estruturas das substâncias 1 a 8 isoladas das partes aéreas de Indigofera hirsuta foram identificadas a partir de dados espectroscópicos obtidos por RMN (mono- e bi-dimensionais) e comparadas com dados da literatura.27,28 Os espectros de RMN de 1H e de 13C e os dados de UV e IV estão apresentados no material suplementar. Para confirmar a presença das substâncias nos respectivos ext. MeOH e extrato aquoso, as substâncias isoladas (1-6) e os extratos foram analisadas por CLAE-DAD-IES-EM (TOF). Esta análise permitiu combinar o tempo de retenção das substâncias com os dados de absorção no UV29,30 (Figuras 1a e 1b).
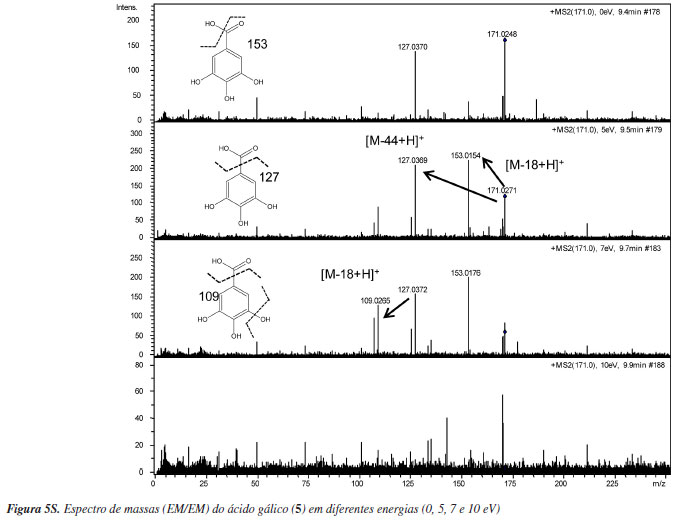
A técnica forneceu, também, informações sobre o íon molecular e fragmentos característicos que possibilitaram confirmar as estruturas das substâncias analisadas (Figura 2, Tabela 1). Os espectros de massas das substâncias 1 a 6 estão apresentados no material suplementar.
O extrato MeOH é constituído por flavonoides (3 e 4) e substâncias fenólicas (5 e 6), enquanto que o extrato aquoso contém as substâncias nitrogenadas triptofano (1) e uracila (2). (Tabela 1, Figura 2).
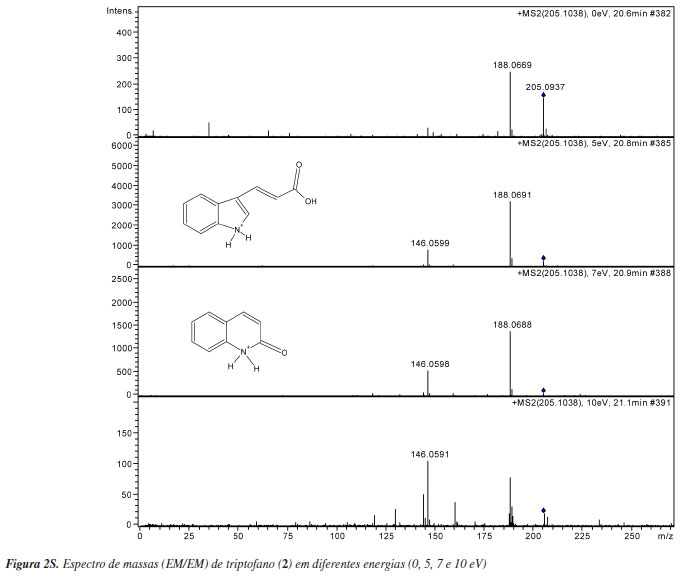
O aminoácido triptofano (1) com tr de 20 min, exibiu o íon molecular protonado [M+H]+ em m/z 205 (C11O2H13N2). A fragmentação de segunda ordem (EM/EM) de m/z 205 gerou os íons em m/z 188, referente à perda de NH3 (fragmento C11O2H10N), e m/z 146, referente ao fragmento C9OH8N.
A uracila (2) com tr de 4 min apresentou íon molecular protonado [M+H]+em m/z 113, de fórmula molecular (C4O2H5N2).
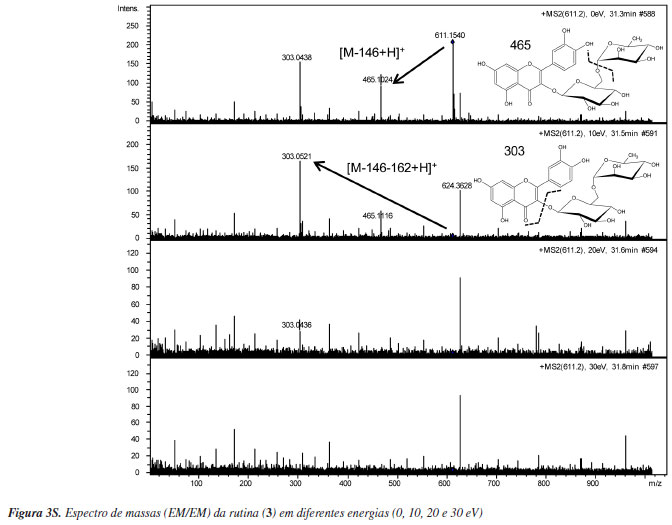
A rutina (3) (tr = 31 min) apresentou o íon molecular protonado [M+H]+ em m/z 611, indicando fórmula molecular C27O16H31. A fragmentação EM/EM gerou fragmentos representativos de m/z 465 [M-146+H]+ e de m/z 303 [M-146-162+H]+, indicando as perdas de ramnose (146) e glicose (162), respectivamente.
O kaempferol-3-O-β-D-glucopiranosídeo (4) (4tr = 34 min) apresentou o íon molecular protonado [M+H]+em m/z 449. A perda de uma unidade de glicose [M-162+H]+ levou à formação do fragmento referente à aglicona protonada (m/z 287).
O espectro de massas do ácido gálico (5) (tr = 9 min) exibiu o íon molecular protonado [M+H]+ em m/z 171, indicando a fórmula molecular C7O5H7. A fragmentação de segunda ordem desse íon precursor levou aos fragmentos de m/z 153 (perda de H2O [M-18+H]+ (C7O4H5)), m/z 127 (perda de CO2 [M-44+H]+ (C6O3H7)) e em m/z 109 [C6O3H7-H2O]+.
O galato de metila (6) (tr = 18 min) exibiu o íon molecular protonado [M+H]+ em m/z 185 (C8O5H9). A fragmentação de segunda ordem gerou os íons de m/z 153 (C7O4H5, perda da metoxila [M-OCH3]+) e m/z 126 (C6O3H6, perda de COOCH3).
A literatura reporta a existência de flavonoides em Indigofera hirsuta,20 enquanto que as substâncias nitrogenadas triptofano (1) e uracila (2) bem como a rutina (3), o kaempferol-3-O-β-D-glucopiranosídeo (4), o ácido gálico (5), o galato de metila (6) o kaempferol (7) e o ácido protocatecuico (8) estão sendo descritos pela primeira vez nesta espécie.
A identificação do triptofano tem grande importância, uma vez que está relacionado à via biossintética de alcaloides bis-indólicos como, por exemplo, o índigo e a indirubina.31,32 Estes alcaloides já foram identificados em algumas espécies do gênero Indigofera (I. suffruticosa e I. truxilelnsis), sendo obtidos dos extratos metanólicos dessas espécies.33
Atividade antirradicalar
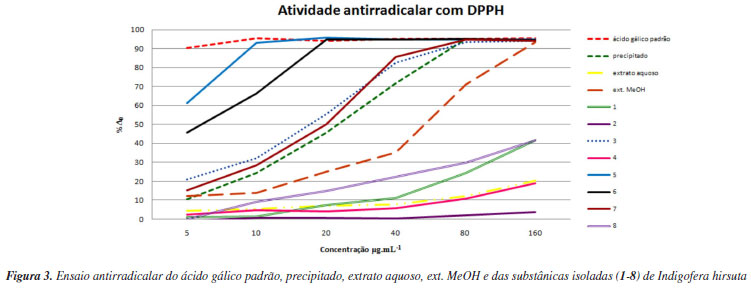
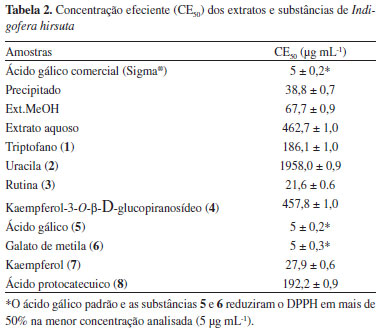
As porcentagens de absorbância medidas pela equação (%Δ0) = 100 x (A0 - A)/A0 estão representadas na Figura 3 e os valores da CE50 na Tabela 2.
Os resultados obtidos para o precipitado (CE50 = 38,8 ± 0,7), proveniente da centrifugação do extrato aquoso, e para o ext. MeOH (CE50 = 67,7 ± 0,9) contêm flavonoides e outras substâncias fenólicas e evidenciaram a atividade antirradicalar desses extratos.
O extrato aquoso (CE50 = 462,7 ± 1,0), que contém as substâncias nitrogenadas triptofano (1) e uracila (2), não apresentou atividade antirradicalar quando comparado aos demais extratos e ao padrão do ácido gálico comercial (CE50 = 5 ± 0,2).
O ácido gálico (5) (CE50 = 5 ± 0,2) isolado do ext. MeOH e o galato de metila (6) (CE50 = 5 ± 0,3) foram as substâncias que, na menor concentração, reduziram o DPPH em mais de 50%, enquanto que o ácido protocatecuido (8) apresentou CE50 192,2 ± 0,9. Esse fato pode ser explicado pela presença de duas hidroxilas fenólicas em 8 e três em 5 e 6.26,34
A rutina (3) apresentou CE50 = 21,6 ± 0,6, enquanto que o kaempferol-3-O-β-D-glucopiranosídeo (4) exibiu CE50 = 457,8 ± 1,0. A menor atividade antirradicalar de 4 em comparação à rutina (3) é justificada devido à existência do sistema orto-di-hidroxi no anel B de 3.34
O kaempferol (7) (CE50 = 27,9 ± 0,6) não possui o sistema orto-di-hidroxi no anel B sendo, portanto, sua atividade antirradicalar menos pronunciada que em 3. A menor atividade antirradicalar da substância 4, um derivado do kaempferol, (CE50 = 457,8 ± 1,0), em comparação com 7, é justificada pela presença da glicose na posição 3 de 4.34
Comparadas aos flavonoides as substâncias 1 e 2 não têm a propriedade de estabilizar o radical formado, pois não apresentam em suas estruturas hidroxilas fenólicas (Figura 2), sendo, portanto, pouco efetiva a ação de sequestrar o hidrogênio radicalar para formar a difenilpicril-hidrazina.35,36
Os flavonoides já são considerados substâncias com potentes propriedades antirradicalares.35,36 A presença de flavonoides (3,4 e 7) e outros fenólicos (5, 6 e 8) no precipitado e no ext. MeOH das partes aéreas de Indigofera hirsuta justifica a propriedade antirradicalar da espécie.
CONCLUSÃO
A técnica CLAE-IES-EM (TOF) mostrou-se adequada para identificar os constituintes químicos dos ext. MeOH e aquoso das partes aéreas de Indigofera hirsuta. Através da análise dos íons moleculares protonados e dos fragmentos nos espectros de massa foi possível identificar as substâncias isoladas dos extratos como sendo: triptofano (1), uracila (2), rutina (3), kaempferol-3-O-β-D-glucopiranosideo (4), ácido gálico (5) e galato de metila (6). As substâncias kaempferol (7) e ácido protocatecuico (8) foram isolados do precipitado (Figura 1c).
Comparando-se os extratos de Indigofera hirsuta, a melhor atividade sequestradora de radicais livres foi obtida para o precipitado, seguido do extrato metanólico e do extrato aquoso. Esta atividade é justificada pela presença do kaempferol no precipitado, da rutina, ácido gálico e galato de metila, no ext. MeOH. Essas são substâncias capazes de melhor sequestrar um hidrogênio radicalar do DPPH e formar um radical estável.
MATERIAL SUPLEMENTAR
Os espectros de massas, os espectros de RMN 1H, os dados de RMN de 13C, UV e IV encontram-se disponíveis gratutitamente em http://quimicanova.sbq.org.br, na forma de arquivo PDF.
AGRADECIMENTOS
Ao CNPq, à CAPES e FAPESP pelo apoio financeiro. À Profa. Dra. V. da S. Bolzani (NUBBE, IQ-UNESP-Araraquara), ao Prof. Dr. N. P. Lopes (USP-RP) pela colaboração na realização dos experimentos de HPLC-ESI-MS (TOF) e ao técnico J. C. Tomaz (USP-RP) pelo registro dos espectros de massas.
Recebido em 14/7/10; aceito em 21/2/11; publicado na web em 15/4/11
Material Suplementar
Figura 1S - clique para ampliar
Figura 2S - clique para ampliar
Figura 3S - clique para ampliar
Figura 4S - clique para ampliar
Figura 5S - clique para ampliar
Figura 6S - clique para ampliar
Dados de RMN de 1H, de 13C (obtidos através de experimentos gHMQC e gHMBC) e de UV e IV das substâncias (1-8):
Triptofano (1): RMN 1H [500 MHz, DMSO-d6, δ(ppm), J (Hz)]: 7,52 (s; H-2); 7,58 (d, J=8,0 Hz; H-4); 6,98 (ddd, J=8,0; J=8,0 e J=0,5 Hz; H-5); 7,07 (ddd, J=8,0; J=8,0 e J=0,5 Hz; H-6); 7,35 (d, J=8,0 Hz; H-7); 3,5 (m; H-α); 3,32 e 2,99 (m; H-β). RMN 13C [125 MHz, DMSO-d6, d (ppm)]: 124,0 (C-2); 110,0 (C-3); 118,0 (C-4; C-5); 121,0 (C-6); 111,0 (C-7); 127,0 (C-3a); 136,0 (C-7a); 54,0 (C-α); 27,0 (C-β). UV: 278 nm. IV (cm-1): υNH2 em 3288; υC-H em 2920 e υCH2 em 2853; dN-H(ass) em 1631 cm; υC=C(aromático) e υC=N(aromático) em 1602; υC-O em 1402; υC-N em 1091.
Figura 7S - clique para ampliar
Uracila (2): RMN 1H [500 MHz, DMSO-d6, δ (ppm), J (Hz)]:]: 5,45 (d, J=7,5 Hz, H-5); 7,38 (d, J=7,5 Hz, H-6). RMN 13C [125 MHz, DMSO-d6, δ (ppm)]: 151,6 (C-2); 164,4 (C-4); 100,2 (C-5); 142,3 (C-6). UV: 259 nm. IV (cm-1): υN-H em 3370; υC=O em 1702; dN-H em 1578; υC-N em 1392.
Figura 8S - clique para ampliar
Rutina (3): RMN 1H [500 MHz, DMSO-d6, δ (ppm), J (Hz)]: 6,20 (d, J=2,1 Hz, H-6); 6,40 (d, J=2,1 Hz, H-8); 7,53 (d, J=2,0 Hz, H-2'); 6,83 (d, J=9,0 Hz, H-5'); 7,75 (dd, J=7,8 e J=2,4 Hz, H-6'); 5,44 (d, J=7,2 Hz, H-1"); 4,38 (d, J=1,0 Hz, H-1"'); 0,99 (d, J=6,0 Hz, H-6"'). RMN 13C [125 MHz, DMSO-d6, δ (ppm)]: 156,5 (C-2); 133,2 (C-3); 177,3 (C-4); 161,2 (C-5); 98,7 (C-6); 164,5 (C-7); 93,6 (C-8); 156,4 (C-9); 103,7 (C-10); 121,5 (C-1'); 116,2 (C-2'); 115,2 (C-3'); 148,5 (C-4'); 115,2 (C-5'); 121,0 (C-6'); 101,2 (C-1"); 75,8 (C-2"); 74,0 (C-3"); 69,9 (C-4"); 76,4 (C-5"); 66,9 (C-6"); 100,7 (C-1"'); 70,5 (C-2"'); 70,3 (C-3"'); 71,8 (C-4"'); 68,2 (C-5"'); 17,6 (C-6"'). UV: 258 nm e 354 nm. IV (cm-1): υO-H em 3345, υC-H em 2920, υC=O em 1659, υC=C(aromático) em 1597 e em 1445, dO-H em 1358, υC-O em 1196 cm-1.
Figura 9S - clique para ampliar
Kaempferol-3-O-β-D-glucopiranosideo (4): RMN 1H [500 MHz, DMSO-d6, δ (ppm), J (Hz)]: 6,20 (d, J=2,1 Hz, H-6); 6,43 (d, J=2,1 Hz, H-8); 7,97 (d, J=8,5 Hz, H-2'); 6, 84 (d, J=8,5 Hz, H-3'); 6,84 (d, J=8,5 Hz, H-5'); 7,97 (d, J=8,5 Hz, H-6'); 5,28 (d, J=7,5 Hz, H-1"); 3,18 (H-2"); 3,20 (H-3"); 3,10 (H-4"); 3,13 (H-5"); 3,55; 3,35 (H-6"). RMN 13C [125 MHz, DMSO-d6, δ (ppm)]: 156,2 (C-2); 133,2 (C-3); 177,4 (C-4); 161,2 (C-5); 98,6 (C-6); 164,1 (C-7); 93,6 (C-8); 156,4 (C-9); 104,0 (C-10); 120,8 (C-1'); 130,8 (C-2'); 115,1 (C-3'); 159,9 (C-4'); 115,1 (C-5'); 130,8 (C-6'); 100,8 (C-1"); 74,2 (C-2"); 76,4 (C-3"); 69,9 (C-4"); 77,4 (C-5"); 60,8 (C-6"). UV: 264 nm e 345 nm. IV (cm-1): υO-H em 3242, υC=O em 1655, υC=C(aromático) em 1607 e em 1505, βO-H em 1354, υC-O em 1175, βC-H(aromático) em 840.
Figura 10S - clique para ampliar
Ácido gálico (5): RMN 1H [500 MHz, DMSO-d6, δ (ppm), J (Hz)]: 6,92 (s, H-2 e H-6). RMN 13C [125 MHz, DMSO-d6, δ (ppm)]: 120,7 (C-1); 108,8 (C-2); 145,4 (C-3); 138,0 (C-4); 145,4 (C-5); 108,8 (C-6); 167,6 (C-1'). UV: 273 nm. IV (cm-1): υO-H em 3274, υC=O(conjugado) em 1602, υC=C(aromático) em 1535.
Figura 11S - clique para ampliar
Galato de metila (6): RMN 1H [500 MHz, DMSO-d6, δ (ppm), J (Hz)]: 6,93 (s, H-2 e H-6); 3,74 (s, CH3). RMN 13C [125 MHz, DMSO-d6, δ (ppm)]: 119,7 (C-1); 108,8 (C-2); 145,5 (C-3); 138,0 (C-4); 145,5 (C-5); 108,8 (C-6); 165,6 (C-1'); 52,3 (OCH3) . UV: 274 nm. IV (cm-1): υO-H em 3293, υC=O(conjugado) em 1674, υC=C(aromático) em 1540.
Figura 12S - clique para ampliar
Kaempferol (5): RMN 1H [500 MHz, DMSO-d6, δ (ppm), J (Hz)]: 6,20 (d, J=2,0 Hz, H-6); 6,44 (d, J=2,0 Hz, H-8); 8,05 (d, J=8,5 Hz, H-2'); 6, 94 (d, J=8,5 Hz, H-3'); 6,94 (d, J=8,5 Hz, H-5'); 8,05 (d, J=8,5 Hz, H-6'). RMN 13C [125 MHz, DMSO-d6, δ (ppm)]: 147,0 (C-2); 99,0 (C-6); 164,2 (C-7); 94,0 (C-8); 156,2 (C-9); 103,0 (C-10); 122,0 (C-1'); 130,0 (C-2'); 115,0 (C-3'); 159,0 (C-4'); 115,0 (C-5'); 130,0 (C-6'). UV: 265 nm e 367 nm. IV (cm-1): υO-H em 3317, υC=C(aromático) em 1607, δO-H em 1380 e υC-O em 1170.
Figura 13S - clique para ampliar
Ácido protocatecuico (8): RMN 1H [500 MHz, DMSO-d6, δ (ppm), J (Hz)]: 7,32 (d, J=1,5 Hz, H-2); 6,76 (d, J=8,5 Hz, H-5); 7,27 (dd, J=8,5 e J=1,5 Hz, H-6). RMN 13C [125 MHz, DMSO-d6, δ (ppm)]: 117,1 (C-2); 145,0 (C-3); 150,0 (C-4); 114,4 (C-5); 122,4 (C-6); 167,0 (C-1'). UV: 260 nm e 294 nm. IV (cm-1): υC-H(aromático) em 3182, υC=O(conjugado) em 1673, υC=C(aromático) em 1597.
Figura 14S - clique para ampliar
- 1. Sultana, B.; Anwar, F.; Food Chem. 2008, 108, 879.
- 2. Li, H. B.; Wong, C.; Cheng, K.; Chen, F.; Food Sci. Technol. 2008, 41, 385.
- 3. Barroso, G, M.; Sistemática de angiospermas do Brasil, 2Ş ed., Edusp: São Paulo, 1978.
- 4. Di Stasi, L. C.; Hiruma-Lima, C. A.; Plantas medicinais na Amazônia e na Mata Atlântica, 2Ş ed., Ed. UNESP: São Paulo, 2002.
- 5. Moreira, J. L. A.; Azevedo-Tozzi, A. N. G.; Rev. Bras. Bot. 1997, 20, 97.
- 6. Barros, G. M. C. C.; Teixeira, S. P.; Rev. Bras. Farmacogn 2008, 18, 287.
- 7. Hasan, A.; Farman, M.; Ahmad, I.; Phytochemistry 1994, 35, 275.
- 8. Hasan, A.; Ahmad, I.; Khan, M. A.; Chudhary, M. I.; Phytochemistry 1996, 43, 1115.
- 9. Kamal, R.; Mangla, M.; Biol. Plant 1984, 263, 202.
- 10. Adinarayana, D.; Sarada, M. J.; Indian Chem. Soc. 1987, 64, 648.
- 11. Anila, T.; Nancy, R.; Ahmed, S. R. J.; Indian Chem. Soc. 1982, 59, 1007.
- 12. Hasan, A.; Khan, M. A.; Iftikhar, N.; Fitoterapia 1991, 52, 183.
- 13. Hasan, A.; Waterman, P.; Iftikhar, N.; J. Chromatogr 1989, 466, 399.
- 14. Moraes e Souza, M. A.; Bieber, L. W.; Chiappeta, A. A.; Maciel, G. M.; Mello, J. F.; Monache, F. D.; Messana, I.; Phytochemistry 1988, 27, 1817.
- 15. Williams, M. C.; Agron. J 1981, 73, 434.
- 16. Aylward, J. H.; Court, R. D.; Haydock, K. P.; Strickland, R. W.; Hegarty, M. P.; Aust. J. Agric. Res 1987, 38, 177.
- 17. Dominguez, X. A.; Martinez, C.; Calero, A.; Dominguez-Jr, X. A.; Hinojosa, M.; Samudio, A.; Watson, W. H.; Zabel, U.; Planta Med 1978, 34, 172.
- 18. Dominguez, X. A.; Martinez, C.; Calero, A.; Dominguez-Jr, X. A.; Hinojosa, M.; Zamudio, A.; Zabel, U.; Smith, W. B.; Watson, W. H.; Tetrahedron Lett. 1978, 5, 429.
- 19. Garcez, W. S.; Garcez, F. R.; Honda, N. K.; Ciência Cult. (Suppl.) 1985, 37, 312.
- 20. Rao, J. U. M.; Hanumiah, T.; Rao, B. K.; Rao, K. V. J.; Indian J. Chem., Sect. B: Org. Chem. Incl. Med. Chem. 1984, 23, 91.
- 21. Morris, J. B.; Walker, J. T.; J. Nemat. 2002, 34, 358.
- 22. Wagner, H.; Bladt, S.; Zgainski, E. M.; Plant Drug Analysis, Springer Verlag: Berlin, 1984.
- 23. Molyneux, P.; Songklanakarin J. Sci. Technol. 2004, 26, 211.
- 24. Silva, M. A.; Tese de Doutorado, Universidade Estadual Paulista, Brasil, 2008.
- 25. Jang, H. D.; Chang, K. S.; Chang, T. C.; Hsu, C. L.; Food Chem. 2010, 118, 554.
- 26. Sousa, C. M. M.; Silva, H. R.; Vieria-Jr., G. M.; Ayres, M. C. C.; Costa, C. L. S.; Araújo, D. S.; Cavalvante, L. C. D.; Barros, E. D. S.; Araújo, P. B. M.; Brandão, M. S.; Chaves, M. H.; Quim. Nova 2007, 30, 351.
- 27. Agrawal, P. K.; Carbon 13 NMR of flavonoids, Elsevier: Amsterdam, 1989.
- 28. Harborne, J. B.; The flavonoids: advances in research since 1986, Chapman and Hall: London, 1996.
- 29. Mabry, T. J.; Markham, K. R.; Thomas, M. B.; The systematic identification of flavonoids, Springer-Verlag: New York, 1970.
- 30. Rinaldo, D.; Dissertação de Mestrado, Universidade Estadual Paulista, Brasil, 2007.
- 31. Salvini, M.; Boccardi, T. M.; Sani, E.; Bernardi, R.; Tozzi, S.; Pugliesi, C.; Durante, M.; Plant Physiol. Biochem. 2008, 46, 715.
- 32. Berry, A.; Dodge, T. C.; Pepsin, M.; Weyler, W.; J. Ind. Microbiol. Biotechnol 2002, 28, 127.
- 33. Calvo, T. R.; Cardoso, C. R. P.; Moura, A. C. S.; Santos, L. C.; Colus, I. M. S.; Vilegas, W.; Varanda, E. A.; Evid. Based Complement. Altern. Med. (2009), doi: doi:10.1093/ecam/nep123.
- 34. Ayres, M. C. C.; Chaves, M. H.; Rinaldo, D.; Vilegas, W.; Vieira-Jr., G. M.; Quim. Nova 2009, 32, 1509.
- 35. van den Ber, R.; Haenen, G. R. M. M.; van den Berg, H.; Vander, V. W.; Bast, A.; Food Chem 2000, 703, 391.
- 36. Saija, A.; Scalese, M.; Lanza, M.; Marzullo, D.; Bonina, F.; Castelli, F.; Free Radical Biol. Med. 1995, 4, 481.
Datas de Publicação
-
Publicação nesta coleção
12 Set 2011 -
Data do Fascículo
2011
Histórico
-
Aceito
21 Fev 2011 -
Recebido
14 Jul 2010