Resumo
TiO2 immobilization on concrete was studied using mixtures with cement, varnish and resin. The UV radiation sources were a germicide UV lamp and solar light. Aqueous solutions of chloroform (CHCl3) and of phenol were prepared and recirculated over the TiO2 immobilized surfaces. The immobilized TiO2 surfaces showed better photocatalytic efficiency for phenol degradation compared to the control. For CHCl3, the presence or absence of the catalyst did not cause any significant difference to its degradation efficiency. The micrographic results showed a more homogeneous surface for TiO2 immobilized in resin and varnish.
titanium dioxide; immobilization; degradation
titanium dioxide; immobilization; degradation
ARTIGO
Imobilização de TiO2 em concreto: fotodegradação de clorofórmio e fenol
TiO2 immobilization onto concrete: chloroform and phenol photodegradation
Valquíria Claret dos Santos; Márcia Matiko Kondo* * e-mail: mmkondo@unifei.edu.br
Departamento de Física e Química Instituto de Ciências Exatas, CE - Universidade Federal de Itajubá, Av. BPS, 1303, 37500-903 Itajubá MG
ABSTRACT
TiO2 immobilization on concrete was studied using mixtures with cement, varnish and resin. The UV radiation sources were a germicide UV lamp and solar light. Aqueous solutions of chloroform (CHCl3) and of phenol were prepared and recirculated over the TiO2 immobilized surfaces. The immobilized TiO2 surfaces showed better photocatalytic efficiency for phenol degradation compared to the control. For CHCl3, the presence or absence of the catalyst did not cause any significant difference to its degradation efficiency. The micrographic results showed a more homogeneous surface for TiO2 immobilized in resin and varnish.
Keywords: titanium dioxide; immobilization; degradation.
INTRODUÇÃO
Inúmeros trabalhos envolvendo os Processos Oxidativos Avançados (POA) têm sido desenvolvidos visando principalmente a mineralização completa de poluentes orgânicos1-3. Dentre estes trabalhos os mais investigados são os que empregam o sistema dióxido de titânio e irradiação UV (TiO2/UV). O TiO2 é um semicondutor que sob irradiação, de energia mínima de 3,2 eV, promove os elétrons da banda de valência para a banda de condução, formando sítios oxidantes e redutores capazes de catalisar reações químicas, oxidando os compostos orgânicos à CO2 e H2O e reduzindo metais dissolvidos ou outras espécies presentes4-7. Elétrons na banda de condução e buracos na banda de valência representam cargas móveis que interagem umas com as outras. O tempo de vida deste estado excitado é de nanosegundos, uma vez que os elétrons e os buracos irão se recombinar ao se reencontrarem, e a energia dissipada será na forma de calor ou outra forma de radiação8.
Este sistema foi primeiramente utilizado em suspensão aquosa, degradando inúmeros compostos orgânicos9-11. Entretanto, existe a necessidade de se separar o TiO2 da água após o tratamento, acarretando uma etapa adicional e, conseqüentemente, um aumento no custo do processo12,13. Pela necessidade deste processo adicional, vários pesquisadores vêm estudando tipos de imobilização para o TiO2.
Rachel e colaboradores14 investigaram a imobilização de TiO2 em vários substratos, tais como vidro, cimento branco, tijolo vermelho e fibra inorgânica, utilizando técnicas como spray, sol-gel e um método já patenteado para imobilização em fibras inorgânicas.
Souza15 imobilizou filmes finos de suspensões variadas de TiO2, TiO2/álcool polivinílico (PVA) e TiO2/poliestireno (PS) contendo 23, 60 e 70% do catalisador. O autor imobilizou o TiO2/PVA em placas de Petri empregando o método "dip-coating". Para o filme TiO2/PS, a técnica utilizada foi a evaporação do solvente.
Um outro exemplo de imobilização encontrado na literatura foi o empregado por Kondo e colaboradores16, onde o TiO2 foi imobilizado em uma superfície de vidro. Os autores investigaram a inativação de microorganismos em ambientes interiores e verificaram que mais de 90% de fungos e bolores eram inativados na presença de TiO2/UV.
Considerando a necessidade de se imobilizar o TiO2 para seu emprego como fotocatalisador, o objetivo principal do presente trabalho foi imobilizar o TiO2 em concreto e investigar sua eficiência na destruição do CHCl3 e fenol.
O processo de cloração é muito utilizado na maioria dos países, por ser um método eficaz e econômico de desinfecção de água para consumo humano. Uma desvantagem deste processo é que o cloro reage com substâncias húmicas, resultantes da degradação de matéria orgânica, originando compostos organoclorados, principalmente os trialometanos (THM). Dentre os THM, o clorofórmio é o composto que se forma em maior quantidade, sendo comprovadamente cancerígeno17.
Uma vez que a cloração é o processo empregado no Brasil, uma alternativa para evitar que o THM, formado durante o processo de tratamento da água, chegue ao consumo doméstico, seria remover o mesmo de alguma forma. A literatura mostra que nos últimos 30 anos, os chamados Processos Oxidativos Avançados (POA) vêm sendo intensamente estudados18, em particular o emprego do sistema TiO2/UV e pode ser uma alternativa promissora.
PARTE EXPERIMENTAL
Reagentes
O dióxido de titânio (TiO2), fornecido pela Degussa (P25, predominantemente anatase, área superficial de 50,0 m2 g-1), foi utilizado sem nenhum tratamento prévio.
Solução de clorofórmio (CHCl3 Caal): foi preparada uma solução de 100 µg L-1, que foi mantida sob refrigeração a 4 °C.
Solução de fenol (Rhodia): preparou-se uma solução estoque de 1x10-2 mol L-1, que foi mantida sob refrigeração a 4 °C.
Preparo do concreto
Uma massa de concreto convencional foi preparada em uma fôrma (canaleta) de 0,5x30x0,25 cm. O TiO2 foi imobilizado sobre este concreto, empregando-se três procedimentos: imobilização do TiO2 com cimento e areia: foi preparada uma massa de cimento e TiO2 com as seguintes proporções: 30 g de cimento, 23 g de areia, 88 mL de água destilada e 15 g de TiO2. Esta massa foi aplicada sobre o concreto com uma espessura de 0,5 cm; imobilização do TiO2 empregando resina epóxi: pesou-se 16 g de uma resina disponível comercialmente e adicionou-se 1,2 g de TiO2 até a homogeneização da mistura e, imobilização do TiO2 empregando verniz: pesou-se 16 g de um verniz disponível comercialmente e adicionou-se 3,2 g de TiO2.
Estudo de fotodegradação
Preparou-se a solução a ser irradiada, de CHCl3 ou fenol, e foram transferidos 100 mL para um béquer e 100 mL para a canaleta, conforme a Figura 1. A solução foi forçada a recircular sobre o sistema empregando-se uma bomba peristáltica (Ismatec). Todos os experimentos foram realizados com uma canaleta contendo o TiO2 imobilizado e uma canaleta controle. Estes estudos foram realizados com 200 mL da solução teste (CHCl3 ou fenol) utilizando uma bomba peristáltica, que permitia o bombeamento contínuo da solução entre o bécker e a canaleta, com vazão de 6,7 e 13 mL min-1. A solução recirculada no béquer era mantida sob agitação. A vazão de 6,7 mL min-1 possibilita que os 200 mL da solução passem pelo sistema em 30 min e a vazão de 13 mL min-1, em 15 min. Este sistema foi um sistema aberto com espessura de coluna d'água de 0,6 cm.
Como fonte de irradiação UV foi utilizada uma lâmpada germicida de 30 W de potência. O mesmo esquema de irradiação foi empregado quando a radiação solar foi usada como fonte de luz UV e sua intensidade foi medida pelo radiômetro (Cole-Parmer) no comprimento de onda de 365 nm. Nestes estudos, aumentou-se o comprimento da canaleta para 60 cm.
Quantificação do CHCl3
O CHCl3 presente em solução aquosa foi quantificado por extração líquido-líquido19. Para tanto, foram coletados 10 mL da amostra, adicionados 2 mL de hexano e a mistura foi agitada por 2 min. Injetou-se 2 µL da fase orgânica no cromatógrafo CG/ECD (Varian, modelo CP 3800). A coluna utilizada foi CP WAX 52 CB, com 30 cm de comprimento, diâmetro interno de 0,25 µm e externo de 0,25 mm. O programa do cromatógrafo utilizado foi isoterma de 180 ºC por 3 min. A temperatura do injetor foi de 270 ºC e do detector de 300 ºC.
Quantificação do fenol
A quantificação de fenol foi feita coletando-se 5 mL de amostra e injetando-se 0,5 µL no cromatógrafo CG/FID (Varian, modelo CP 3800). A coluna empregada foi a WCOT de sílica fundida com 15 cm de comprimento, diâmetro interno de 0,53 nm e externo de 0,70 mm. O programa utilizado foi temperatura inicial de 60 ºC por 1 min com rampa de aquecimento de 59 ºC min-1 até 180 ºC por 4 min. A temperatura do injetor foi de 250 ºC e do detector FID de 300 ºC.
Estudo de adsorção
Um pedaço de concreto já preparado foi moído com ajuda de pistilo e almofariz. Este pó foi transferido (0,1 g) para 15 erlenmeyers de 100 mL de capacidade. Adicionou-se a eles 50 mL de solução contendo CHCl3 nas concentrações de 1, 5, 10, 25, 50 µg L-1, todas em triplicata.
Estes frascos foram colocados em mesa agitadora por 24 h a 25 °C. Após este período as amostras foram filtradas em membrana de 0,45 µm de porosidade e analisadas quanto à concentração de CHCl3 remanescente em solução.
RESULTADOS E DISCUSSÃO
Fotodegradação do CHCl3
Para verificar a fotólise direta do clorofórmio, foram empregados frascos plásticos contendo 100 mL da solução de concentração 20 µg L-1 de CHCl3. Este estudo apresenta os resultados realizados com a fonte de radiação UV a 2 e a 15 cm de distância da solução. Verificou-se que com a lâmpada a 2 cm de distância, a degradação total do CHCl3 foi obtida após 90 min de irradiação, enquanto que ao se empregar a lâmpada a 15 cm de distância, a fotólise direta do CHCl3 foi de 50%, no mesmo intervalo de tempo. Embora a fotólise direta tenha sido mais significativa empregando-se a fonte a 2 cm da solução, optou-se por utilizar esta distância para os experimentos futuros.
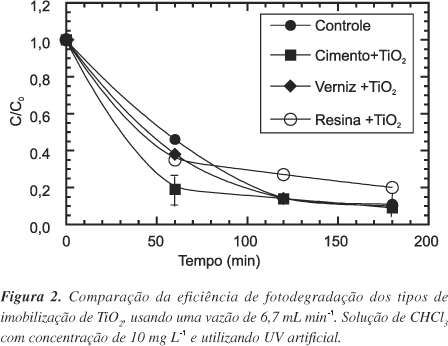
Após preparar as superfícies imobilizadas com o TiO2, foram feitos estudos comparativos das eficiências fotocatalíticas das mesmas, empregando-se para tanto, uma solução de 10 µg L-1 de CHCl3. Os resultados estão apresentados na Figura 2. Pode-se observar que em 60 min de irradiação, a superfície de TiO2/cimento degradou 80% do CHCl3 presente inicialmente, seguido das superfícies de resina e verniz com 65 e 60%, respectivamente. A degradação observada no controle, ou seja, o concreto puro, foi de aproximadamente 50%. Embora pareça a princípio que exista uma diferença na eficiência de fotodegradação do CHCl3, após 120 min de irradiação, a porcentagem de degradação atingiu a mesma concentração para todas as superfícies estudadas.
Uma possível explicação para estes resultados seria o fato do concreto estar adsorvendo o CHCl3. Para verificar esta hipótese, foi realizado um estudo onde a solução foi recirculada sobre as canaletas no escuro, por um período de 60 min para, após este intervalo, a fonte de UV ser ligada. A concentração inicial do clorofórmio foi dobrada uma vez que os resultados apresentados na Figura 2 mostram que em 60 min, há uma diminuição de 50% da concentração inicial do CHCl3. Após este intervalo a lâmpada foi acesa e a concentração de CHCl3 remanescente quantificada por mais 2 h. Os resultados estão apresentados na Figura 3. Pode-se observar uma diminuição na concentração do CHCl3 na ausência de radiação, o que indica a adsorção deste composto sobre as superfícies. Em um estudo paralelo, foi verificado que neste mesmo intervalo de tempo de 60 min, a concentração de CHCl3 não se alterou quando na ausência de luz e cimento, em um sistema aberto.
Foram também realizados experimentos com radiação solar, utilizando-se o CHCl3 na concentração de 100 µg L-1 (Figura 4). A intensidade média da radiação UV no comprimento de onda de 365 nm, quantificadas nos horários de 12:30 a 14:00 h foi de 1,78 mW cm-2. Pode-se verificar na Figura 4 que não houve diferença significativa na degradação do CHCl3 entre as superfícies estudadas.
Um estudo mais detalhado de adsorção foi realizado empregando-se o modelo de Freundlich, que é um modelo empírico.
A forma linear da Equação de Freundlich é dada por:
onde Kf (mg g-1) e m são constantes relacionadas com a capacidade de adsorção e a intensidade de adsorção, respectivamente. Os valores de Kf e m podem ser obtidos pela intersecção e inclinação da reta linear no gráfico de log qx (quantidade adsorvida no equilíbrio) em função de log Cx (concentração remanescente no tempo x). Os valores experimentais dos coeficientes de correlação das retas mostraram que o modelo de isoterma de Freundlich pôde adequadamente descrever os dados de adsorção20. Pela equação da reta obtida, verificou-se que a adsorção máxima do CHCl3 no cimento foi de qmax = 6,5 mg CHCl3 g-1 de cimento.
Estes resultados mostraram que a diminuição da concentração do CHCl3 em relação ao tempo de irradiação, nos estudos de fotodegradação, é devida, principalmente, à adsorção do composto teste no concreto. Variações nos parâmetros, tais como concentração, tempo de irradiação, intensidade de irradiação, presença ou não de catalisador, não alteraram significativamente os resultados obtidos em relação ao controle.
Para verificar se este comportamento, ou seja, o processo de adsorção ser superior à fotodegradação, seria também seguido por outros compostos, optou-se por investigar a fotodegradação do fenol, um outro composto teste bastante utilizado nos estudos empregando POA21-23.
Fotodegradação do fenol
Uma vez que o CHCl3 foi adsorvido pelas superfícies investigadas, o primeiro passo foi verificar se o fenol também seria adsorvido. Realizou-se então um estudo recirculando as soluções aquosas de fenol sobre as canaletas, na ausência de irradiação UV. Pôde-se observar que nos primeiros 60 min, a adsorção máxima ficou em torno de 15% para todos tipos de imobilização, inclusive para o controle. Este estudo comprovou que em comparação à adsorção do CHCl3, nas superfícies contendo TiO2 imobilizado, a adsorção do fenol foi menor. Por este motivo, não foi realizado um estudo mais detalhado para se obter os valores desta adsorção, como foi feito para o CHCl3.
No estudo de fotólise direta do fenol, utilizou-se uma solução aquosa com concentração de 1x10-2 mol L-1. Como pode ser visto na Figura 5, após 90 min de irradiação empregando UV artificial, menos de 30% do composto originalmente presente foi degradado. Este resultado indica que nas condições estudadas o fenol sofre muito pouca influência de fotólise direta. A Figura 5 mostra também um estudo de fotodegradação do fenol recirculando a solução sobre as canaletas contendo o TiO2 imobilizado, nas mesmas condições de laboratório realizadas para o CHCl3. Pode-se observar uma diferença significativa na degradação empregando as superfícies com TiO2 em comparação ao controle, principalmente nos primeiros 60 min. Em 2 h de irradiação, as superfícies contendo TiO2 imobilizado degradaram cerca de 60 a 70%, dependo do tipo de imobilização, enquanto o controle degradou apenas 25%. Não foram realizadas análises para quantificar possíveis intermediários, uma vez que a literatura mostra que estes intermediários também são mineralizados após um intervalo maior de irradiação24,25.
Microscopia Eletrônica de Varredura (MEV)
A Figura 6a apresenta a micrografia da amostra de cimento misturada com TiO2. Observa-se uma morfologia de cristalitos de forma irregular, apresentando aglomerados de substâncias nas áreas claras (A) e cavidades nas áreas escuras (B). As amostras preparadas com mistura de TiO2/verniz também foram analisadas por MEV (Microscopia Eletrônica de Varredura) e estão apresentadas na Figura 6b. Observando a micrografia pode-se afirmar que a mistura apresenta melhor homogeneidade de superfície na área escura, que foi um dos objetivos do presente trabalho. As incidências das áreas mais claras são menores que os observados no MEV da amostra de cimento/TiO2. A Figura 6c mostra a imagem de MEV da amostra de TiO2/resina. Verifica-se que a superfície é mais homogênea que a observada na Figura 6a.
Os resultados de EDS ("Energy Dispersive Spectroscopy") mostram que as espécies predominantes na superfície são cálcio e titânio. Os resultados de EDS apresentados na Tabela 1 da região A indicam maior quantidade de partículas de cálcio, com pequena porcentagem de TiO2, sugerindo a necessidade de melhoria no procedimento experimental de preparação da mistura.
A presença dos outros elementos pode ser explicada por estes fazerem parte da formulação do cimento. Visto ao microscópio, o clínquer, como é chamado o cimento, apresenta cristais de diversas formas ligados entre si por um material intersticial. Estes cristais são de silicatos e aluminatos de cálcio, formados pelo óxido de cálcio (CaO) do calcário com a sílica (SiO2) e alumina (Al2O3), presentes na argila, ou até do próprio calcário26.
Os resultados de EDS das amostras de verniz e resina contendo o TiO2 apresentaram resultados similares ao observado na amostra de cimento/TiO2. Os elementos de maior incidência foram Ca e Ti. Embora o Ca não esteja presente na formulação do verniz nem da resina, a presença deste elemento na superfície pode ser explicada através, provavelmente, da migração do mesmo, proveniente do cimento.
CONCLUSÃO
Os resultados das superfícies estudadas como fotocatalisadores, empregando o CHCl3 como composto teste, mostraram uma diminuição da concentração do mesmo sem se provar a eficiência fotocatalítica do TiO2, uma vez que o processo de adsorção se sobrepôs ao de degradação.
Em relação aos resultados observados com o fenol sendo empregado como composto teste, foi verificado que a eficiência de degradação deste em presença do TiO2 imobilizado foi melhorada em relação ao controle. Dentre os processos de imobilização a eficiência fotocatalítica aumentou seguindo a ordem Verniz/TiO2 > resina/TiO2 > cimento/TiO2.
As micrografias mostraram uma melhor homogeneidade nas amostras de resina e verniz. Devido às superfícies de verniz/TiO2 não se soltarem com facilidade do substrato, e os resultados de degradação também serem mais favoráveis, esta foi a que melhor atingiu o objetivo do presente trabalho.
AGRADECIMENTOS
À CAPES pelo apoio financeiro.
Recebido em 16/3/05; aceito m 28/7/05; publicado na web em 20/1/06
- 1. Byrne, J. A.; Davidson, A.; Dunlop, P. S. M.; Eggins, B. R.; J.; Photochem. Photobiol 2002, 148, 365.
- 2. Byrne, J. A.; Eggins, B. R.; Brown, N. M. D.; Mckinney, B.; Rouse, M.; Appl. Catal 1998, 17, 25.
- 3. Chen, D.; Ray, A. K.; Chem Eng. Sci. 2001, 56, 1561.
- 4. Bideau, M.; Bernard, C.; Michel, O.; J. Photochem 1980, 14, 291.
- 5. Linsebigler, A. L.; Lu, G.; Yates Jr., T.; Chem. Rev 1995, 95, 735.
- 6. Kondo, M. M.; Jardim, W. F.; Water Res 1991, 25, 823.
- 7. Dunlop, P. S. M.; Byrne, J. A.; Manga, N.; Eggins, B. R.; J. Photochem. Photobiol. 2002, 148, 355.
- 8. Takiyama, M. M. K.; Tese de Doutorado, University of Delaware, EUA, 1996.
- 9. Fujishima, A.; Hashimoto, K.; Watanabe, T.; TiO2 Photocatalysis. Fundamentals and Applications 5Ş ed., Editora BKC, Inc., 1999.
- 10. Kagaya, S.; Shimizu, K.; Araf, R.; Hasegawa, K.; Water Res. 1999, 33, 1753.
- 11. Pruden, A. L.; Ollis, D. F.; Environ. Sci. Technol 1983, 17, 628.
- 12. Fujishima, A.; Rao, T. N.; Tryk, D. A.; J. Photochem. Photobiol., A 2000, 1, 1.
- 13. Fujishima, A.; Honda, K.; Kikuchi, S.; Kogyo Kagaku Zasshi 1969, 72, 108.
- 14. Rachel, A.; Subrahmanyam, M.; Boule, P.; Appl. Catal 2001, 37, 301.
- 15. Souza, A. C.; Dissertação de Mestrado, Universidade Federal de Itajubá, Brasil, 2003.
- 16. Kondo, M. M.; Orlanda, J. F. F.; Ferreira, M. G. A. B.; Grassi, M. T.; Quim. Nova 2003, 26, 133.
- 17. Grassi, M. T.; Caderno Temático de Química Nova na Escola 2001, 1, 31.
- 18. Takiyama, M. M. K.; Dissertação de Mestrado, Universidade Estadual de Campinas, Brasil, 1990.
- 19. APHAAWWAWEF; Standard Methods for the Examination of Water and Wastewater, 19tth ed., Eaton, A. D.; Clesceri L. S.; Greenberg, A. E., eds., 1995.
- 20. Fungaro, D. A.; Silva, M. G. da; Quim. Nova 2002, 25, 1081.
- 21. Tryba, B.; Morawski, A. W.; Inagaki, M.; Appl. Catal 2002, 1274, 1.
- 22. Espulgas, S.; Jiménez, J.; Contreras, S.; Pascual, E.; Rodríguez, M.; Water Res. 2002, 36, 1034.
- 23. Roig, B.; Gonzalez, C.; Thomas, O.; Spectrochim. Acta 2002, 59, 303.
- 24. Ziolli, R. L.; Jardim, W. F.; Quim Nova 1997, 21, 319.
- 25. Matthews, R. W.; J. Phys. Chem 1987, 91, 3328.
- 26. Petrucci, E. G.; Concreto de Cimento Portland, 2Ş ed., Ed. Globo, 1975.
Datas de Publicação
-
Publicação nesta coleção
03 Abr 2006 -
Data do Fascículo
Abr 2006
Histórico
-
Aceito
28 Jul 2005 -
Recebido
16 Mar 2005