Resumo
This work describes the use of clinoptilolite for removal of ammonium ions present in waters produced at the Campos' Basin. Samples were previously treated in order to remove organic compounds and metals. Experiments were run in fixed- and fluidized-bed systems, at room temperature. The fluidized-bed systems did not remove efficiently the ammonium ion. The best operational conditions were obtained with clinoptilolite particle size in the range 0.30-0.50 mm, under ascendant flow (3 mL min-1), in a fixed-bed system. The best zeolite performance was found when it was pretreated with 0.5 mol L-1 NaOH. Na+ was the most important interfering ion due to its high concentration in the water. Clinoptilolite lost partially its capacity to retain ammonium ions after several regeneration cycles with NaOH.
ammonium ion; produced water; clinoptilolite
ammonium ion; produced water; clinoptilolite
NOTA TÉCNICA
Remoção do íon amônio de águas produzidas na exploração de petróleo em áreas offshore por adsorção em clinoptilolita
Removal of ammonium ions from waters produced in petroleum offshore exploitation by adsorption on clinoptilolite
Rosilda Maria Gomes de LimaI; Glória Regina da Silva WildhagenI; José Waldemar Silva Dias da CunhaI; Julio Carlos AfonsoII,* * e-mail: julio@iq.ufrj.br
IDepartamento de Química e Materiais Nucleares, Instituto de Engenharia Nuclear, CP 68456, 21941-909 Rio de Janeiro RJ, Brasil
IIDepartamento de Química Analítica, Instituto de Química, Universidade Federal do Rio de Janeiro, Av. Athos da Silveira Ramos, 149, CT, Bloco A, 21941-909 Rio de Janeiro RJ, Brasil
ABSTRACT
This work describes the use of clinoptilolite for removal of ammonium ions present in waters produced at the Campos' Basin. Samples were previously treated in order to remove organic compounds and metals. Experiments were run in fixed- and fluidized-bed systems, at room temperature. The fluidized-bed systems did not remove efficiently the ammonium ion. The best operational conditions were obtained with clinoptilolite particle size in the range 0.30-0.50 mm, under ascendant flow (3 mL min-1), in a fixed-bed system. The best zeolite performance was found when it was pretreated with 0.5 mol L-1 NaOH. Na+ was the most important interfering ion due to its high concentration in the water. Clinoptilolite lost partially its capacity to retain ammonium ions after several regeneration cycles with NaOH.
Keywords: ammonium ion; produced water; clinoptilolite.
INTRODUÇÃO
A água produzida na exploração de petróleo
Ao longo da exploração de petróleo de jazidas em terra (onshore) ou no mar (offshore), existe geração concomitante de um efluente aquoso, denominado água produzida, que representa a maior corrente de resíduo na produção do óleo cru.
Para manter as condições de pressão na rocha-reservatório, condição para a migração do petróleo para os poços, principalmente em áreas offshore, normalmente é efetuada uma operação de injeção de água nas camadas inferiores do reservatório. A participação da água produzida no óleo associado varia durante a produção do petróleo. Um campo novo produz de 5 a 15% de volume de água. À medida que a vida econômica dos poços se esgota, essa água pode atingir uma faixa de 75 a 90% vol..1-4
A produção excessiva de água é um problema sério nos campos de petróleo maduros, isto é, aqueles que têm permanecido em operação por longo período de tempo. A eficiência do separador água/óleo diminui. Depois do separador, a água contendo óleo (gotas microemulsionadas), produtos químicos dissolvidos e até microorganismos precisa ser tratada.5 Em áreas offshore o descarte é feito em grandes ambientes receptores, onde a diluição e a dispersão rápida tomam lugar. Isto poderia ser uma argumentação para o não tratamento da água produzida. Mas fatores, tais como correntes marítimas, ventos, temperatura da água, mudança de clima, podem transportar ou mesmo concentrar alguns de seus constituintes (fenóis, íon NH4+ etc.). O descarte de tais volumes de resíduos vem causando preocupações sobre a poluição ambiental não controlada e irreversível no ambiente marinho. As águas produzidas apresentam, em geral, altos teores de contaminantes tóxicos (metais pesados, tais como Cd, Cr, Cu, Pb, Hg, Ag, Ni, Zn; produtos químicos adicionados durante a injeção, tais como inibidores de corrosão, inibidores de incrustação, desemulsificantes, metanol, glicol, polieletrólitos), além de uma complexa mistura de compostos orgânicos e inorgânicos, cuja composição varia com a vida do campo petrolífero.6-8 O impacto ambiental é avaliado pela toxicidade dos constituintes e pela quantidade de compostos presentes. Alguns destes constituintes permanecerão dissolvidos, enquanto outros são convertidos, seja por decomposição, evaporação, transformação em outro composto não tóxico, deposição no fundo do mar, etc. Os efeitos mais nocivos ao meio ambiente são aqueles associados aos compostos que permanecem solúveis após o descarte, por interagirem diretamente com a vida presente neste meio.
O nitrogênio na forma amoniacal é um poluente extremamente sério à vida aquática, pois é um nutriente de algas e outros microorganismos, reduzindo a concentração de O2 dissolvido e, também, é um dos responsáveis pelo fenômeno da eutrofização. O nitrogênio amoniacal engloba a forma gasosa NH3, denominada amônia, e a forma ionizada NH4+, denominada íon amônio. O equilíbrio estabelecido entre a amônia dissolvida e os íons amônio depende do pH da solução:9
A partir da constante de equilíbrio da Equação 1, pode-se obter a relação entre as concentrações das espécies para um determinado pH. Em valores de pH acima de 9,25 o equilíbrio é deslocado para a direita e a espécie NH3 é a predominante:
O aumento da força iônica do meio desfavorece a razão NH3/NH4+, implicando na necessidade de um aumento no pH para manutenção das mesmas relações.
A resolução nº 357 do Conselho Nacional do Meio Ambiente (CONAMA)10 limita a concentração do íon NH4+ a valores de 20 ppm em efluentes. Na água do mar, a concentração desse íon normalmente se encontra na faixa de 1 a 8 ppm, fato não verificado na região da Bacia de Campos, maior região produtora de petróleo do país. As águas provenientes da prospecção do petróleo contêm concentrações muito acima do valor permitido pela legislação, e o descarte dessa água no oceano leva a um desequilíbrio ecológico local.
Métodos de remoção do íon NH4+
Historicamente, as preocupações com a remoção do íon amônio de águas eram focadas para os efluentes urbanos (esgotos) e de áreas agrícolas. Na seqüência, essa preocupação se estendeu às águas de áreas rurais, especialmente aquelas contaminadas por fertilizantes agrícolas (tipo NPK) e dejetos animais e vegetais. Grosso modo, as tecnologias se dividem em processos eletroquímicos e não eletroquímicos: troca iônica, remoção por passagem de gás (air stripping), adsorção em carvão ativo, processos biológicos, oxidação química etc.11-14 A expansão para a área de águas produzidas em campos petrolíferos, principalmente em áreas offshore, é muito mais recente. Dentre os métodos baseados em fenômenos de adsorção, a troca iônica é muito utilizada por apresentar um custo efetivo relativamente baixo e por ser uma metodologia de execução bem simples.12,14-17
Dentre os vários trocadores iônicos, o uso de zeólitas é muito difundido. As zeólitas naturais ou sintéticas são os trocadores catiônicos inorgânicos mais importantes, possuindo outras características atraentes, como elevada abundância na natureza, possibilidade de alta seletividade para a troca desejada (mesmo que a capacidade de troca - média de 2,25 meq g-1 - não seja elevada),16 e compatibilidade ambiental.13,14 Nos últimos 30 anos, as características e propriedades de troca desses materiais foram bastante estudadas para definir aplicações práticas, como é o caso do tratamento de efluentes contendo compostos inorgânicos e/ou orgânicos.13,18 Dentre elas destaca-se a clinoptilolita, cuja fórmula de célula unitária pode ser descrita como (Na, K)6(Al6Si30O72 ).20 H2O19 ou (Na, K)6(AlO2)6(SiO2)30.24 H2O.12 Ela apresenta alta resistência térmica13 e uma suspensão desta zeólita em água pura não afeta o pH.20-22 Em 1967, foi demonstrado16 que a clinoptilolita tem particular preferência pelo íon NH4+, comparada com outros cátions tais como Ca2+ e Mg2+, quando uma solução contendo estas espécies é passada através de coluna contendo esta zeólita. Ela pode, inclusive, acomodar bactérias desnitrificantes, completando o processo de remoção de nitrogênio do efluente.11 Apesar de sua capacidade de troca ser inferior à de outras zeólitas naturais e sintéticas,14,23 sua alta seletividade para o íon NH4+ vem atraindo a atenção para seu emprego (desde a década de 70) no tratamento de efluentes,13,23,24 inclusive sob baixas temperaturas,24 e até mesmo na remediação de solos.19 Dependendo da origem da clinoptilolita, ela terá uma capacidade de retenção diferente para o íon NH4+, em função da presença de impurezas (especialmente, quartzo)14 e outros elementos que a acompanham. Mesmo assim, pesquisas mostram que a remoção do íon NH4+ no tratamento de água potável e de esgoto urbano pode ter eficiência superior a 97% m/m.16 A capacidade de troca da clinoptilolita é sensível à concentração de íons NH4+ no efluente, mas outros fatores também intervêm na eficiência do processo:21 tamanho de partícula, pré-tratamento da zeólita, condições operacionais e concentração de outros cátions que competem pelos sítios de troca. A ordem de seletividade16 para a clinoptilolita é: Cs+ > K+ > NH4+ > Sr 2+ > Na+ > Ca2+ > Fe3+ > Al3+ > Mg2+. O íon K+ é o principal competidor com o íon NH4+ pelos sítios de troca, posto que ambos têm praticamente o mesmo raio iônico.14,24 A literatura cita16,20,21,25,26 que a máxima eficiência de remoção de NH4+ é obtida quando os sítios intercambiáveis da clinoptilolita são convertidos para a forma sódica, basicamente com tratamento via solução de NaCl13,14,24 em pH abaixo de 724 ou em presença de NaOH (pH 11-12).13
Nos últimos anos vem se estudando o fenômeno da adsorção do íon NH4+ em águas produzidas por determinados tipos de zeólitas naturais.15,16 O desempenho do tratamento dessa água é afetado pelas seguintes condições:7,14,23,24,27 concentração de metais pesados e presença de complexos organometálicos; concentração de sais; presença de outras substâncias dissolvidas (produtos químicos adicionados); presença de óleo disperso e suspenso; pH e, temperatura. Alguns testes mostram que a clinoptilolita satura muito rapidamente para uma razão (em volume) água produzida/zeólita de 8:1,14-16 devido aos diversos cátions presentes nessa água. Estudos24,28 mostram que um ciclo de até dez regenerações (com soluções de NaOH) pode ser feito com sucesso, mas tal situação se aplica a amostras sintéticas e de efluentes urbanos. A natureza complexa e a variabilidade da composição das águas produzidas levam à necessidade de estudos de caso, o que determina uma seletividade diferenciada7 para um mesmo material de troca.
A presença do NaCl em grandes quantidades nas águas produzidas torna o rendimento da remoção do íon NH4+ baixo,27 embora a seletividade para este íon16 seja maior que para o Na+.
A avaliação da literatura mostra que as metodologias propostas, fundamentalmente, não foram desenvolvidas para tratamento das águas produzidas. O desempenho destas técnicas depende dramaticamente da qualidade (composição) da mesma. Isso exige um estudo de caso para cada amostra. A presença de uma grande variedade de constituintes de difícil tratamento, e com teores variáveis de amostra a amostra, contribui para a diminuição da eficiência dos diversos processos, uma vez que alguns deles também removem outros constituintes.14,24
Com base na relevância da origem das amostras a serem estudadas, este trabalho apresenta um estudo fundamental sobre a aplicação da técnica de troca iônica com a clinoptilolita, com o objetivo de remover o íon NH4+ de águas produzidas, para se obter uma idéia precisa sobre o nível de dificuldade de tratamento dessa amostra para enquadramento na legislação ambiental brasileira pertinente. A necessidade de encontrar soluções viáveis para tratamento da água produzida na Bacia de Campos torna este objetivo extremamente relevante para a realidade nacional.
PARTE EXPERIMETNAL
Descrição da água produzida
A água produzida utilizada nos experimentos é proveniente das diversas plataformas em operação na Bacia de Campos, sendo recebida no terminal marítimo de São Sebastião (litoral norte do estado de São Paulo). No terminal, o petróleo é separado da água produzida. Esta apresenta coloração marrom clara e odor característico da presença de tióis. A água é tratada para a remoção de óleos e graxas e sólidos em suspensão.
A Tabela 1 apresenta a composição média da água produzida utilizada neste trabalho. Os dados referem-se à água como foi recebida no terminal, ou seja, sem nenhum tratamento físico-químico aplicado a ela. Seu pH é 7,3, apresenta uma condutividade elétrica em torno de 7,64 µS cm-1, contém 3,83 g L-1 de sólidos totais dissolvidos, 1,8 ppm de fenóis e 15 ppm de óleos e graxas.
Pré-tratamento da água produzida
Considerando a possibilidade de saturação rápida da clinoptilolita pela água produzida,14-16 este pré-tratamento visava adsorver, ao menos em parte, compostos orgânicos e metais (entre eles os íons Na+, extremamente abundantes nessas águas), a fim de melhorar a eficiência da clinoptilolita em relação à remoção do íon NH4+ e aumentar sua vida útil.
A água produzida foi percolada em coluna contendo alumina (100 cm de altura e 2,54 cm de diâmetro), previamente lavada com água deionizada (3 vezes o volume da coluna). O experimento foi conduzido à temperatura ambiente, a uma vazão de 3,0 mL min-1 e fluxo descendente. Nas condições de ensaio, a coluna de alumina é capaz de tratar até 50 L de água produzida (aproximadamente 100 vezes o volume da coluna), e a saturação é visualizada pelo enegrecimento da alumina, sendo o processo interrompido quando a zona escura descia até 1 cm antes da base da coluna. O eluato era praticamente incolor e sem odor característico de tióis.
Meio adsorvente para o íon NH4+
A clinoptilolita (comercial) empregada possui, segundo dados do fabricante, capacidade de troca catiônica de 170 meq 100 g-1, superfície específica de 38,05 m2 g-1, capacidade de adsorção de amônia (ativado a 110 ºC) entre 42,5 e 50 g kg-1, e capacidade de adsorção de vapor de água de 130 g kg-1. A composição química está na Tabela 2, sendo obtida em nosso laboratório a partir de dados de análise quantitativa por fluorescência de raios-x (FRX).
Pré-tratamento da clinoptilolita
A clinoptilolita foi triturada em moinho de mandíbulas e peneirada; as faixas granulométricas 16-32 Mesh (0,50 1,00 mm), 32-48 Mesh (0,30 0,50 mm) e 48-80 Mesh (0,18 0,30 mm) foram selecionadas para os testes, pois representam mais de 95% m/m do produto triturado. A zeólita foi convertida à forma sódica. Empregaram-se três procedimentos para a conversão. No primeiro, ela foi tratada com uma solução de NaCl 0,6 mol L-1. No segundo, a zeólita foi tratada com NaOH (0,4 a 1,0 mol L-1), seguida de lavagem com água deionizada até pH 7. No terceiro, a zeólita foi tratada com NaOH 1 mol L-1, lavada com água deionizada até pH 7 e, a seguir, colocada em contato com NaCl 0,6 mol L-1. Este último procedimento visava detectar algum efeito sinérgico entre NaCl e NaOH em relação às trocas efetuadas com os reagentes isolados. As concentrações dos mesmos seguem valores relatados na literatura.13,14,21,24
Todos os procedimentos foram realizados em triplicata em béquer sob agitação (200 rpm) à temperatura ambiente, por 10 min (tempo obtido a partir de experimentos prévios, em que ocorre a troca limite dos cátions intercambiáveis da zeólita pelo íon Na+).
Retenção do íon NH4+ em leito fixo
A coluna de clinoptilolita preparada para essa finalidade tinha 48 cm de altura e diâmetro de 1,1 cm. Ela foi avaliada frente aos seguintes parâmetros: pré-tratamento de conversão da clinoptilolita à forma sódica; granulometria; vazão e sentido de fluxo: a vazão foi variada entre 1 e 10 mL min-1 (faixa normalmente citada na literatura),16,21,24 em fluxo ascendente ou descendente. Todos os experimentos foram conduzidos à temperatura ambiente.
Avaliação da interferência de cátions na retenção do NH4+
Considerada a composição média da água produzida empregada neste trabalho (Tabela 1), foram realizados alguns ensaios em leito fixo com águas sintéticas contendo os principais cátions numa concentração próxima àquela encontrada na amostra. A meta é melhor precisar o grau de interferência desses cátions na adsorção preferencial do íon NH4+ pela clinoptilolita: NaCl (~20.000 ppm Na+); KCl (~320 ppm K+); MgCl2 (~500 ppm Mg2+); NaCl + NH4Cl; KCl + NH4Cl; MgCl2 + NH4Cl; NaCl + KCl + NH4Cl. Quando da adição de NH4Cl, a concentração de NH4+ foi ajustada a ~100 ppm. Estes testes foram efetuados à temperatura ambiente sob fluxo ascendente de 3 mL min-1, com a zeólita na faixa granulométrica 0,30-0,50 mm e pré-tratada com NaOH 0,5 mol L-1.
Regeneração da clinoptilolita
O objetivo foi verificar se a zeólita perde a eficiência de adsorção do íon NH4+ quando é regenerada várias vezes. Nestes experimentos, conduzidos em leito fixo, a zeólita (faixa granulométrica 0,30-0,50 mm) foi convertida à forma sódica com NaOH 0,5 mol L-1. A seguir, percolou-se a água produzida no sentido ascendente com um fluxo de 3 mL min-1 até a saturação da clinoptololita. Após cada experimento, a clinoptilolita foi regenerada conforme o procedimento descrito acima para convertê-la à forma sódica e, a seguir, utilizada em uma nova experiência. A capacidade de retenção foi determinada através da quantificação do teor de NH4+ na amostra original e no eluato (medidor de pH com eletrodo íon-seletivo para NH4+).
Retenção do íon NH4+ em coluna de leito fluidizado
Considerando que a literatura praticamente não menciona estudos de remoção do íon NH4+ em leito fluidizado, foram feitos dois tipos de experimentos com este sistema. No primeiro, trabalhou-se em circuito fechado, com recirculação da fase aquosa; no segundo, os ensaios foram realizados sem recirculação da água produzida, em processo contínuo. Em ambos os casos, utilizou-se a clinoptilolita na faixa granulométrica 0,30-0,50 mm. A razão volume de leito/volume de solução foi fixada em 1/10, e a vazão da água produzida foi 184,5 mL min-1, correspondente a uma velocidade 1,5 vezes superior à velocidade mínima de fluidização. Utilizou-se um leito de vidro de 4 cm de diâmetro e 40 cm de altura, com um distribuidor feito de uma mistura de areia e araldite. A vazão da fase aquosa foi medida por um rotâmetro e a queda de pressão do sistema foi verificada por um tubo em U contendo mercúrio.
RESULTADOS E DISCUSSÃO
Influência do pré-tratamento da clinoptilolita na retenção do íon NH4+ em coluna de leito fixo
A Figura 1 apresenta a influência do pré-tratamento da clinoptilolita para a forma sódica pelos três procedimentos testados. Apesar do tratamento da zeólita com NaCl ser o procedimento geralmente adotado,14,24 o pré-tratamento com NaOH e NaCl foi mais eficiente. No caso da zeólita tratada apenas com NaOH, a variação da concentração entre 0,4 e 1,0 mol L-1 não apresentou diferença significativa na conversão para a forma sódica. Por outro lado, os pré-tratamentos da clinoptilolita com NaOH 0,5 mol L-1 + NaCl 0,6 mol L-1 e apenas com NaOH 0,5 mol L-1 apresentaram os mesmos resultados, indicando que a maior eficiência da troca está relacionada ao emprego da base. Isso confirma uma das estratégias adotadas no pré-tratamento da clinoptilolita (meio de NaOH13), com a diferença da não necessidade do emprego de NaCl.
Influência das condições operacionais na retenção do íon NH4+ em coluna de leito fixo
Granulometria
A Figura 2 mostra que os melhores resultados de retenção em leito fixo foram obtidos com a faixa granulométrica intermediária (0,30-0,50 mm), aparentemente representando um equilíbrio entre a troca iônica (retenção do íon NH4+) e fenômenos que reduzem essa troca iônica, como a oclusão dos sítios de troca por partículas finas e a adsorção de outros componentes da água produzida sobre esses sítios. A literatura aponta que a redução do tamanho de partícula favorece a retenção do íon NH4+ de efluentes urbanos e sintéticos até o limite onde fenômenos difusionais e de oclusão por partículas limitam (ou reduzem) a troca iônica.14,24
Vazão de eluição
A influência da vazão (fluxo ascendente) para a faixa granulométrica 0,30-0,50 mm está ilustrada na Figura 3. Os melhores resultados foram obtidos para a vazão de 3 mL min-1. Para vazões de 5 e 10 mL min-1, as concentrações do íon NH4+ no eluato final foram muito próximas, e um pouco maiores que com vazão de 3 mL min-1. Valores acima de 10 mL min-1 levaram à queda acentuada da retenção desse íon, pelo não estabelecimento do equilíbrio de troca na coluna. Valores abaixo de 3 mL min-1 tornam o processo demasiado lento para que tenha interesse prático.
Direção de fluxo
Para os experimentos com a clinoptilolita na faixa granulométrica 0,30-0,50 mm e fluxo ascendente de 3 mL min-1, os valores da concentração do íon NH4+ no eluato foram um pouco menores que as verificadas sob fluxo descendente (Figura 4). Num fluxo ascendente (contrário à gravidade), nas mesmas condições operacionais, há menor risco de haver caminhos preferenciais e maior possibilidade de contato do líquido com a superfície de troca que no sentido descendente,29 sendo particularmente válido para baixas vazões (tipicamente, < 10 mL min-1).29
Interferência de cátions na retenção do íon NH4+ em coluna de leito fixo
Os resultados da Tabela 3 indicam que o íon Na+ é o cátion que mais interfere na retenção, por conta de sua elevada concentração nas amostras, confirmando comportamento citado na literatura.27 Entretanto, o cátion K+ é bastante adsorvido, conforme a semelhança de seus raios iônicos;14,24 da mesma forma, a influência do íon Mg2+ sobre a retenção do íon NH4+ é muito pequena, em conformidade com a série preferencial de adsorção de cátions da clinoptilolita.16
Eficiência dos ciclos regenerativos da clinoptilolita em coluna de leito fixo
A Tabela 4 mostra a comparação entre as curvas de saturação da zeólita regenerada até nove vezes.
A capacidade da clinoptilolita de reter o íon NH4+ diminuiu com o incremento do número de regenerações, ainda que a variação do desempenho seja irregular ao longo dos ciclos regenerativos. Enquanto que com uma zeólita nova é possível reduzir a concentração desse íon a valores abaixo de 5 ppm empregando até um volume de amostra correspondente a 11 vezes o volume de leito, este valor caiu para 6 vezes após 10 utilizações, indicando que parte dos sítios de troca foi bloqueado por outros componentes da água produzida que não foram removidos ao longo da etapa de regeneração da zeólita com NaOH. Esses componentes são, ao menos em parte, compostos orgânicos que não foram removidos quando do pré-tratamento da água produzida em coluna de alumina: a calcinação da clinoptilolita regenerada nove vezes a 800 ºC por 5 h em mufla e passagem do efluente gasoso em solução de Ba(OH)2 0,2 mol L-1 indicou a formação de carbonato de bário (BaCO3).
Os ciclos de regeneração da clinopitilolita levam à produção de efluentes. A neutralização dos mesmos com H2SO4 1 mol L-1 não gerou precipitado, mas apresentou características redutoras frente ao KMnO4 (descoramento da cor violeta e formação de precipitado de MnO2) e ao H2O2, devido provavelmente a substâncias orgânicas dessorvidas da coluna. Isso implica numa etapa suplementar de oxidação desses efluentes, a fim de enquadrá-los nas normas da Resolução 357/05 do CONAMA.10 Na escala de laboratório, o tratamento com KMnO4 0,1 mol L-1 (0,2 mL para cada 1 mL de efluente tratado) foi suficiente. Numa escala maior, é mais adequado empregar o H2O2, que tem a vantagem de não gerar resíduos finais. A clinoptilolita, após esgotamento de sua vida útil, bem como a coluna de alumina empregada no pré-tratamento da água produzida, podem, a princípio, ser enviadas a co-processamento, em conformidade com a Resolução 264/99 do CONAMA.30
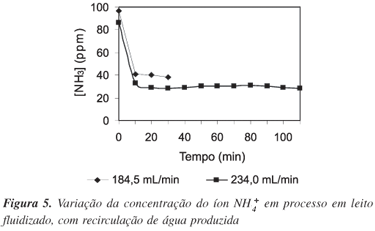
Retenção do íon NH4+ em leito fluidizado com recirculação de água produzida
Os resultados obtidos nestes experimentos (Figura 5) mostram que o equilíbrio foi atingido rapidamente, uma vez que a concentração inicial do íon NH4+ diminuiu até um determinado valor, permanecendo constante a partir daí. O processo de adsorção em leito fluidizado é mais rápido que em leito fixo. Contudo, os resultados alcançados com esta configuração não foram satisfatórios, uma vez que a concentração média do íon NH4+ alcançada no equilíbrio foi muito superior a 20 ppm, inaceitável em termos de valor limite estipulado na resolução 357/05 do CONAMA.10 Mesmo o aumento da vazão para 234,0 mL min-1 (1,9 vezes a velocidade mínima de fluidização) não melhorou o resultado final (Figura 5).
Retenção do íon NH4+ em leito fluidizado em sistema contínuo
Os resultados apresentados na Figura 6 indicam que o desempenho do sistema com esta configuração, sob as condições experimentais deste trabalho, também não foi capaz de reter o íon amônio de maneira eficiente, visto que sua concentração aumentou rapidamente com o tempo.
CONCLUSÕES
A remoção do íon amônio de águas produzidas empregando a clinoptilolita foi capaz de reduzir a concentração desta espécie a valores abaixo de 5 ppm, empregando um sistema em leito fixo, com granulometria na faixa 0,30-0,50 mm, em fluxo ascendente de 3 mL min-1, à temperatura ambiente. Foi possível tratar um volume de amostra equivalente a 11 vezes o volume da coluna, obtendo-se um eluato com menos de 5 ppm de NH4+. Os resultados empregando processos em leito fluidizado foram muito menos satisfatórios, obtendo-se efluentes tratados que não se enquadram dentro das restrições da Resolução 357/05 do CONAMA.
A grande dificuldade no emprego da clinoptilolita é o pré-tratamento da água produzida; apesar desta etapa, não se evitou a perda da capacidade de adsorção do íon amônio com sucessivas regenerações da zeólita, devido ao bloqueio de parte dos sítios de troca por outros componentes da água. Embora a clinoptilolita usada possa, a princípio, ser co-processada, o tratamento dos efluentes oriundos de sua regeneração exige a eliminação do caráter redutor dos mesmos para enquadramento nas normas ambientais vigentes.
REFERÊNCIAS
1. Huang, J. S.; Varadaraj, R.; J. Colloid Interface Sci. 1996, 1, 535.
2. Ali, S. A.; Darlington, L. W.; Occapinti, J.; New filtration process cuts contaminants from offshore produced water, Oil & Gas Journal, Novembro 1998, p. 73.
3. Thomas, J. E.; Fundamentos de Engenharia de Petróleo, Editora Interciência: Rio de Janeiro, 2001, vol. 9, p. 255-267.
4. Lucas, E. F.; Barbosa, C. C. R.; Carvalho, M. S.; Estudo do Tratamento de Água Produzida com Membranas Poliméricas, Relatório final do projeto CT-PETRO-1301, 2001.
5. Guida, J. W.; Fruge, D. E.; Improved wastewater treatment, Hydrocarbon Processing, Agosto 1995, p. 55.
6. Stephenson, M. T.; J. Petr. Tech. 1992, 44, 548.
7. Hansen, B. R., Davies, S. R. H.; Trans. Inst. Chem. Eng. 1994, 72, 176.
8. Stephenson, M. T.; J. Petr. Tech. 1992, 44, 602.
9. Connel, D. W.; Basic Concepts of Environmental Chemistry, Lewis Publishers: Nova Iorque, 1997, vol. 5, p. 107-124.
10. Resolução nº 357 do Conselho Nacional do Meio Ambiente, 17/03/2005, Diário Oficial da União, 18/03/2005.
11. Lubin, M.; Otten, S.; US pat. 5,614,078 1997.
12. Karadag, D.; Koc, Y.; Turan, M.; Armagan, B.; J. Hazard. Mater. 2006, 136B, 604.
13. Ji, Z. Y.; Yuan, J. S.; Li, X. G.; J. Hazard. Mater. 2007, 141, 483; Aguiar, M. R. M. P. de; Novaes, A. C.; Guarino, A. W. S.; Quim. Nova 2002, 25, 1145; Fungaro, D. A.; Silva, M. G. da; Quim. Nova 2002, 25, 1081; Pergher, S. B. C.; Caovilla, M.; Detoni, C.; Machado, N. R. C. F.; Quim. Nova 2005, 28, 397; Pergher, S. B. C.; Oliveira, L. C. A.; Smaniotto, A.; Petkowicz, D. I.; Quim. Nova 2005, 28, 751.
14. Wang, Y. F.; Lin, F.; Pang, W. Q.; J. Hazard. Mater. 2007, 142, 160.
15. Mc Veight, R.; Weartherley, L.; Water Sci. Technol. 1999, 40, 143.
16. Inglezakis, V.J.; Hadjiandreou, K. J.; Loizidou, M. D.; Water Res. 2001, 35, 2161.
17. Wang, Y.; Liu, S.; Xu, Z.; Han, T.; Chuan, S.; Zhu, T.; J. Hazard. Mater. 2006, 136B, 735.
18. Park, J. B.; Lee, S. H.; Lee, J. W.; Lee, C. Y.; J. Hazard. Mater. 2002, 95B, 65; Fungaro, D. A.; Izidoro, J. C.; Quim. Nova 2006, 29, 735; Freire, R. S.; Pelegrini, R.; Kulota, L. T.; Duran, N.; Peralta-Zamora, P.; Quim. Nova 2000, 23, 504.
19. Dyer, A.; White, K. J.; Thermochim. Acta 1999, 340-1, 341.
20. Papadopoulos, A.; Kapetaneous, E. G.; Loizidou, M. D.; J. Environ. Sci. Health 1996, 31, 211.
21. Gonzalez, M. C. G.; Dissertação de Mestrado, Universidad Autónoma del Universidad del Mexico, México, 2002.
22. http://mineral.galleries.com/minerals/silicate/clinopti/clinopti.htm, acessada em Maio 2007.
23. Weatherley, L. R.; Miladinovic, N. D.; Water Res. 2004, 38, 4305.
24. Sprynskyy, M.; Lebedynets, M.; Terzyk, A. P.; Kowakzyk, P.; Namiesnik, J.; Buszewski, B.; J. Colloid Interface Sci. 2005, 284, 408.
25. Loizidou, M. D.; Townsend, R. P.; Zeolites 1984, 4, 191.
26. Loizidou, M. D.; Townsend, R. P.; Zeolites 1987, 7, 153.
27. Queiros, Y. G. C.; Clarisse, M. D.; Oliveira, R. S.; Reis, B. D.; Lucas, E. F.; Louvisse, A. M. T.; Polímeros, Ciência e Tecnologia 2006, 16, 224; Clarisse, M. D.; Tese de Doutorado, Universidade Federal do Rio de Janeiro, Brasil, 2005.
28. Sarioglu, M.; Sep. Purif. Technol. 2005, 41, 1.
29. Ohlweiler, O. A.; Química Analítica Quantitativa, 2ª ed., Livros Técnicos e Científicos: Rio de Janeiro, 1980, cap. 13-10; Inglezakis, V. I.; Poulopoulos, S. G.; Adsorption, Ion Exchange and Catalysis, Elsevier: Amsterdam, 2006, cap. 4.
30. Resolução 264 do Conselho Nacional do Meio Ambiente, 26/08/1999, Diário Oficial da União, 22/03/2000.
Recebido em 12/6/07; aceito em 30/8/07; publicado na web em 2/4/08
- 1. Huang, J. S.; Varadaraj, R.; J. Colloid Interface Sci 1996, 1, 535.
- 2. Ali, S. A.; Darlington, L. W.; Occapinti, J.; New filtration process cuts contaminants from offshore produced water, Oil & Gas Journal, Novembro 1998, p. 73.
- 3. Thomas, J. E.; Fundamentos de Engenharia de Petróleo, Editora Interciência: Rio de Janeiro, 2001, vol. 9, p. 255-267.
- 4. Lucas, E. F.; Barbosa, C. C. R.; Carvalho, M. S.; Estudo do Tratamento de Água Produzida com Membranas Poliméricas, Relatório final do projeto CT-PETRO-1301, 2001.
- 5. Guida, J. W.; Fruge, D. E.; Improved wastewater treatment, Hydrocarbon Processing, Agosto 1995, p. 55.
- 6. Stephenson, M. T.; J. Petr. Tech 1992, 44, 548.
- 7. Hansen, B. R., Davies, S. R. H.; Trans. Inst. Chem. Eng. 1994, 72, 176.
- 8. Stephenson, M. T.; J. Petr. Tech 1992, 44, 602.
- 9. Connel, D. W.; Basic Concepts of Environmental Chemistry, Lewis Publishers: Nova Iorque, 1997, vol. 5, p. 107-124.
- 10. Resolução nş 357 do Conselho Nacional do Meio Ambiente, 17/03/2005, Diário Oficial da União, 18/03/2005.
- 11. Lubin, M.; Otten, S.; US pat. 5,614,078 1997
- 12. Karadag, D.; Koc, Y.; Turan, M.; Armagan, B.; J. Hazard. Mater. 2006, 136B, 604.
- 13. Ji, Z. Y.; Yuan, J. S.; Li, X. G.; J. Hazard. Mater 2007, 141, 483;
- Aguiar, M. R. M. P. de; Novaes, A. C.; Guarino, A. W. S.; Quim. Nova 2002, 25, 1145;
- Fungaro, D. A.; Silva, M. G. da; Quim. Nova 2002, 25, 1081;
- Pergher, S. B. C.; Caovilla, M.; Detoni, C.; Machado, N. R. C. F.; Quim. Nova 2005, 28, 397;
- Pergher, S. B. C.; Oliveira, L. C. A.; Smaniotto, A.; Petkowicz, D. I.; Quim. Nova 2005, 28, 751.
- 14. Wang, Y. F.; Lin, F.; Pang, W. Q.; J. Hazard. Mater. 2007, 142, 160.
- 15. Mc Veight, R.; Weartherley, L.; Water Sci. Technol. 1999, 40, 143.
- 16. Inglezakis, V.J.; Hadjiandreou, K. J.; Loizidou, M. D.; Water Res 2001, 35, 2161.
- 17. Wang, Y.; Liu, S.; Xu, Z.; Han, T.; Chuan, S.; Zhu, T.; J. Hazard. Mater. 2006, 136B, 735.
- 18. Park, J. B.; Lee, S. H.; Lee, J. W.; Lee, C. Y.; J. Hazard. Mater. 2002, 95B, 65;
- Fungaro, D. A.; Izidoro, J. C.; Quim. Nova 2006, 29, 735;
- Freire, R. S.; Pelegrini, R.; Kulota, L. T.; Duran, N.; Peralta-Zamora, P.; Quim. Nova 2000, 23, 504.
- 19. Dyer, A.; White, K. J.; Thermochim. Acta 1999, 340-1, 341.
- 20. Papadopoulos, A.; Kapetaneous, E. G.; Loizidou, M. D.; J. Environ. Sci. Health 1996, 31, 211.
- 21. Gonzalez, M. C. G.; Dissertação de Mestrado, Universidad Autónoma del Universidad del Mexico, México, 2002.
- 22. http://mineral.galleries.com/minerals/silicate/clinopti/clinopti.htm, acessada em Maio 2007.
» link - 23. Weatherley, L. R.; Miladinovic, N. D.; Water Res. 2004, 38, 4305.
- 24. Sprynskyy, M.; Lebedynets, M.; Terzyk, A. P.; Kowakzyk, P.; Namiesnik, J.; Buszewski, B.; J. Colloid Interface Sci. 2005, 284, 408.
- 25. Loizidou, M. D.; Townsend, R. P.; Zeolites 1984, 4, 191.
- 26. Loizidou, M. D.; Townsend, R. P.; Zeolites 1987, 7, 153.
- 27. Queiros, Y. G. C.; Clarisse, M. D.; Oliveira, R. S.; Reis, B. D.; Lucas, E. F.; Louvisse, A. M. T.; Polímeros, Ciência e Tecnologia 2006, 16, 224;
- Clarisse, M. D.; Tese de Doutorado, Universidade Federal do Rio de Janeiro, Brasil, 2005.
- 28. Sarioglu, M.; Sep. Purif. Technol. 2005, 41, 1.
- 29. Ohlweiler, O. A.; Química Analítica Quantitativa, 2Ş ed., Livros Técnicos e Científicos: Rio de Janeiro, 1980, cap. 13-10;
- Inglezakis, V. I.; Poulopoulos, S. G.; Adsorption, Ion Exchange and Catalysis, Elsevier: Amsterdam, 2006, cap. 4.
- 30. Resolução 264 do Conselho Nacional do Meio Ambiente, 26/08/1999, Diário Oficial da União, 22/03/2000.
Datas de Publicação
-
Publicação nesta coleção
12 Set 2008 -
Data do Fascículo
2008
Histórico
-
Revisado
30 Ago 2007 -
Recebido
12 Jun 2007 -
Aceito
02 Abr 2008