Resumos
O bloqueio da produção do óxido nítrico durante endotoxinemia permanece controvertido. Visando avaliar o efeito do bloqueio do óxido nítrico na microcirculação hepática, ratos Sprague-Dawley machos receberam LPS e depois de 2h foram tratados com L-NAME (10 mg/kg, n=6) ou solução salina (NS, n=7). A perfusão sinusoidal foi avaliada pela microscopia intravital, sangue foi colhido das veias hepáticas para determinação do equilíbrio ácido-básico, e a bile produzida durante todo o experimento foi mensurada. Depois de 1h de tratamento L-NAME acentuou a falência da perfusão sinusoidal induzida pelo LPS (p < 0.05 vs NS), acentuando a acidose no sangue efluente hepático (p < 0.05 vs NS), enquanto o fluxo biliar apresentou uma redução adicional (L-NAME 2.0 ± 0.5 vs NS 2.4 ± 0.1 <FONT FACE="Symbol">m</font>l/g/min). O bloqueio não-seletivo do óxido nítrico na endotoxinemia aumenta a falência da perfusão sinusoidal, piora o equilíbrio ácido-básico do fígado e tende a acentuar a deficiência da função excretora.
Óxido nítrico; Microcirculação hepática; Perfusão sinusoidal
The blockade of NO production during endotoxemia remains controversial. To evaluate the effect of NO blockade on the liver microcirculation, Sprague-Dawley male rats received LPS and 2h after they were treated by injections of L-NAME (10 mg/kg BW, n=6) or normal saline (NS, n=7). Intravital microscopy (IVM) assessed sinusoidal perfusion, blood samples were taken from the hepatic vein to determine base excess, and bile was collected. After 1h treatment L-NAME increased the LPS-induced sinusoidal perfusion failure (p < 0.05 vs NS), accentuated the acidosis in the hepatic blood effluent (p < 0.05 vs NS), while bile flow was further reduced (L-NAME 2.0 ± 0.5 vs NS 2.4 ± 0.1 <FONT FACE="Symbol">m</font>l/g/min). Non-selective NO blockade in endotoxemia enhances the sinusoidal perfusion failure, impairs acid-basic status of the liver and shows a tendency of impairment of the excretory function.
Nitric oxide; Hepatic microcirculation; Sinusoidal perfusion
BLOQUEIO DO ÓXIDO NÍTRICO COM L-NAME COMPROMETE A MICROCIRCULAÇÃO HEPÁTICA DURANTE ENDOTOXINEMIA1 1 Trabalho realizado no Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 2 Professor Adjunto do Departamento de Ciências Morfológicas da UFRGS. 3 Médico do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 4 Pesquisadora do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 5 Professor Pesquisador do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 6 Professor e Diretor do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 7 Professor Catedrático de Cirurgia Experimental e Diretor do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha.
Carlos Otavio Corso2 1 Trabalho realizado no Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 2 Professor Adjunto do Departamento de Ciências Morfológicas da UFRGS. 3 Médico do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 4 Pesquisadora do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 5 Professor Pesquisador do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 6 Professor e Diretor do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 7 Professor Catedrático de Cirurgia Experimental e Diretor do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha.
Yngvar Gundersen3 1 Trabalho realizado no Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 2 Professor Adjunto do Departamento de Ciências Morfológicas da UFRGS. 3 Médico do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 4 Pesquisadora do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 5 Professor Pesquisador do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 6 Professor e Diretor do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 7 Professor Catedrático de Cirurgia Experimental e Diretor do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha.
Martina Dörger4 1 Trabalho realizado no Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 2 Professor Adjunto do Departamento de Ciências Morfológicas da UFRGS. 3 Médico do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 4 Pesquisadora do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 5 Professor Pesquisador do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 6 Professor e Diretor do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 7 Professor Catedrático de Cirurgia Experimental e Diretor do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha.
Per Lilleaasen5 1 Trabalho realizado no Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 2 Professor Adjunto do Departamento de Ciências Morfológicas da UFRGS. 3 Médico do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 4 Pesquisadora do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 5 Professor Pesquisador do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 6 Professor e Diretor do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 7 Professor Catedrático de Cirurgia Experimental e Diretor do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha.
Ansgar Aasen6 1 Trabalho realizado no Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 2 Professor Adjunto do Departamento de Ciências Morfológicas da UFRGS. 3 Médico do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 4 Pesquisadora do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 5 Professor Pesquisador do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 6 Professor e Diretor do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 7 Professor Catedrático de Cirurgia Experimental e Diretor do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha.
Konrad Messmer7 1 Trabalho realizado no Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 2 Professor Adjunto do Departamento de Ciências Morfológicas da UFRGS. 3 Médico do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 4 Pesquisadora do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha. 5 Professor Pesquisador do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 6 Professor e Diretor do Instituto para Pesquisa Cirúrgica, Universidade de Oslo, Noruega. 7 Professor Catedrático de Cirurgia Experimental e Diretor do Instituto para Pesquisa Cirúrgica, Universidade Ludwig-Maximilians, Munique, Alemanha.
Corso CO, Gundersen Y, Dörger M, Lilleaasen P, Aasen A, Messmer K. Bloqueio do óxido nítrico com L-Name compromete a microcirculação hepática durante endotoxinemia. Acta Cir Bras [serial online] 1999 Apr Jun; 14(2). Available from: URL: http://www.scielo.br/acb.
RESUMO: O bloqueio da produção do óxido nítrico durante endotoxinemia permanece controvertido. Visando avaliar o efeito do bloqueio do óxido nítrico na microcirculação hepática, ratos Sprague-Dawley machos receberam LPS e depois de 2h foram tratados com L-NAME (10 mg/kg, n=6) ou solução salina (NS, n=7). A perfusão sinusoidal foi avaliada pela microscopia intravital, sangue foi colhido das veias hepáticas para determinação do equilíbrio ácido-básico, e a bile produzida durante todo o experimento foi mensurada. Depois de 1h de tratamento L-NAME acentuou a falência da perfusão sinusoidal induzida pelo LPS (p < 0.05 vs NS), acentuando a acidose no sangue efluente hepático (p < 0.05 vs NS), enquanto o fluxo biliar apresentou uma redução adicional (L-NAME 2.0 ± 0.5 vs NS 2.4 ± 0.1 ml/g/min). O bloqueio não-seletivo do óxido nítrico na endotoxinemia aumenta a falência da perfusão sinusoidal, piora o equilíbrio ácido-básico do fígado e tende a acentuar a deficiência da função excretora.
DESCRITORES: Óxido nítrico. Microcirculação hepática. Perfusão sinusoidal.
INTRODUÇÃO
O comprometimento da função hepática é um achado comum em pacientes com patologia infecciosa grave1. A severidade e a recuperação da falência orgânica múltipla induzida pela sepsis são influenciadas de maneira decisiva pela existência e grau de disfunção hepática2.
Os baixos níveis de endotoxina normalmente encontrados no sistema porta parecem modular a função das células de Kupffer e a perfusão microvascular do fígado3. Todavia, em situações patológicas as endotoxinas induzem sério dano hepático devido à ativação das células de Kupffer, acumulação leucocitária e falência da perfusão sinusoidal. As células de Kupffer e os polimorfonucleares neutrófilos liberam um largo espectro de mediadores, os quais são considerados o evento principal no comprometimento crescente da perfusão sinusoidal hepática4. As endotoxinas alteram profundamente a produção do Óxido Nítrico (NO). A produção exagerada do NO na endotoxinemia é considerada como causa das alterações circulatórias, como a hipotensão e a irresponsividade a vasoconstritores. Portanto, o bloqueio da produção do NO poderia ser decisivo na reversão da disfunção cardíaca e na irresponsividade circulatória, melhorando assim o suprimento sangüíneo aos órgãos e contribuindo para a resolução do quadro séptico.
Este estudo foi realizado visando elucidar os efeitos do bloqueio não seletivo do óxido nítrico sobre a perfusão microvascular hepática, e as conseqüências imediatas sobre o equilíbrio ácido básico e a função excretória do fígado, em um modelo animal de endotoxinemia.
MÉTODO
Modelo. Ratos Sprague-Dawley machos (Peso médio 205 ± 6 g) foram anestesiados com a-cloralose (20 mg/kg/h) por via endovenosa, traqueostomizados e ventilados mecanicamente. A artéria carótida direita e a veia jugular direita foram canuladas, e o cateter venoso foi introduzido através da veia cava superior e coração, até atingir uma das veias hepáticas. Os cateteres permitiram a obtenção de dados hemodinâmicos (Pressão arterial média - PAM e freqüência cardíaca - FC), injeção do marcador fluorescente e coleta de amostras sangüíneas para dosagens laboratoriais. Foi realizada laparotomia transversa, o fígado foi liberado de seus ligamentos e o ducto colédoco cateterizado. A bile foi coletada durante todo o experimento, pesada e expressa em ml/g fígado/min, servindo como um índice de função hepática5. Um cateter adicional foi colocado na veia porta, através de uma veia mesentérica, sendo utilizado para a administração de lipopolissacarídeo (LPS) e de drogas.
Microscopia Fluorescente Intravital. O lobo esquerdo do fígado foi cuidadosamente rotado e exteriorizado, sendo posicionado sobre um suporte especialmente concebido para este fim, com a sua superfície visceral voltada para cima. Em todos os experimentos houve o cuidado de evitar-se qualquer comprometimento ao fluxo vascular, condição obrigatória para o seu prosseguimento. O lobo esquerdo foi coberto com uma lamínula, e o restante do fígado e abdome com uma película plástica, para evitar perda de calor e líquido. O animal foi posicionado sob o microscópio conectado a uma lâmpada de mercúrio de 100 W com iluminador, visando a microscopia por epi-iluminação. Através de uma câmera de vídeo (FK 6990, COHU, Prospective Measurements, San Diego, EUA) as imagens magnificadas do fígado (540X) foram observadas em um monitor de televisão e gravadas em um sistema de vídeo (S-VHS Panasonic AG 7330, Matsushita, Tóquio, Japão). A contagem do tempo foi superimposta através de um gerador (VTG 33, FOR-A Company, Tóquio, Japão). A fluoresceína sódica (2 mmol/kg ev), que se liga às proteínas plasmáticas, foi utilizada para visualização da perfusão sinusoidal com auxílio de um filtro específico (comprimento de onda de 450-490nm e > 515 nm, respectivamente para excitação e emissão), que foi quantificada por análise off-line, quadro a quadro, das imagens gravadas. Os resultados são expressos em sinusoides não perfundidos, como percentual do número total de sinusoides visualizados.
Protocolo Experimental. Após a conclusão da preparação e 30 minutos adicionais para estabilização, as medidas hemodinâmicas e a microscopia intravital basal foram gravadas, sendo também obtidas amostras sanguíneas. O LPS (E. coli O128:B12, Sigma, St. Louis, EUA) foi injetado na veia porta (5 mg/kg em 10 min), e novas medidas e amostras sangüíneas foram obtidas 2 horas após a injeção do LPS. Na sequência os animais foram divididos, de maneira randomizada, para o tratamento a ser instituído: NG -nitro-L-arginina metil ester (L-NAME, 10 mg/kg, n=6) ou um volume idêntico de solução salina (NS, 1 ml/kg, n=7), que foram injetados em bolo na veia porta. Depois de 1 h de tratamento foram realizadas as determinações finais, os animais foram sacrificados, e os seus fígados removidos e pesados.
Estatística. Os resultados são apresentados como média e erro padrão. As diferenças entre os grupos foram testadas utilizando-se o teste T de Sudent, e o nível de significância foi estabelecido em 0,05. As correlações foram realizadas pelo método de Spearman, e a significância igualmente situada em 0,05.
RESULTADOS
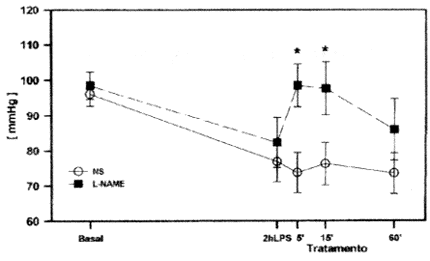
Não houve diferença significativa entre os grupos em condições basais com relação à PAM (fig. 1), e ambos os grupos apresentaram uma queda de aproximadamente 20% 2 h após a administração do LPS.
Pressão arterial média em condições basais, após 2h da infusão de LPS, e após 5, 15 e 60 min de tratamento com solução salina (NS, circulos, n=7) e NG-nitro-L-arginina metil ester (L-NAME, quadrados, n=6). * P < 0,05 vs NS.
O tratamento com L-NAME resultou num aumento significativo da PAM após 5 e 15 min, quando comparado com a solução salina. Após 1 h de tratamento os dois grupos apresentavam PAM equivalente.
Em condições basais, menos de 1% dos sinusoides apresentavam-se sem perfusão (fig. 2).
- Sinusóides não perfundidos (expressos em percentual de todos os sinusóides visualizados) em condições basais, após 2h da infusão de LPS, e após 1h de tratamento com solução salina (NS, circulos, n=7) e NG-nitro-L-arginina metil ester (L-NAME, quadrados, n=6). * P < 0,05 vs NS.
O LPS induziu um forte aumento no número de sinusoides não perfundidos 2 h após a sua administração. Após o tratamento a falência da perfusão sinusoidal continuou a progredir, mas foi claramente mais intensa nos animais que receberam L-NAME (26,5 ± 2,5% vs NS 19,3 ± 1,8% dos sinusoides não perfundidos, p < 0,05). Depois de 2 h da infusão do LPS, o sangue efluente hepático mostrava uma acidose moderada (fig. 3), que se tornou mais acentuada após 1 h de tratamento com L-NAME (-12,1 ± 1,6 vs NS -9,0 ± 0,8 mmol/l, p < 0.05).
- Fluxo biliar em condições basais, após 2h da infusão de LPS, e após 1h de tratamento com solução salina (NS, circulos, n=7) e NG-nitro-L-arginina metil ester (L-NAME, quadrados, n=6).
O fluxo biliar era superior a 3 ml/g/min em condições basais (fig. 4).
- Excesso de base em condições basais, após 2h da infusão de LPS, e após 1h de tratamento com solução salina (NS, circulos, n=7) e NG-nitro-L-arginina metil ester (L-NAME, quadrados, n=6). * P < 0,05 vs NS.
Duas horas de exposição à endotoxina resultou numa redução de cerca de 15%, e o tratamento levou a uma queda adicional em ambos os grupos (L-NAME 2,0 ± 0,5 vs NS 2,4 ± 0,1 ml/g/min), todavia sem que houvesse diferença significativa entre ambos.
As seguintes correlações foram observadas após 1 h de tratamento da endotoxinemia com NS e L-NAME:
Perfusão sinusoidal x Fluxo biliar r = -0,79 p < 0.01
Perfusão sinusoidal x Excesso de base r = -0,56 p < 0.05
Excesso de base x Fluxo biliar r = 0,77 p < 0.01
DISCUSSÃO
Os resultados obtidos indicam que os efeitos iniciais do bloqueio não-seletivo do NO durante as fases iniciais da endotoxinemia são extremamente deletérios. Pode-se constatar claramente um prejuizo adicional da perfusão sinusoidal já comprometida pela endotoxina, suportando o ponto de vista de que o óxido nítrico desempenha um papel importante na preservação da perfusão microvascular nutritiva do fígado6,7. De maneira correspondente, a falência da perfusão tem relação direta com o déficit na função excretora hepática e com a acentuação da acidose no efluente sangüíneo hepático .
A elevação instantânea da PAM após a injeção de L-NAME está relacionada com aumento da resistência vascular periférica, favorecendo uma subsequente redução do débito cardíaco e também do aporte de sangue arterial ao fígado7. Durante a endotoxinemia o NO parece também determinar um efeito benéfico, pelo fato de evitar uma queda suplementar do fluxo sanguíneo total ao fígado, devido à ausência de uma resposta adequada do sistema tampão da artéria hepática8.
Os efeitos prejudiciais da endotoxina no fígado parecem ocorrer principalmente nos sinusóides, devido à ativação das células de Kupffer e liberação de citocinas pró-inflamatórias, como TNF-a e Il-19. Edema perisinusoidal, hematócrito microvascular local elevado e edema de células endoteliais levam a uma dificuldade crescente do fluxo nos sinusóides, favorecendo a estagnação de polimorfonucleares neutrófilos ativados e plaquetas, que por sua vez pode ser reforçada ainda mais pelo bloqueio do óxido nítrico6,10,11. Juntamente com estes fatores físicos, existem evidências indicando a liberação de grandes quantidades de substâncias vasoconstritoras durante endotoxinemia12. Desta forma, é bastante provável que o bloqueio não-seletivo do NO possa produzir um agravamento adicional do dano microvascular, devido a um desequilíbrio entre agentes vasodilatadores e vasoconstritores, tendendo à vasoconstrição da microcirculação13. Nosso estudo corrobora estas evidências, revelando um grande aumento do número de sinusóides não-perfundidos depois da administração de L-NAME. Mais ainda, nossos resultados indicam que a progressão da disfunção microvascular está claramente relacionada com o comprometimento no equilíbrio ácido-básico hepático e tendência de redução do fluxo biliar.
Os altos níveis de NO circulantes encontrados durante endotoxinemia têm sido considerados como a origem de importantes distúrbios fisiopatológicos, como hipotensão arterial e citotoxicidade, devido à expressão aumentada da iNOS11. Entretanto, a produção aumentada do óxido nítrico deveria ser vista preferencialmente como uma tentativa exagerada de manter um aporte microvascular adequado, e a manipulação da produção do óxido nítrico deve ser realizada com grande cautela, provavelmente levando-se em conta um bloqueio seletivo da iNOS.
CONCLUSÃO
O bloqueio não-seletivo do óxido nítrico produzido pela L-NAME compromete a microcirculação hepática, acentua o desequilíbrio ácido-básico do fígado e tem tendência a diminuir a função excretora.
Corso CO, Gundersen Y, Dörger M, Lilleaasen P, Aasen A, Messmer K. Blockade of NO with L-NAME jeopardize hepatic microcirculation during endotoxemia. Acta Cir Bras [serial online] 1999 Apr Jun; 14(2). Available from: URL: http://www.scielo.br/acb.
SUMMARY: The blockade of NO production during endotoxemia remains controversial. To evaluate the effect of NO blockade on the liver microcirculation, Sprague-Dawley male rats received LPS and 2h after they were treated by injections of L-NAME (10 mg/kg BW, n=6) or normal saline (NS, n=7). Intravital microscopy (IVM) assessed sinusoidal perfusion, blood samples were taken from the hepatic vein to determine base excess, and bile was collected. After 1h treatment L-NAME increased the LPS-induced sinusoidal perfusion failure (p < 0.05 vs NS), accentuated the acidosis in the hepatic blood effluent (p < 0.05 vs NS), while bile flow was further reduced (L-NAME 2.0 ± 0.5 vs NS 2.4 ± 0.1 ml/g/min). Non-selective NO blockade in endotoxemia enhances the sinusoidal perfusion failure, impairs acid-basic status of the liver and shows a tendency of impairment of the excretory function.
SUBJECT HEADINGS: Nitric oxide. Hepatic microcirculation. Sinusoidal perfusion.
Endereço para correspondência:
Carlos Otavio Corso
Av. Lavras, 587/302
90460-040 Porto Alegre RS
Data do recebimento: 14/12/1998
Data da revisão: 12/02/1999
Data da aprovação: 15/04/1999
- 1. Matuschak GM, Mattingly ME, Tredway TL, Lechner AJ. Liver-lung interactions during E. coli endotoxemia. TNF-alfa: leukotriene axis. Am J Repir Crit Care 1994; 149:41-9.
- 2. Hawker F. Liver dysfunction in critical illness. Anaesth Intens Care 1991; 19:165-81.
- 3. McCuskey RS. Hepatic microvascular responses to endotoxemia and sepsis. In Messmer K, Menger MD. Liver microcirculation and hepatobiliary function. Basel: Karger; 1993. p 76-84.
- 4. Rüttinger D, Vollmar B, Wanner GA, Messmer K. In vivo assessment of hepatic alterations following gadolinium chloride-induced Kupffer cell blockade. J Hepatol 1996; 25:960-7.
- 5. Kamiike W, Nakahara M, Nakao K, Koseki M, Nishida T, Kawashima Y, Watanabe F, Tagawa K. Correlation between cellular ATP level and bile excretion in the rat liver. Transplantation 1985; 39:50-5.
- 6. Harbrecht BG, Billiar TR, Stadler J, Demetris AJ, Ochoa J, Curran RD, Simmons RL. Inhibition of nitric oxide synthesis during endotoxemia promotes intrahepatic thrombosis and an oxygen radical-mediated hepatic injury. J Leukoc Biol 1992; 52:390-4.
- 7. Mulder MF, Van Lambalgen AA, Huisman E, Visser JJ, Van den Bos GC, Thijs LG. Protective role of NO in the regional hemodynamic changes during acute endotoxemia in rats. Am J Physiol 1994; 266:H1558-64.
- 8. Gundersen Y, Saetre T, Scholz T, Carlsen H, Kjekshus H, Smiseth OA, Lilleaasen P, Aasen AO. The NO donor nitroprusside reverses the negative effects on hepatic arterial flow induced by endotoxin and the NOS inhibitor L-NAME. Eur Surg Res 1996; 28:323-332.
- 9. McCuskey RS, Reilly FD. Hepatic microvasculature: dynamic structure and its regulation. Sem Liver Dis 1993; 13:1-12.
- 10. Gaboury J, Woodman RC, Granger DN, Reinhardt P, Kubes P. Nitric oxide prevents leukocyte adherence: role of superoxide. Am J Physiol 1993; 265:H862-7.
- 11. Natanson C, Hoffman WD, Suffredini AF, Eichacker PQ, Danner RL. Selected treatment strategies for septic shock based on proposed mechanisms of pathogenesis. Ann Intern Med 1994; 120:771-83.
- 12. Voerman HJ, Stehouwer CD, Van Kamp GJ, Strack RJ, Van Schijndel, Groeneveld AB, Thijs LG. Plasma endothelin levels are increased during septic shock. Crit Care Med 1992; 20:1097-1101.
- 13. Zhang JX, Pegoli Jr. W, Clemens MG. Endothelin-1 induces direct constriction of hepatic sinusoids. Am J Physiol 1994; 266:G624-32.
Datas de Publicação
-
Publicação nesta coleção
16 Jul 1999 -
Data do Fascículo
Abr 1999
Histórico
-
Aceito
15 Abr 1999 -
Revisado
12 Fev 1999 -
Recebido
14 Dez 1998