Resúmenes
Se realizaron bioensayos con 105 genotipos de Solanum phureja (papa criolla) para evaluar la resistencia a la sarna polvosa causada por Spongospora subterranea f. sp. subterranea. Estos fueron propagados por esquejes de tallo lateral. La inoculación se realizó con una solución a una concentración de 1x10(6) quistosoros mL-1. Se determinó el grado de resistencia o susceptibilidad de cada genotipo al patógeno en tres momentos diferentes: 1) después de 15 días de la inoculación se evaluó en el microscopio la presencia de zoosporangios en raíces; 2) en estado de floración, se observó la presencia de agallas de raíces; y 3) en la cosecha se evaluaron los tubérculos, observando la presencia de pústulas. Las plantas asintomáticas, aquellas donde no se observaron estructuras del patógeno o síntomas de la enfermedad, fueron evaluadas mediante la técnica de PCR con primers específicos. Los resultados mostraron que a los 15 días no fue posible discriminar el grado de resistencia de los genotipos. Igualmente no hubo presencia de síntomas de la enfermedad en los tubérculos, sin embargo sí se observaron síntomas de agallas en raíces en la evaluación en estado de floración. El genotipo más susceptible fue Criolla Colombia y 30 genotipos presentaron una alta resistencia sin presentar síntomas de la enfermedad o signos del patógeno, dentro de los cuales se incluye la variedad Criolla Paisa.
mejoramiento papa; quistosoros; roña de la papa; sarna polvosa
In order to evaluate the resistance to Spongospora subterranea f. sp. subterranea on 105 genotypes of Solanum phureja (local name in Colombia papa criolla), bioassays were conducted through propagation by lateral stem cuttings. Inoculation was performed with a 1 x 10(6) sporeballs mL-1 solution. The level of resistance or susceptibility of each genotype to the pathogen was determined at three different times: 1) At 15 days after inoculation (DAI), the presence of zoosporangia was evaluated in roots under optical microscopy; 2) At flowering, the presence of galls was observed in roots and 3) At harvest, the tubers were screened for the detection of pustules. Asymptomatic plants, (i.e. plants seemingly without pathogen´s structures or disease symptoms) were evaluated by PCR using specific primers. At 15 DAI it was not possible to determine the degree of resistance in the genotypes and later there were no disease symptoms on tubers. Nevertheless, disease was detectable through gall formation on roots at the flowering stage. The most susceptible genotype was Criolla Colombia. Thirty genotypes, including the commercial variety Criolla Paisa, were highly resistant and presented neither pathogen´s structures nor symptoms.
Uso de esquejes de tallo lateral para evaluar la resistencia de genotipos de Solanum phureja a Spongospora subterranea f. sp. subterranea
Using lateral stem cuttings to evaluate the resistance of Solanum phureja genotypes to Spongospora subterranea f. sp. subterranea
Liliana Andrea RamírezI; Catalina María ZuluagaII; Elena Paola GonzalezII; Mauricio Alejandro MarínIII; Juan Gonzalo MoralesI; Carlos Eduardo ÑústezIV; José Miguel CotesI
IUniversidad Nacional de Colombia - Sede Medellín, Facultad de Ciencias Agrarias, Departamento de Ciencias Agronómicas, Calle 59A No 63-20 Núcleo El Volador, Medellín, Colombia
IIPolitécnico Colombiano Jaime Isaza Cadavid, Facultad de Ciencias Agrarias, Cr 48 No. 7-151, Medellín, Colombia
IIIUniversidad Nacional de Colombia - Sede Medellín, Facultad de Ciencias, Escuela de Biociencias, Calle 59A No 63-20 Núcleo El Volador Medellín, Colombia
IVUniversidad Nacional de Colombia - Sede Bogotá, Facultad de Agronomía, Departamento de Agronomía, Carrera 45 Nº 26-85 Edificio Uriel Gutiérrez, Bogotá D.C., Colombia
RESUMEN
Se realizaron bioensayos con 105 genotipos de Solanum phureja (papa criolla) para evaluar la resistencia a la sarna polvosa causada por Spongospora subterranea f. sp. subterranea. Estos fueron propagados por esquejes de tallo lateral. La inoculación se realizó con una solución a una concentración de 1x106 quistosoros mL-1. Se determinó el grado de resistencia o susceptibilidad de cada genotipo al patógeno en tres momentos diferentes: 1) después de 15 días de la inoculación se evaluó en el microscopio la presencia de zoosporangios en raíces; 2) en estado de floración, se observó la presencia de agallas de raíces; y 3) en la cosecha se evaluaron los tubérculos, observando la presencia de pústulas. Las plantas asintomáticas, aquellas donde no se observaron estructuras del patógeno o síntomas de la enfermedad, fueron evaluadas mediante la técnica de PCR con primers específicos. Los resultados mostraron que a los 15 días no fue posible discriminar el grado de resistencia de los genotipos. Igualmente no hubo presencia de síntomas de la enfermedad en los tubérculos, sin embargo sí se observaron síntomas de agallas en raíces en la evaluación en estado de floración. El genotipo más susceptible fue Criolla Colombia y 30 genotipos presentaron una alta resistencia sin presentar síntomas de la enfermedad o signos del patógeno, dentro de los cuales se incluye la variedad Criolla Paisa.
Palabras-claves: mejoramiento papa, quistosoros, roña de la papa, sarna polvosa.
ABSTRACT
In order to evaluate the resistance to Spongospora subterranea f. sp. subterranea on 105 genotypes of Solanum phureja (local name in Colombia papa criolla), bioassays were conducted through propagation by lateral stem cuttings. Inoculation was performed with a 1 x 106 sporeballs mL-1 solution. The level of resistance or susceptibility of each genotype to the pathogen was determined at three different times: 1) At 15 days after inoculation (DAI), the presence of zoosporangia was evaluated in roots under optical microscopy; 2) At flowering, the presence of galls was observed in roots and 3) At harvest, the tubers were screened for the detection of pustules. Asymptomatic plants, (i.e. plants seemingly without pathogen´s structures or disease symptoms) were evaluated by PCR using specific primers. At 15 DAI it was not possible to determine the degree of resistance in the genotypes and later there were no disease symptoms on tubers. Nevertheless, disease was detectable through gall formation on roots at the flowering stage. The most susceptible genotype was Criolla Colombia. Thirty genotypes, including the commercial variety Criolla Paisa, were highly resistant and presented neither pathogen´s structures nor symptoms.
Key words: potato plant breeding, powdery scab, sporeball.
INTRODUCCIÓN
La riqueza genética de Solanum Sec. Petota, sección en la cual se encuentra la papa (Solanum tuberosum) y sus especies silvestres relacionadas, contienen 232 especies, divididas en 21 series, las cuales incluyen especies diploides, tetraploides, pentaploides y hexaploides (Spooner, 2010). Los recursos genéticos de la papa criolla (Solanum phureja) constituyen un gran potencial genético, que pueden servir como material vegetal para cruzamientos interespecíficos, con el fin de solucionar problemas fitosanitarios del cultivo de papa, así como de estrés abiótico tales como heladas, sequía, granizo, suelos salinos y suelos ácidos (Estrada, 2000). El programa de mejoramiento genético de papa de la Universidad Nacional de Colombia trabaja desde 1998 en el mejoramiento genético de la papa diploide, con el objetivo de desarrollar genotipos redondos amarillos con mayor período de dormancia, aptitud para consumo fresco y/o procesamiento, alto potencial de rendimiento, resistencia a Phytophthora infestans y al virus del amarillamiento de venas (Potato yellow vein virus PYVV) (Rodríguez et al., 2009).
De otro lado, Spongospora subterranea f. sp subterranea es un patógeno obligado que causa la sarna polvosa de la papa, enfermedad que afecta las raíces y tubérculos, deteriorando la calidad y la comercialización de la papa (Qu & Christ, 2006; Merz & Falloon, 2009). En daños severos en tubérculos se puede afectar más del 75% de la superficie, ocasionando la deformación y afectando la comercialización del producto, sin embargo, en daños leves a moderado, se denomina el daño como "cosmético" porque puede ser utilizada la producción para procesamiento industrial o en fresco, mediante la realización de un pelado más profundo de los tubérculos. La presencia de la enfermedad en raíces puede ocasionar la deformación y necrosis de este órgano, afectando la toma de agua, nutrientes y la translocación de azúcares a los tubérculos, disminuyendo la producción y causando el síntoma conocido como dormidera (Falloon et al., 2004; Nitzan et al., 2008). Así para el cultivo de la papa, el desarrollo de la enfermedad en raíces es mucho más preocupante que en tubérculos, ya que al dañar la raíces las plantas mueren y no producen tubérculos afectando directamente la producción, mientras que el daño del tubérculo cuando no es severo se puede recuperar parte de la producción.
A nivel mundial, la enfermedad se ha reportado en Alemania, Holanda, Irlanda, España, Dinamarca, y por ser vector del potato mop-top virus, además causa problemas más severos en Suiza, Reino Unido, Australia, Nueva Zelanda, Canadá y EEUU. En Centro y Sur América, la enfermedad se ha confirmado en Bolivia, Brasil, Colombia, Ecuador, Guatemala, México y Perú (De Boer, 2000; Wale, 2000). Según Qu y Christ (2006), Merz & Falloon (2009), la importancia de la sarna polvosa ha incrementado en las últimas décadas a nivel mundial, debido al uso de cultivares altamente susceptibles y a la poca rotación de cultivos que han permitido la diseminación de la enfermedad. Según Jaramillo et al. (2008), el desconocimiento de la biología del patógeno, y su variación morfológica, patogénica y molecular han impedido desarrollar una estrategia de manejo integrado de la enfermedad.
Dentro de los factores que determinan la infección de la papa por S. subterranea, se encuentran, el grado de resistencia o susceptibilidad del hospedero y la ocurrencia de temperatura favorable para la infección, la cual varía entre 12 y 17ºC (Van de Graaf et al., 2005). Según Alzate et al. (2008) para la liberación de zoosporas se requieren temperaturas entre 15-23ºC. Sin embargo, Merz & Falloon (2009) mencionan que las condiciones de temperaturas en diferentes estudios reportados varían entre 5-25ºC, pero la actividad de las zoosporas y la infección de tubérculos es favorecida a los 12ºC mientras que la infección en agallas a los 17ºC. Las condiciones de humedad elevada en el suelo son necesarias, por lo tanto, el exceso de irrigación reduce la temperatura en el suelo favoreciendo la infección (Merz & Falloon, 2009). Según Jaramillo et al. (2008) los quistosoros necesitan agua libre para lograr una mayor hidratación y posiblemente dar lugar a procesos bioquímicos.
Existen varios reportes que proponen el mejoramiento genético como método eficiente para el manejo de la enfermedad, debido a que se carece de un método químico de control (Baldwin et al., 2008; Merz & Falloon, 2009; Houser & Davidson, 2010). Uno de los objetivos importantes en el mejoramiento de la papa, es lograr la resistencia a enfermedades, plagas y factores abióticos que en forma numerosa y severa afectan la cantidad y la calidad de la producción (Estrada, 2000). Los primeros reportes en mejoramiento por resistencia a S. subterranea los presentaron Torres et al. (1995), quienes evaluaron 467 genotipos de papa, entre materiales de colección y materiales avanzados de mejoramiento. Encontraron que existían 17 genotipos resistentes y 33 moderadamente resistentes, por lo menos durante dos ciclos de cultivo. Lees (2000) realizó evaluaciones con ocho variedades de papa, y encontró gran variación de un año al otro en la severidad de la sarna polvosa y sugirió que esta variación es debida a los cambios en las condiciones climáticas y posiblemente a la distribución en focos del patógeno en el suelo. Por tal motivo, Merz et al. (2004) propusieron diseñar un método que permita evaluar la susceptibilidad de genotipos bajo condiciones controladas, donde se asegure la inoculación con el patógeno, surgiendo el uso de bioensayos, como herramienta para seleccionar materiales en las etapas tempranas del mejoramiento. En estudios realizados por Falloon et al. (2003), se determinó la susceptibilidad a S. subterranea de 99 cultivares de S. tuberosum y 13 líneas mejoradas. Los cultivares y líneas fueron categorizadas como: muy resistentes 21%, moderadamente resistentes 28%, moderadamente susceptibles 33% o muy susceptibles 19%, lo cual sugiriere una resistencia cuantitativa a esta enfermedad. Estudios realizados por Lees (2000), quienes evaluaron clones de S. phureja, reportaron un buen grado de resistencia de los mismos, por lo que sugieren que esta especie puede ser una importante fuente de genes de resistencia a S. subterranea. Asimismo, Falloon et al. (2003), realizando bioensayos en 15 cultivares de S. tuberosum encontraron que en todos se desarrollaban zoosporangios y agallas en las raíces, por tal motivo, no había ningún cultivar inmune a la infección.
El objetivo de esta investigación fue evaluar la respuesta de 105 genotipos de S. phureja a la infección con quistosoros de S. subterranea f. sp subterranea mediante el uso de bioensayos desarrollados a partir de esquejes de tallo lateral como base para el desarrollo a mediano plazo de materiales con resistencia a la sarna polvosa de la papa.
MATERIALES Y MÉTODOS
La investigación se realizó bajo condiciones de Casa Malla en el Centro Agropecuario Paysandú de la Universidad Nacional de Colombia, Sede Medellín, localizado a una altura de 2550 msnm en el corregimiento de Santa Elena, municipio de Medellín (Antioquia, Colombia). Para estos ensayos se utilizaron los 105 genotipos de la Colección de Trabajo de papa criolla (S. phureja), los cuales incluyen las variedades comerciales Criolla Colombia, Criolla Galeras, Criolla Guaneña, Criolla Latina y Criolla Paisa, recientemente liberados por la Universidad Nacional de Colombia a los agricultores. El cultivar Criolla Colombia es conocido por su susceptibilidad en raíces a la sarna polvosa.
Se utilizó la metodología propuesta por Cotes & Ñústez (2001) para lo cual se sembraron nueve tubérculos madre de S. phureja en camas de un 1 m2 usando como sustrato suelo natural derivado de cenizas volcánicas del Oriente Antioqueño, en las cuales se aplicó al momento de la siembra y en aporque 20 g del fertilizante NPK (10- 20- 20) por sitio, y se realizaron las labores propias del cultivo como manejo de arvenses y manejo preventivo fitosanitario con aplicaciones de Mancozeb (80% i.a.) para evitar la presencia principalmente de tizón tardío (P. infestans). Posteriormente, 45 días después de la siembra, mucho antes del período de floración, se eliminó el brote apical a cada planta, con un bisturí previamente desinfectado con 1% de hipoclorito de sodio, para estimular la formación de brotes laterales. Después, de 15 días se inició la cosecha de todos los esquejes de tallo lateral, los cuales variaban en número según el genotipo, cortando en bisel, tallos de por lo menos 3 cm de longitud, a los cuales se les aplicó ácido alfa-naftalenacético (0,4%) en la base del corte para fomentar su enraizamiento en un sustrato de arena estéril.
Para la obtención del inóculo inicial de Spongospora subterranea se siguió la metodología desarrollada por Alzate et al. (2008), la cual consiste en utilizar quistosoros extraídos a partir de suelo, en este caso procedente del municipio de La Unión (Antioquia), vereda Chuscalito, donde se reporta una alta severidad de la enfermedad en cultivos previos. El suelo fue secado a temperatura ambiente durante ocho días, luego fue macerado y pasado secuencialmente por un conjunto de tamices de 90 y 25 µm, recogiendo el suelo presente en el último tamiz. La concentración de quistosoros se determinó en cámara de Neubauer.
Se realizó una suspensión de quistosoros en bandejas plásticas de un volumen total de 0.9 L, la cual tuvo una concentración de 1 x 106 quistosoros. Este proceso se realizó dos días antes de la inoculación, con el objetivo de rehidratar los quistosoros y obtener una mejor liberación de zoosporas. Una vez preparada la solución, cada esqueje ya enraizado fue transferido en esta bandeja ubicada en una mesa de 0,90 cm de altura en casa malla durante 15 días, realizando la inmersión de la raíz en esta solución. Las bandejas fueron cubiertas con plástico negro para garantizar las condiciones de oscuridad de la raíz. En cada bandeja se colocaban entre 10 a 12 esquejes por genotipos, dependiendo del tamaño de los mismos, y se colocaban tres bandejas por genotipo para un total de 315 bandejas. A los ocho días de inoculación, se aplicó solución nutritiva de Hoagland para el mantenimiento de las plantas. La solución contiene en g por cada 500 mL de solución stock, 118,1 de Ca(NO3)2 4 H2O, 50,55 de KNO3, 123,24 de MgSO4 7 H2O, 6,81 de KH2PO4,0,24 de Na2MoO4 2 H2O, 3,09 de H2BO3, 0,26 de NiSO4 6 H2O, 1,44 ZnSO4 7 H2O, 1,98 de MnCl2 4 H2O, 0,62 de CuSO4 5 H2O, 0,24 CoCl2 6 H2O, 19,525 de MES y 1,84 de Na FeEDTA. Pasados los 15 días, se tomaron diez esquejes para ser evaluados, los otros veinte esquejes se pasaron a macetas de 3 kg con suelo estéril, las cuales se mantuvieron dentro de la casa malla, para evaluar síntomas en floración y luego en tuberización. Las plantas se mantuvieron con riegos frecuentes (cada tres días) con el fin de mantener el suelo de las materas en capacidad de campo y así favorecer el desarrollo de la epidemia. Se realizaron aplicaciones semanales de mancozeb (80% i.a), para el control de la gota de la papa (P. infestans), mediante aspersión al follaje.
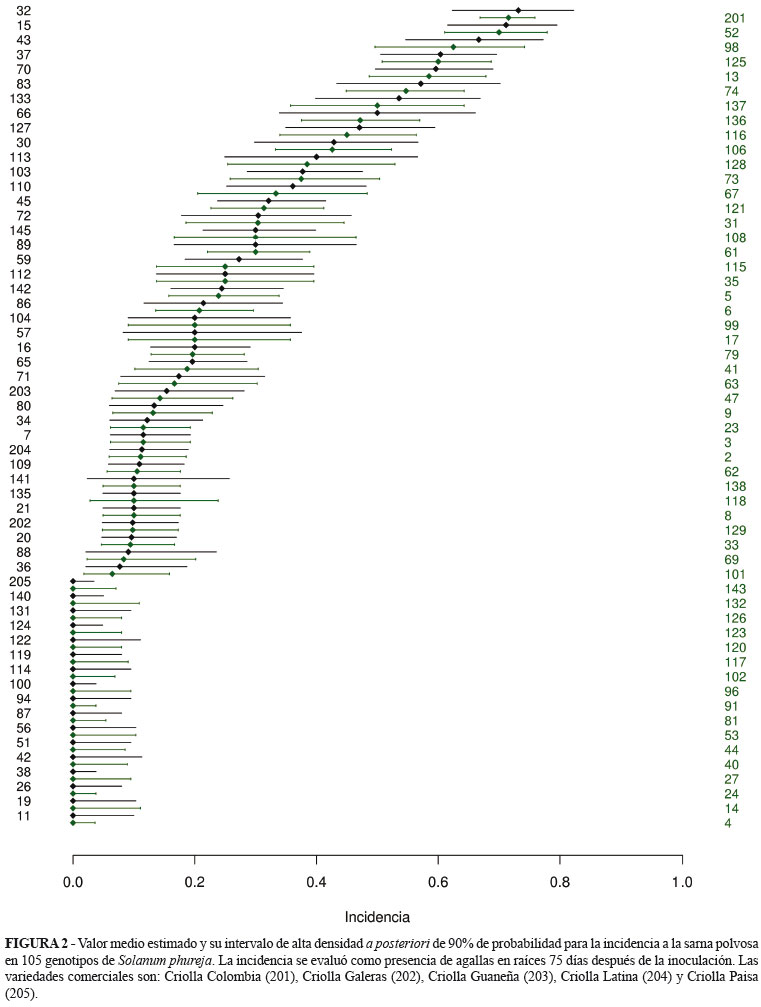
Se evaluaron los síntomas de sarna polvosa de forma visual a los 15, 75 y 105 días. A los 15 días se tomaron raíces de diez esquejes por cada genotipo que fueron extraídas de los recipientes plásticos, realizando un lavado con abundante agua y tomando la mitad de la raíz para tinción y la mitad restante se secó a temperatura ambiente, para realizar pruebas de detección molecular. El método de tinción, consistió en cubrir las raíces con azul de tripano al 0,05% durante dos días. Las raíces teñidas se montaron en portaobjetos y se analizaron bajo microscopía de luz, donde se buscaban quistosoros y zoosporangios de S. subterranea. La evaluación a los 75 días consistió en tomar diez plantas por genotipo al momento de la floración, donde se evaluó la presencia de agallas producidas por S. subterranea modificando la escala propuesta por Álvarez y Rojas (2001) pasando de diez categorias a solamente seis, la cual discrimina la severidad de la enfermedad en raíces así (Figura 1): 0) no se observan agallas, 1) presencia de síntomas de la enfermedad entre 1-5% de las raíces, 2) 6-10%, 3) 11-25%, 4) 26-50%, 5) > 50%. A su vez, cada planta sin síntomas de la enfermedad en campo fue llevada al laboratorio, donde se realizaron tinciones de raíces con el fin de detectar estructuras del patógeno en su interior mediante la observación al microscopio. La última evaluación se realizó a los 105 días, al momento de la cosecha de tubérculos, donde se evaluaron síntomas como presencia de pústulas siguiendo la escala diagramática tomada de Merz (2000). En algunos, con el fin de confirmar que el síntoma observado se debía a S. subterranea, se realizó el respectivo raspado y montaje al microscopio. Asimismo, se realizó la prueba molecular PCR (Polimerase Chain Reaction), sólo en plantas evaluadas a los 15 y 75 días después de inoculación, en los genotipos donde no se observaban síntomas visuales de la enfermedad o estructuras del patógeno al microscopio.
La extracción de ADN de raíces asintomáticas, se realizó en bulk, para un total de diez plantas por genotipo, siguiendo la metodología propuesta por Doyle & Doyle (1990), con el buffer de extracción CTAB 2X (700 mM NaCl, 50 mM Tris HCl pH 8, 10 mM EDTA, 2% P/V de CTAB y 1% mercaptoetanol). Posteriormente se realizó el lavado de la fase orgánica con fenol: cloroformo, alcohol isoamílico (25:24:1) y la precipitación de los ácidos nucleicos con dos volúmenes de alcohol absoluto y 0,1 volúmenes de acetato de sodio 3M. Finalmente, el pellet generado fue disuelto en agua destilada estéril, tratado con ARNasa (10 mg µL-1) y almacenado a -20ºC. La PCR se realizó utilizando dos pares de primers específicos dirigidos a amplificar la región ITS del ADNr: Spo8 (5'CTG GGT GCG ATT GTC TGT TG 3') - Spo9 (5' CAC GCC AAT GGT TAG AGA CG 3') diseñados por Bulman & Marshall (1998) y los SsF (5´ GTC GGT TCT ACC GGC AGA CC 3´) - SsR (5´ GCA CGC CAA TGG TTA GAG ACG 3´) diseñados por Qu et al. (2006). El uso de dichos primers permiten generar amplicones de 390 y 434 pb, respectivamente. Las reacciones de PCR incluyeron 0,5 µM de cada primer, 1 U de Taq DNA polimerasa recombinante (Fermentas, Vilnius, Lituania), 0,2 mM de cada dNTP, 1X de buffer de enzima (100 mM Tris-HCl pH 8,8), 1,8 mM MgCl2, 1 µL de DNA para volumen total de 25 µL. Las amplificaciones se realizaron en un termociclador T3 (Biometra, Alemania) con una desnaturalización inicial a 98ºC por 3 min, seguida por 40 ciclos de 94ºC por 30 seg, 57ºC por 30 seg, 72º C por 1 min y un período final de extensión a 72ºC por 10 min. Luego de la amplificación, se tomaron 5 µL de los productos de reacción y se suplementaron con 5 µL de EZ VISION (10 mg mL-1) para proceder a su separación por electroforesis en gel de agarosa al 1,5%. La visualización de las bandas se realizó bajo luz ultravioleta utilizando el sistema digital de análisis Bio Doc Analyze (Biometra).
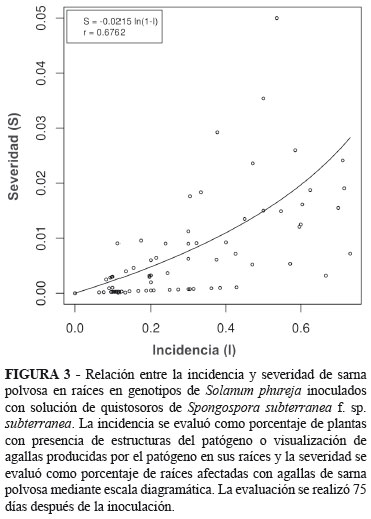
Para el análisis estadístico se consideraron las variables incidencia y severidad de la enfermedad. En el caso de la severidad la variable se tomó como la marca de clase de las seis categorías de la escala diagramática utilizada. Asimismo, se incluyeron cuatro subcategorías más con los siguientes valores: 1) 0% ausencia de síntomas o estructuras del patógeno bajo observación al microscopio y resultado negativo del PCR; 2) 0,1% de severidad si se detecta presencia del patógeno a través de PCR; 3) 0,25% de severidad cuando se observan al microscopio plasmodios o zoosporangios en la raíces evaluadas; y 4) 1% de severidad si se observaban quistosoros al microscopio. La incidencia se evaluó como porcentaje de plantas con presencia de estructuras del patógeno o visualización de agallas producidas por el patógeno en sus raíces. Las variables incidencia y severidad de la enfermedad, al ser variables de porcentaje, en el primer caso que proviene de una distribución binomial, y en el segundo de una distribución pseudobinomial, se analizaron mediante un modelo lineal generalizado asumiendo una función de ligamiento logit. Se utilizó la metodología de estimación Bayesiana, obteniendo como estimados la media de la distribución a posteriori, la cual minimiza el riego de bayes bajo la función de pérdida cuadrática, y fue tenida en cuenta para la comparación de los tratamientos. Si estos intervalos se traslapan no hay diferencias significativas entre los tratamientos. Para explorar la relación entre la incidencia y la severidad se empleó la fórmula propuesta por McRoberts et al. (2003), la cual considera que la relación entre la incidencia y la severidad está dada por la expresión S = αln(1 - I), donde α, es - 1/a, y "a" es el nivel mínimo de incidencia, S es la severidad e I es la incidencia. Esta fórmula, es útil para el caso donde la incidencia incrementa desde un bajo valor (usualmente toma valores de cero) hacia un valor superior b (usualmente puede tomar valores explícitos en la escala del 100% o 1 en proporción).
RESULTADOS
Los esquejes evaluados a los 15 días después de la inoculación no presentaron estructuras del patógeno al interior de la raíz, así como tampoco fue posible su detección mediante PCR, siendo difícil corroborar la presencia temprana del patógeno. Por el contrario, las evaluaciones en floración (75 días después de inoculación) discriminaron entre genotipos susceptibles y genotipos promisorios por su resistencia al patógeno, aunque se presentó una baja incidencia y severidad de la enfermedad
La variedad Criolla Colombia fue la más afectada por la enfermedad en raíces, presentando un valor medio estimado del 75% de plantas afectadas. Al ser esta la variedad testigo-susceptible utilizada en el bioensayo, dicho resultado sugiere que la prueba con esquejes de tallos laterales es útil para lograr la infección con S. subterranea. Otros genotipos susceptibles fueron las accesiones 32, 15, 52, 43, 98, 37 y 125, con valores superiores al 60% de incidencia (Figura 2). Es importante considerar, la respuesta de 30 genotipos que pueden ser potencialmente resistentes a la sarna polvosa por su respuesta frente al patógeno mediante este bioensayo, los cuales no presentaron síntomas de la enfermedad ni signos del patógeno en raíces. Es de notar que el cultivar Criolla Paisa, liberado por la Universidad Nacional de Colombia a los agricultores en el año 2005 (Rodríguez et al. 2009), pertenece a este grupo de genotipos resistentes. Para el caso de la severidad, se pudo observar que los genotipos 137, 133, fueron los que presentaron mayores niveles de enfermedad superiores a 3%, seguidos de las accesiones 103, 13, 15 y 136 con valores estimados de severidad entre el 2 y el 3%.
Al relacionar la incidencia con la severidad de la enfermedad en raíces en floración a los 75 días después de inoculación, se obtuvo un coeficiente de correlación del 69% entre los valores observados y los ajustados por el modelo (Figura 3). El análisis de la relación entre estas variables permite seleccionar genotipos por su grado de resistencia al patógeno (McRoberts et al., 2003). Los genotipos que se encuentran por encima de la curva de predicción se consideran los más susceptibles a la enfermedad, después dentro de estos genotipos se escogen aquellos que tiene mayores niveles de severidad de la enfermedad. Así, se destacan los valores encontrados para los genotipos 133 y 137, por ser los más susceptibles a la enfermedad al presentar valores de incidencia-severidad de 65%-6,1% y de 64%-5,2%, respectivamente. El testigo susceptible Criolla Colombia presentó el valor más alto de incidencia pero su severidad fue del 2%. El genotipo 103 presentó una respuesta de susceptibilidad intermedia al patógeno, con valores de 37,8% y 2,9%, para incidencia y severidad de la enfermedad, respectivamente. Aunque en algunas plantas se observaban agallas en raíces, la evaluación en tubérculos no fue posible al no presentarse los síntomas característicos de la enfermedad, como los son las pústulas. Cuando se realizó el raspado y montaje al microscopio buscando no se observaron quistosoros.
La prueba molecular de PCR no permitió detectar la presencia del patógeno a los 15 días después de la inoculación, pero sí a los 75 días, siendo posible detectar dos genotipos susceptibles al patógeno, que no mostraron síntomas en raíces ni estructuras del patógeno al microscopio. Así, a partir de ADN del genotipo 7 se obtuvieron amplicones del tamaño esperado con los dos pares primers (SsF y SsR, Spo8 y Spo9), mientras que para el genotipo 9 se logró amplificación para la región ITS de S. subterranea solamente con el último par de primers.
DISCUSIÓN
A los 15 días después de la inoculación, no se observó la formación de zoosporangios. Rodríguez et al. (2002), inoculando con solución de quistosoros plantas de tomate y de uchuva (Physalis peruviana), en ensayos muy similares a los desarrollados en esta investigación con 105 genotipos de S. phureja, tampoco encontraron formación de zoosporangios en las raíces evaluadas. De igual forma, sugieren, que inoculaciones mayores a los 15 días, provocan un alto deterioro de la raíz, inviabilizando esta metodología de inoculación en medio líquido. Según Haapala (2005), inmersiones constantes de las raíces en soluciones, pueden generar problemas de hiperhidricidad, lo que puede dañar seriamente los tejidos, resultado que también fue observado en este ensayo utilizando esquejes de tallo lateral donde la inoculación duró 15 días pero hubo una mortalidad de esquejes superior al 50% durante este procedimiento.
La ausencia de zoosporangios a los 15 días de inoculación podría ser considerada como una evidencia de que en S. phureja el tiempo de infección podría ser mayor que el reportado en especies relacionadas como S. tuberosum ssp. andigena y S. tuberosum ssp tuberosum. Merz et al. (2004) utilizando una metodología de inoculación en medio líquido, bajo oscuridad y partiendo de una concentración de quistosoros conocida, utilizando una metodología muy similar a la que se realizó en la presente investigación, evaluaron el potencial que tienen los bioensayos para detectar la resistencia de cultivares de S. tuberosum spp. tuberosum a S. subterranea, pudieron observar la formación de zoosporangios a los 17 días después de la inoculación, determinando que ningún cultivar era inmune a la enfermedad y que los cultivares presentaban diferentes respuestas a la infección siendo los cultivares Agria y Desiree los más susceptibles. Por otro lado Qu et al. (2006), Qu & Christ (2006) y, Qu & Christ (2007), realizando experimentos en raíces de papa (S. tuberosum ssp. tuberosum), tomate, tabaco y arvenses hospederas, encontraron la formación de zoosporangios 14 días después de la inoculación. Sin embargo, todas estas investigaciones, son en un número limitado de genotipos y utilizando una fuente de inóculo de diferente procedencia que el utilizado en ésta investigación.
Andersen et al. (2002), realizando inoculaciones artificiales mediante técnicas hidropónicas, manifiestan que este método permite condiciones idénticas y óptimas en cada período de evaluación, a la vez que, sugieren realizar inoculaciones directamente con zoosporas, donde se puede garantizar una concentración y reducir el problema de la germinación escalonada de los quistosoros. Mediante esta técnica, estos investigadores pudieron encontrar formación de zoosporangios en arvenses (Artemisa vulgaris, Chamomila suaveolens, Geranium pusillum, Poligonun aviculare, S. nigrum, Sonchus arvensis, Urtica urens) tres semanas después de la inoculación. Falloon et al. (2003), realizando bioensayos en genotipos de S. tuberosum ssp. tuberosum en sustrato de arena con adición cada dos días de solución nutritiva e inoculación con quistosoros de tubérculo, pudieron encontrar formación de zoosporangios 22 días después de la inoculación, sugiriendo que el número de raíces, el área de superficie de la raíz, tamaño de las células y la maduración de la raíz, pueden afectar el tamaño y el número de zoosporangios. Los 105 genotipos de S. phureja evaluados en esta investigación, poseen marcadas diferencias morfológicas y de desarrollo radicular. Algunas presentan un desarrollo radicular abundante mientras que en otras es escaso, pudiendo ser estas diferencias morfológicas parte de su componente de resistencia y/o susceptibilidad al desarrollo de la enfermedad.
Aunque a los 15 días después de la inoculación no fue posible observar la formación de zoosporangios al interior de la raíz, la evaluación a los 75 días después de la inoculación, en plantas que crecían en suelo en materas mostró formación de agallas en las raíces. Estos resultados de la formación de agallas a los 75 días, contrastan con lo expresado por Qu & Christ (2007), quienes manifestaban haber observado formación de estas estructuras seis semanas después de la inoculación en S. tuberosum. Andersen et al. (2002) manifiestan haber observado la presencia de agallas en papa, cuatro semanas después de la inoculación. Harrison et al. (1997) consideraron que el período crítico de la infección en papa está establecido entre el desarrollo de los estolones, siete días antes de iniciar la tuberización, hasta que se da el 50% de la formación de los tubérculos. Este período corresponde en S. phureja al período de diferenciación floral. Lo anterior, podría explicar el por qué al realizar las evaluaciones en floración fue posible observar síntomas del patógeno, a pesar de no ser observados a los 15 días. A la vez, Van de Graaf et al. (2007), sugirieron que el patógeno infecta la papa en la etapa de inicio de la tuberización, encontrando un 76% de severidad de la enfermedad. Estos autores proponen que la cantidad de ADN del patógeno, detectado por PCR en tiempo real, aumenta con el desarrollo del hospedero y que el 15% de las plantas evaluadas, formaron agallas en raíces al inicio de la tuberización, aumentando la incidencia y la severidad de la enfermedad en esta etapa. Resultados que ayudan a soportar, el éxito que el bioensayos usando esquejes de tallo laterales, tiene al realizar la evaluación en el momento de floración.
Con el ensayo de esquejes de tallo lateral e inoculación con solución de quistosoros de suelo, no fue posible observar síntomas de la enfermedad, como la presencia de pústulas a los 105 días después de la inoculación, resultado que sugiere que en S. phureja pueden existir genes de resistencia al ataque de la enfermedad en los tubérculos. Contrario a ello, existen otros reportes que manifiestan que los bioensayos fueron útiles para evaluar la resistencia. Baldwin et al. (2008) reportan valores de incidencia entre 0 y 86% en los genotipos de papa evaluados y valores promedios de severidad entre 0,63 y 2,91% en el testigo que fue el cultivar Agria. Wastie et al. (1988) reporta una correlación entre genotipos evaluados en campo naturalmente infestados e inoculaciones artificiales del 0,84 y 0,81 en dos años evaluados, respectivamente. Baldwin et al. (2008) manifestaron que los síntomas en los tubérculos, variaban de una temporada a otra y, en algunos casos, la incidencia de la enfermedad era muy baja, soportando este resultado por la variación en el factor temperatura.
Van de Graaf et al. (2007) manifiestan que no sólo el genotipo es importante en la interacción, las condiciones ambientales (temperatura y humedad) son necesarias para el desarrollo de la enfermedad. Houser & Davidson (2010), evaluando el cultivar Rio Colorado y dos regímenes de humedad, mediante bioensayos pudieron encontrar que el régimen de humedad ideal para el desarrollo de la enfermedad estuvo entre 5 y 10 cbares. La baja humedad puede jugar un papel importante en los bajos niveles de exudados radiculares, porque la planta percibe una condición de estrés, siendo importantes estos exudados en el estímulo para la liberación de zoosporas, a la vez que una alta humedad en el suelo permite que la zoospora pueda moverse fácilmente (Harrison et al., 1997; Baldwin et al., 2008; Houser & Davidson, 2010). En los experimentos realizados con S. phureja no se controló el contenido de humedad aunque hubo irrigación permanente, sin embargo este puede ser un factor a considerar en futuros bioensayos. Por otro lado, observaciones de campo muestran que estos 105 genotipos no presentan síntomas de la enfermedad en tubérculo en 10 ensayos realizados en el municipio de La Unión (Cotes et al., 2012), donde se obtuvo el inóculo para estos bioensayos.
En los bioensayos realizados, con esquejes de tallo lateral, la evaluación en raíces, resultó ser más eficiente que la evaluación en tubérculo, donde no se observaron pústulas del patógeno. Una de las posibles explicaciones, sería lo reportado por Balwdin et al. (2008), quienes manifiestan que para la sarna polvosa de la papa, pueden existir infecciones latentes en tubérculos, que al ser evaluados al momento de la cosecha no presentan síntomas, sólo hasta que son almacenados bajo condiciones de 8ºC, durante dos meses, se logra la expresión de síntomas, sin embargo, S. phureja no puede ser almacenanda bajo condiciones de frío debido a la ausencia de dormancia del tubérculo, por lo que esta explicación no podría ser utilizada en la presente investigación. Falloon et al. (2003), Housen & Davidson (2010), Nakayama et al. (2002), manifiestan que el hecho de que una planta presente síntomas de agallas en raíces no garantiza encontrar pústulas en tubérculos. Nakayama et al. (2002), mediante bioensayos con solución nutritiva, encontraron que los cultivares más susceptibles a la infección en raíces, tenían poca o escasa presencia de la enfermedad en tubérculos, concluyendo que la infección en raíces no correlacionaba con la infección en tubérculos. Merz et al. (2004) manifiestan que existe una mejor correlación entre los zoosporangios presentes en la raíz en comparación con las agallas para que haya presencia de síntomas en tubérculos. Baldwin et al. (2008) reportaron en la variedad 'Swift', presencia de síntomas solo en raíces, y sugirieron que la precocidad en el desarrollo de esta variedad, le permitió a los tubérculos escapar de la enfermedad. Los anteriores trabajos citados permiten explicar el resultado encontrado en esta investigación en S. phureja donde se presentan síntomas de agallas en raíces y hay ausencia de pústulas en los tubérculos, ya sea porque existe una falta de correlación ampliamente reportada entre el desarrollo de la enfermedad en raíces y tubérculos o porque S. phureja al presentar bajo las condiciones de Colombia (centro de diversidad de esta especie) un ciclo de cultivo corto (entre 100 y 120 días), así los tubérculos pueden escapar de ser infectados por el patógeno.
Nitzan et al. (2008) describieron que la variación en la susceptibilidad a la sarna polvosa puede estar dada por la superficie del tubérculo, donde aquellos con epidermis rugosa no desarrollan síntomas notables como pústulas en comparación con tubérculos de piel lisa. Todos los genotipos de papa criolla evaluados en esta investigación son de piel lisa y no presentaron síntomas de la enfermedad, lo cual contradice el reporte de Nitzan et al. (2008). Sin embargo la diversidad de síntomas en los órganos de papa han sido reportados por Jaramillo & Botero (2007), quienes manifestaron que en Cundinamarca, Boyacá y Norte de Antioquia es más frecuente observar pústulas sobre los tubérculos de las variedades Parda Pastusa y DIACOL Capiro, mientras que en el departamento de Nariño y Oriente de Antioquia es común observar agallas en raíces de estas variedades. A su vez, Gans (2000) sugirió que a nivel mundial los síntomas de la enfermedad son muy variables. En Escocia, por ejemplo, se observan pústulas que explotan después de un mes de almacenadas, mientras en Australia se observan cráteres y granos sobre el tubérculo. Según Merz et al. (2004), realizando bioensayos en laboratorio, encontraron que hay diferencias en la severidad de la infección en las raíces cuando son inoculadas con quistosoros de diversos países, lo que indica diferencias biogeográficas en el patógeno. Falloon (2008) propuso que la diferencia en síntomas puede ser un mecanismo de resistencia que funciona para las raíces y tubérculos. El origen del inóculo es muy importante, para obtener resultados y síntomas consistentes a través del tiempo. En este bioensayo el inóculo fue procedente del municipio de La Unión (Oriente Antioqueño), donde es común observar síntomas en raíces tanto en S. tuberosum como en S. phureja (Jaramillo & Botero, 2007). Esto podría explicar posiblemente el por qué no hubo presencia de pústulas en tubérculo y solamente se presentaron síntomas en raíces.
Uno de los más grandes problemas que existen en Colombia en los cultivares con alta incidencia y severidad de la enfermedad en las raíces es el hecho, de que la enfermedad puede pasar desapercibida por el agricultor, quien finalmente cosecha los tubérculos, y por lo tanto no ve la enfermedad. Sin embargo, el incremento en el inóculo de S. subterranea ocurrió durante el desarrollo del cultivo.
Finalmente los resultados encontrados en esta investigación permiten el desarrollo de bioensayos para la evaluación de la resistencia de genotipos de S. phureja a S. subterranea f. sp. subterranea utilizando esquejes de tallo lateral, donde dicha evaluación debe realizarse a los 75 días después de inoculadas las plantas y evaluando síntomas en raíces de forma exhaustiva, es decir, evaluando inicialmente síntomas visuales y posteriormente evaluando al microscopio de luz las raíces asintomáticas.
AGRADECIMIENTOS
Esta investigación fue financiada a través del proyecto 220101007287-Evaluación fenotípica y genotípica de la colección colombiana de Solanum phureja por resistencia a Spongospora subterranea el cual fue desarrollado por la Universidad Nacional de Colombia Sedes Medellín y Bogotá, el Politécnico Colombiano Jaime Isaza Cadavid y la Federación de Cultivadores de Papa (FEDEPAPA) y cofinanciado por el Ministerio de Agricultura y Desarrollo Rural de Colombia, y la Asociación Hortofrutícola de Colombia (Asohofrucol). Los autores expresan sus agradecimientos a los integrantes de los grupos de investigación de Mejoramiento y producción de Especies Andinas y Tropicales (COL0039484) y al Grupo de Investigación en papa (COL0010065), que aportaron el recurso humano para desarrollar esta investigación.
Recebido 31 Diciembre 2011
Acceptado 14 Julio 2012
Autor de correspondencia: José Miguel Cotes Torres, e-mail: jmcotes@unal.edu.co
TPP 469
Editor de Seccion: Marcial A. Pastor-Corrales
- Álvarez C, Rojas M (2001) Evaluación de los efectos del cinc sobre la sarna polvosa en raíces de papa de la variedad Diacol Capiro. Tesis de Grado de Ingeniería Agronómica, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia. Medellín Colombia.
- Álzate DE, Hoyos LM, González EP (2008) Factores que inciden en la liberación de zoosporas de Spongospora subterranea (Wallroth) Lagerheim f. sp. subterranea Tomlinson. Revista Facultad Nacional de Agronomía Medellín 61:4503-4510.
- Andersen B, Nicolaisen M, Nielsen SL (2002) Alternative hosts for potato mop-top virus, genus Pomovirus and its vector Spongospora subterranea f. sp. subterranea. Potato Research 45:37-43.
- Baldwin S, Genet RA, Butler RC, Jacobs JM (2008) Greenhouse assay for powdery scab (Spongospora subterranea f. sp. subterranea) resistance in potato. Potato Research 5:63-73.
- Bulman SR, Marshall JW (1998) Detection of Spongospora subterranea in potato tuber lesions using the polymerase chain reaction (PCR). Plant Pathology 47:759-766.
- Cotes J, Ñustez CE (2001) Evaluación de dos tipos de esquejes en la producción de semilla prebásica de papa criolla (Solanum phureja Juz et Buck) variedad yema de huevo. Agronomía Colombiana 18:7-13.
- Cotes JM, González EP, Zuluaga CM, Morales JG, Marín MA, Ñustez CE (2012) Informe final de proyecto de investigación "Evaluación fenotípica y genotípica de la colección de Solanum phureja por su resistencia a Spongospora subterranea f. sp. subterranea". Universidad Nacional de Colombia y Politécnico Colombiano Jaime Isaza Cadavid.
- De Boer RF (2000) Powdery scab and potato production in Australia. In: Merz U, Lees AK (Eds.) Proceedings of the First European Powdery Scab Workshop. Aberdeen Scotland. pp. 23-24.
- Doyle JJ, Doyle JL (1990) Isolation of plant DNA from fresh tissue. Focus 12:13-15.
- Estrada N (2000) La biodiversidad en el mejoramiento genético de la papa. La Paz Bolivia. Proinpa/CID/CIP.
- Falloon RE (2008) Control of powdery scab of potato: Towards integrated disease management. American Journal of Potato Research 85:253-260.
- Falloon RE, Genet A, Wallance A, Butler R (2003) Susceptibility of potato (Solanum tuberosum) cultivars to powdery scab (caused by Spongospora subterranea), and relationships between tuber and root infection. Australasian Plant Pathology 32:377-385.
- Falloon, RE, Curtin D, Lister RA, Butler RC (2004) The obligate soilborne pathogen Spongospora subterranea affects host (Solanum tuberosum) root function. Proceedings of the 3rd Australasian Soilborne Diseases Symposium. Adelaide Australia. South Australian Research and Development Institute. pp. 30-31.
- Gans PT (2000) Summary of the session on symptom range and disease assessment. In: Merz U, Lees AK (Eds.) Proceedings of the First European Powdery Scab Workshop. Aberdeen Scotland. pp. 27-28.
- Harrison JG, Searle RJ, Williams NA (1997) Powdery scab disease of potato - a review. Plant Pathology 46:1-25.
- Haapala T (2005) Use of single-leaf cuttings of potato for efficient mass propagation. Potato Research 48:201-214.
- Houser AJ, Davidson RD (2010) Development of a greenhouse assay to evaluate potato germplasm for susceptibility to powdery scab. American Journal of Potato Research 87:285-298.
- Jaramillo S, Botero JM (2007) Respuesta de diferentes poblaciones de Spongospora subterranea f. sp. subterranea a la rotación entre dos variedades de papa (Solanum tuberosum ssp. andigena). Revista Facultad Nacional de Agronomía Medellín 60:3659-3876.
- Jaramillo S, Pérez GA, Hoyos LM (2008) Variación morfológica de quistosoros de Spongospora subterranea (Wallr.) Lagerh f. sp. subterranea. Revista Facultad Nacional de Agronomía Medellín 61:4511-4517.
- Lees AK (2000) Resistance to powdery scab. In: Merz U, Lees AK (Eds.) Proceedings of the First European Powdery Scab Workshop. Aberdeen Scotland. pp. 35-38.
- McRoberts N, Hughes G, Madden LV (2003) The theoretical basis and practical application of relationships between different disease intensity measurements in plants. Annals of Applied Biology 142:191-211.
- Merz U (2000) Powdery scab: Research in Switzerland. In: Merz U, Lees AK (Eds.) Proceedings of the First European Powdery Scab Workshop. Aberdeen Scotland. pp. 67-71.
- Merz U, Falloon RE (2009) Review: powdery scab of potato increased knowledge of pathogen biology and disease epidemiology for effective disease management. Potato Research 52:17-37.
- Merz U, Martínez V, Schwaerzel R (2004) The potential for the rapid screening of potato cultivars (Solanum tuberosum) for resistance to powdery scab (Spongospora subterranea) using a laboratory bioassay. European Journal of Plant Pathology 110:71-77.
- Merz U, Falloon RE (2009) Review: powdery scab of potato increased knowledge of pathogen biology and disease epidemiology for effective disease management. Potato Research 52:17-37.
- Nakayama T, Merz U, Nakagawa A, Takehara T, Shimanuki T (2002) Differences in zoosporangial root infection of some potato varieties inoculated with Japanese and foreign field isolates of Spongospora subterranean f. sp. subterranea Proceedings of the 5th Symposium of IWGPVFV. Zurich Switzerland. pp. 115-118.
- Nitzan N, Cummins TM, Jhonson D, Miller J, Batchelor D, Olsen C, Quick R, Brown C (2008) Resistance to root galling caused by the powdery scab pathogen Spongospora subterranea in potato. Plant Disease 92:1643-1649.
- Qu XS, Christ B (2006) The host range of Spongospora subterranea f. sp. subterranea in the United States. America Journal of Potato Research 83:343-347.
- Qu XS, Christ B (2007) In vitro culture of the obligate parasite Spongospora subterranea (Cercozoa; Plasmodiophorida) associated with root-inducing transferred-DNA transformed potato hairy roots. Journal of Eukaryotic Microbiology 54:465-467.
- Qu XS, Kavanagh JA, Egan D, Christ B (2006) Detection and quantification of Spongospora subterranea f. sp. subterranea by PCR in host tissue and naturally infested soil. American Journal of Potato Research 83:21-30.
- Rodríguez LE, Ñustez CE, Estrada N (2009) Criolla Latina, Criolla Paisa y Criolla Colombia, nuevos cultivares de papa criolla para el departamento de Antioquia (Colombia). Agronomía Colombiana 27:289-303.
- Rodríguez K, Maldonado Y, Murcia L, Huertas W, Vásquez M, Zambrano A, Rivero R, García C (2002) Evaluación de protocolos para la detección de patógenos del suelo en papa. Disponible en: www.todopapa.com.ar/pdf/protocolos.pdf Acesso en 3.11.2011.
- Spooner D (2010) Taxonomy, evolution, and domestication of potato. Memorias Simposium Internacional de Recursos Genéticos de la Papa. Lima Perú. ALAP INIA.
- Torres H, Pacheco M, French ER (1995) Resistance of potato to powdery scab (Spongospora subterranea) under Andean field conditions. American Potato Journal 10:355-363.
- Van De Graaf P, Lees AK, Duncan JM (2005) Effect of soil inoculum level and environmental factors on potato powdery scab caused by Spongospora subterranea Plant Pathology 54:22-28.
- Van De Graaf, P, Wale SJ, Lees AK (2007) The incidence and severity of root infection and root galling caused by Spongospora subterranea were assessed in Potato. Plant Pathology 56:1005-1013.
- Wale SJ (2000) Summary of the session on past and present research on powdery scab. In: Merz U, Lees AK (Eds.) Proceedings of the First European Powdery Scab Workshop. Aberdeen Scotland. p. 110.
Fechas de Publicación
-
Publicación en esta colección
26 Jul 2013 -
Fecha del número
Ago 2013
Histórico
-
Recibido
31 Dic 2011 -
Acepto
14 Jul 2012