Resumos
O uso de contraceptivos orais está associado a um risco aumentado de doenças tromboembólicas, o que pode ser explicado pelos seus efeitos sobre o sistema hemostático. Tem sido descrito que o uso de contraceptivos orais promovem alterações pró-coagulantes, e que essas alterações são acompanhadas dos aumentos da atividade fibrinolítica e dos inibidores naturais da coagulação, o que causaria um restabelecimento do equilíbrio hemostático. O objetivo deste estudo foi avaliar os efeitos do contraceptivo oral contendo 20 µg de etinilestradiol e 150 µg de desogestrel sobre os sistemas de coagulação e fibrinólise. Participaram do estudo 11 voluntárias que foram avaliadas antes e após seis meses de uso do contraceptivo oral. Os parâmetros analisados foram: atividades dos fatores VII, VIII, IX, X e XII (plasmas deficientes em fatores com detecção foto-óptica do coágulo), atividades da antitrombina, plasminogênio e a2-antiplasmina (ensaios cromogênicos), quantificação dos antígenos t-PA, produtos de degradação da fibrina e proteínas C e S (ELISA), TP, TTPA e concentração plasmática de fibrinogênio (detecção foto-óptica do coágulo). Observamos as seguintes alterações estatisticamente significantes (nível de significância de p<0,05): aumento das atividades dos fatores VIII, IX, X e XII, redução do TTPA, aumento da atividade do plasminogênio, aumento de proteína C e diminuição de proteína S. Com esses resultados sugerimos que o uso do contraceptivo oral testado promove um estado pró-coagulante. Entretanto, os mecanismos de restabelecimento do equilíbrio hemostático não podem ser garantidos, já que não observamos alterações suficientes que indiquem isso. Não observamos aumento nos níveis dos produtos de degradação da fibrina, o que indica que não ocorreram alterações na gênese e degradação de fibrina. Portanto, sugerimos que o uso do contraceptivo oral pode aumentar o risco de doenças tromboembólicas, principalmente em associação com outros fatores de riscos genéticos e/ou adquiridos.
Contraceptivos; coagulação; fibrinólise
The aim of this work is to evaluate the effects on coagulation and fibrinolysis of the oral contraceptives of third generation in Brazilian women and the impact on these effects by reducing ethinyl estradiol dosage. Eleven Brazilian women taking monophasic oral contraceptive containing 20 µg of ethinyl estradiol combined with 150 µg of desogestrel for six cycles consecutively entered this study. The effects on parameters pro-coagulants, anticoagulants, pro-fibrinolytics and fibrin turnover index were evaluated. The results from oral contraceptive increased significatively the factors VIII, IX, X and XII. With respect to coagulation inhibitors, no antithrombin changes were noted in both groups, increase in the levels of protein C and decrease in the levels of protein S total were noted. Concerning the fibrinolytic parameters, the oral contraceptive increased the plasminogen activity, although no changes on t-PA, and alpha-2-antiplasmin were observed. Similary, no changes on the levels of fibrin degradation products were observed, thus indicating that oral contraceptives did not interfere with generation and degradation of fibrin. The results obtained indicate that the oral contraceptives studied did not promote enough pro-fibrinolytic changes so as to state that a re-establishment occurs on haemostatic balance. Therefore, we suggest the use of this oral contraceptive can result in thromboembolic episode mainly in association with other factors such as congenital deficiency of natural clotting inhibitor antithrombin, protein C or protein S.
Contraceptives; coagulation; fibrinolysis
Artigo
Efeitos do contraceptivo oral contendo 20 µg de etinilestradiol e 150 µg de desogestrel sobre os sistemas de coagulação e fibrinólise
Ana C.P. Ferreira
Marlise B.A. Montes
Silvio A. Franceschini
Maria R.T. Toloi
O uso de contraceptivos orais está associado a um risco aumentado de doenças tromboembólicas, o que pode ser explicado pelos seus efeitos sobre o sistema hemostático. Tem sido descrito que o uso de contraceptivos orais promovem alterações pró-coagulantes, e que essas alterações são acompanhadas dos aumentos da atividade fibrinolítica e dos inibidores naturais da coagulação, o que causaria um restabelecimento do equilíbrio hemostático. O objetivo deste estudo foi avaliar os efeitos do contraceptivo oral contendo 20 µg de etinilestradiol e 150 µg de desogestrel sobre os sistemas de coagulação e fibrinólise. Participaram do estudo 11 voluntárias que foram avaliadas antes e após seis meses de uso do contraceptivo oral. Os parâmetros analisados foram: atividades dos fatores VII, VIII, IX, X e XII (plasmas deficientes em fatores com detecção foto-óptica do coágulo), atividades da antitrombina, plasminogênio e a2-antiplasmina (ensaios cromogênicos), quantificação dos antígenos t-PA, produtos de degradação da fibrina e proteínas C e S (ELISA), TP, TTPA e concentração plasmática de fibrinogênio (detecção foto-óptica do coágulo). Observamos as seguintes alterações estatisticamente significantes (nível de significância de p<0,05): aumento das atividades dos fatores VIII, IX, X e XII, redução do TTPA, aumento da atividade do plasminogênio, aumento de proteína C e diminuição de proteína S. Com esses resultados sugerimos que o uso do contraceptivo oral testado promove um estado pró-coagulante. Entretanto, os mecanismos de restabelecimento do equilíbrio hemostático não podem ser garantidos, já que não observamos alterações suficientes que indiquem isso. Não observamos aumento nos níveis dos produtos de degradação da fibrina, o que indica que não ocorreram alterações na gênese e degradação de fibrina. Portanto, sugerimos que o uso do contraceptivo oral pode aumentar o risco de doenças tromboembólicas, principalmente em associação com outros fatores de riscos genéticos e/ou adquiridos.
Palavras-chave: Contraceptivos, coagulação, fibrinólise
Introdução
No início da década de 60 observações clínicas apontaram uma associação entre o uso de contraceptivos orais combinados (COCs) e o risco de tromboembolismo venoso. Estudos posteriores revelaram que o uso desse método de contracepção aumenta em até 4 vezes esse risco quando comparado ao não uso. Com a finalidade de explicar esse aumento na incidência de eventos tromboembólicos, os efeitos dos COCs sobre o sistema hemostático têm sido muito estudados (1).
Muitos estudos concluíram que o nível sanguíneo de vários fatores da hemostasia é alterado, usualmente dentro da faixa de referência, pelo uso de COCs. Tal alteração aponta uma maior atividade dos sistemas de coagulação e fibrinólise, implicando em um aumento na formação e degradação de fibrina (2).
As alterações nos parâmetros hemostáticos observadas em usuárias de COCs têm sido atribuídas às doses de estrógeno contidas nesses medicamentos (3-5). A fim de diminuir esses efeitos, nas formulações mais recentes, os chamados COCs de terceira geração, as doses de etinil estradiol (EE) foram reduzidas de 100 para 30 ou 20 µg. Além disso, novos progestágenos - gestodene, desogestrel e norgestimato - com menores efeitos androgênicos e sobre o metabolismo de carbohidratos e lipídios foram desenvolvidos (6-8).
Estudos realizados com essas formulações mais recentes indicaram que COCs contendo doses reduzidas de EE diminuem a magnitude das mudanças pró-coagulantes e mais do que isso, aumentam a atividade fibrinolítica (2, 4, 9-12). Quando comparados com relatos sobre os efeitos tromboembólicos de COCs de alta dose de estrógeno, os COCs de baixa-dose (menos que 50 µg de EE) mostraram um risco significativamente reduzido de tromboembolismo. No entanto, a interpretação quantitativa desses dados é difícil porque os resultados podem ser influenciados por vários fatores, como estilo de vida e diagnóstico inadequado (13, 14). A análise retrospectiva de dados epidemiológicos tem sugerido que trombose venosa profunda e trombose cerebral são mais frequentes em usuárias de COCs contendo 100 µg de EE, do que com 30 µg (14). Alguns pesquisadores defendem que a redução na dose de EE para 20 µg minimizam os efeitos sobre a hemostasia (9, 10).
Alguns estudos concluíram que os chamados COCs de terceira geração não induzem mudanças no sistema hemostático menores do que os de segunda geração. Kluft & Lansink (1997) relataram que esses COCs promovem alterações mais significativas em alguns componentes hemostáticos, como por exemplo no fator VII e que os progestágenos contidos nessas formulações aumentam o risco de doenças cardiovasculares (2). Pesquisas encontraram que COCs de terceira geração estão associados com um risco duas vezes maior de tromboembolismo venoso, quando comparados aos de segunda geração (15, 16).
O componente progestagênico dos COCs modifica o efeito do estrógeno sobre o sistema hemostático, aumenta o risco de doenças cardiovasculares porque aumenta a pressão sanguínea e interfere no metabolismo de lipídios e carbohidratos (9, 12, 17-22). Por muito tempo, considerou-se que o componente progestagênico dos COCs não tinha efeito sobre o sistema hemostático. No entanto, é agora apontado como um importante fator nas desordens vasculares arteriais (5).
Estudos com contraceptivos orais contendo somente progestágeno apontaram que esse tipo de preparação produz efeitos favoráveis sobre a hemostasia, mostrando-se uma boa opção como método contraceptivo para mulheres com história familiar ou pessoal de doença tromboembólica venosa (23). Outros estudos revelaram que esse tipo de formulação parece afetar os parâmetros hemostáticos de maneira mais moderada, e seu uso não leva a um risco aumentado de trombose. Similarmente, durante a terapia de reposição hormonal com estrógenos naturais, a adição de progestágeno não induz mudanças desfavoráveis na hemostasia (3, 13).
Muitos autores têm relatado que os COCs causam um aumento no fibrinogênio e nos fatores II, VII, IX, X e XII levando a um estado de hipercoagulabilidade em suas usuárias (9, 12, 18-20, 24-26). Os fatores V, VIII, pré-calicreína e cininogênio de alto peso molecular parecem não ser afetados (17). Alguns autores encontraram um encurtamento no tempo de protrombina (TP), enquanto outros não encontraram alteração nessa prova, bem como no tempo de tromboplastina parcial ativado (TTPA), em pacientes submetidas ao tratamento com COCs contendo 30 µg de EE (8, 24, 26). No entanto, pode-se observar que os dados obtidos em diferentes estudos são controversos.
Com relação à fibrinólise, estudos apontam um aumento da atividade e uma diminuição do antígeno ativador do plasminogênio do tipo tecidual (t-PA), uma diminuição da atividade e do antígeno inibidor do ativador do plasminogênio do tipo 1 (PAI-1), além de um aumento nos produtos da degradação da fibrina (PDF) e da atividade do plasminogênio, indicando um aumento na atividade fibrinolítica (11, 12, 18, 20, 24, 26-31). Com relação aos inibidores da plasmina, enquanto alguns autores não encontraram alterações na sua concentração plasmática, outros relataram aumento da atividade da alfa-2-antiplasmina (17, 27, 32). Jespersen et al. (1990) relataram que o aumento do plasminogênio é acompanhado de uma diminuição nos níveis de glicoproteína rica em histidina, o que tornaria o plasminogênio mais disponível para ligação à fibrina (7).
Ainda não se sabe se o aumento da fibrinólise é causado por um efeito primário destes medicamentos sobre a secreção desses componentes pelo endotélio, ou se é um efeito secundário como uma resposta ao aumento intravascular de fibrina. Quanto ao aumento do plasminogênio, ainda não está claro se a produção é que está aumentada ou se o consumo é que está diminuído (6-8, 33).
Com relação aos inibidores da coagulação, os resultados são bastante controversos. Muitos autores encontraram uma diminuição na antitrombina; outros não relataram nenhuma alteração (7, 10, 12, 17-19, 24, 26-28). Com relação à proteína C, alguns autores encontraram uma atividade aumentada e outros não encontraram alterações (4, 7, 18-20, 24, 27). Já com relação à proteína S, vários estudos relataram que ocorre uma diminuição na atividade (4, 10, 11, 17, 20, 25).
As alterações nas concentrações sanguíneas dos componentes da hemostasia podem ser devido ao efeito dos COCs sobre a síntese e sobre o clearence desses componentes. Em particular para o t-PA e para o PAI-1 pode-se considerar que a mudança induzida pelos COCs são devido aos efeitos sobre o clearence (2).
Alguns autores concluíram que os mecanismos antitrombóticos fisiológicos, que incluem a antitrombina, proteína C e S e o sistema fibrinolítico neutralizam a tendência coagulante observada no tratamento com COCs contendo baixas doses de EE e gestodene, minimizando assim os efeitos colaterais. Dessa forma, os COCs podem não causar um desequilíbrio hemostático porque as alterações na coagulação são sempre acompanhadas da ativação da fibrinólise, ocorrendo um reajuste no balanço dinâmico entre esses dois processos (8, 12, 18, 22). Isso faz com que mulheres portadoras de defeitos na regulação hemostática não sejam capazes de ajustar esse equilíbrio, explicando assim a contraindicação dos COCs nos casos de deficiência de antitrombina, proteína C e proteína S e nos casos de níveis altos de PAI-1. Portanto, qualquer fator que interfira no ajuste entre a coagulação e fibrinólise limita a capacidade do organismo de restabelecimento do equilíbrio hemostático (8, 22). Entretanto, Kluft & Lansink (1997) relataram que as alterações fibrinolíticas não se correlacionam com as alterações na coagulação, de maneira que esses efeitos são independentes, não havendo nenhuma evidência que ocorra um balanço regulado individualmente (2).
Nenhum dos efeitos sobre o sistema hemostático parece ser específico para usuários de COCs, assim como nenhum deles foi encontrado uniformemente em todas as usuárias. Além disso, a susceptibilidade individual e os efeitos dos COCs aumentando o risco de eventos tromboembólicos parecem agir sinergicamente com diversas condições trombofílicas como, por exemplo, anormalidades congênitas nos inibidores da coagulação (34). Um estudo comparando os efeitos dos COCs sobre os sistemas de coagulação e fibrinólise em diferentes centros mostrou que a administração desses medicamentos em diferentes populações pode não acarretar riscos trombóticos iguais, o que poderia, portanto, ser explicado pela presença de outros fatores genéticos ou adquiridos, que predispõem a um estado trombofílico (35). Dessa forma, muitos autores defendem que uma estratégia de screening deve ser desenvolvida com a finalidade de atingir mulheres com fatores de risco, tais como uma história pessoal ou familiar de tromboembolismo venoso, antes que o COC seja prescrito (34).
A variação interindividual na farmacocinética e farmacodinâmica dos contraceptivos esteroidais é grande e poderia explicar em parte por que certas usuárias de COCs podem apresentar um risco maior de trombose (13).
Ainda não está bem esclarecido se há persistência do risco de doenças cardiovasculares em mulheres que interromperam o uso de COCs após longo tempo de uso (36).
O presente trabalho tem como objetivo avaliar os efeitos do COC de terceira geração contendo 20 µg de EE em associação com 150 µg de desogestrel, sobre os sistemas de coagulação e fibrinólise.
Dessa forma, pretendemos obter dados referentes ao nosso país sobre esse tipo de efeito colateral dos COCs. Isso porque não encontramos na literatura estudos epidemiológicos desta natureza, realizados no Brasil.
Casuística e Métodos
Protocolo clínico
Participaram do estudo 11 voluntárias, que tomaram por seis ciclos menstruais consecutivos o COC contendo 20 µg de etinilestradiol (EE) e 150 µg de desogestrel.
O presente estudo foi aprovado pela comissão de ética médica do Centro de Saúde Escola do HC-FMRP-USP. As mulheres consentiram, por escrito, a sua inclusão no estudo.
Estas voluntárias foram selecionadas entre as pacientes que utilizam o setor de Ginecologia do Serviço de Saúde da USP (SISUSP) e do Centro de Saúde-Escola do HC-FMRP-USP. Os seguintes critérios de inclusão foram adotados:
idade entre 18 e 35 anos;
peso corporal entre 45 e 80 kg;
hábitos de vida e de dieta normais;
não fumantes;
ausência de gravidez ou uso de contraceptivos orais por pelo menos 3 meses;
uso de medicamentos que influenciam na coagulação deve ser evitado durante o estudo ou pelo menos 14 dias antes das coletas de sangue;
ausência de história familiar ou pessoal de doenças trombóticas ou varizes.
Foram colhidas amostras de sangue venoso das voluntárias antes e após seis meses de tratamento. As coletas foram realizadas entre 8 e 10 da manhã. Foram colhidos 14 mL de sangue por punção com um mínimo de estase, sendo que os primeiros 5 mL foram coletados separadamente e desprezados.
A coleta de sangue é realizada em qualquer período do ciclo menstrual, exceto durante a menstruação.
Métodos
O sangue (9 mL) foi dispensado em tubo de polietileno, anticoagulado com citrato de sódio 0,11 mol/L (1 mL), centrifugado por 20 minutos a 2500 g e armazenado em tubos de polietileno -70oC por seis meses. Para as análises laboratoriais, as amostras foram descongeladas rapidamente a 37oC em banho-maria.
As análises laboratoriais do pré e pós-tratamento foram realizadas concomitantemente para minimizar possíveis interferências de variações interensaios.
Foram avaliados os seguintes parâmetros hemostáticos: TP, TTPA, concentração plasmática de fibrinogênio e atividades dos fatores VII, VIII, IX, X e XII foram medidos através de equipamento automatizado da Organon Teknika (Durham, North Carolina, EUA).
A atividade da antitrombina, alfa-2-antiplasmina e plasminogênio foi realizada por ensaios cromogênicos da Organon Teknika (Boxtel, Netherlands). As concentrações plasmáticas de proteína C, proteína S total, t-PA, PAI-1 e PDF foram determinadas através de kits de ELISA da Organon Teknika (Boxtel, Netherlands).
Análise estatística
A análise estatística dos dados foi feita através do teste de Wilcoxon (não paramétrico para amostras dependentes), com um nível de significância de p £ 0,05.
Resultados
Representação gráfica dos resultados estatisticamente significantes:
Discussão
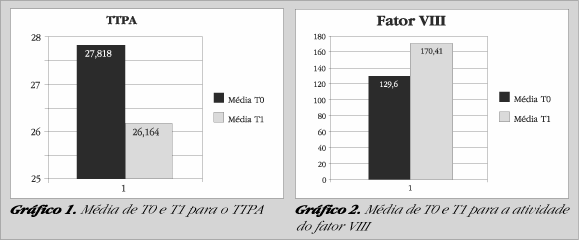
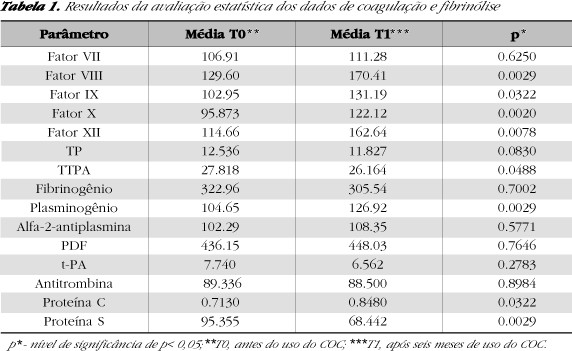
As alterações observadas indicam que o COC estudado causa alterações pró-coagulantes devido ao aumento nas atividades dos fatores VIII (Gráfico 2), IX (Gráfico 3), X (Gráfico 4) e redução do TTPA (Gráfico 1). Também foi observado um aumento na atividade do fator XII (Gráfico 5), entretanto essa não pode ser descrita como uma alteração pró-coagulante, devido à ação pró-fibrinolítica desse fator. A deficiência congênita de fator XII já foi associada a um risco aumentado de tromboembolismo venoso, entretanto, essa associação não está bem estabelecida (37). Daume (1990) encontrou atividade aumentada desses quatro fatores em usuárias de COC contendo 30 µg de EE e 150 µg de desogestrel, entretanto, seus resultados discordam dos obtidos nesse estudo com relação ao fator VII, que também teve sua atividade aumentada naquele estudo (27).
Alguns pesquisadores relataram que o progestágeno desogestrel causa efeitos sobre a hemostasia mais acentuados quando comparado ao gestodene (2, 26). Estudos comparando formulações contendo a mesma dose de EE, mas com diferentes componentes progestagênicos, mostram que o progestágeno pode agir modulando os efeitos do estrógeno sobre a hemostasia (7, 12, 18). Os efeitos do EE sobre as plaquetas, endotélio e macrófagos podem ser atenuados ou exacerbados pelo progestágeno, o que pode resultar diferentes alterações nas atividades coagulante e fibrinolítica. Portanto, diferentes formulações de COCs podem alterar a síntese, ativação e turnover de vários parâmetros hemostáticos de formas diferentes (3). Os progestágenos também agem como antagonistas de estrógenos em vários tecidos, particularmente sobre o metabolismo hepático, e o grau com que essa regulação ocorre depende das propriedades androgênicas do progestágeno (3). Diversos estudos comparando a seletividade de diferentes moléculas por receptores de progestágenos e andrógenos mostraram que o 3-cetodesogestrel, que é o metabólico ativo do desogestrel, possui maior especificidade pelos receptores de progestágenos quando comparado ao levonorgestrel, noretindrona e gestodene (38). Portanto, o desogestrel possui menor efeito androgênico do que o gestodene, o que poderia explicar a diferença nas alterações hemostáticas.
Os aumentos observados nas atividades dos fatores IX e X e no TTPA permaneceram dentro da faixa de referência, entretanto, para os fatores VIII e XII os aumentos das atividades ultrapassaram o limite superior da faixa de referência (150%). Nas situações onde ocorre a ativação da cascata da coagulação, o aumento nos níveis de fatores, ainda que dentro do normal, pode implicar em resposta exacerbada tornando a mulher mais vulnerável aos efeitos trombogênicos (2). Níveis elevados de determinados fatores da coagulação, como por exemplo o VIII, estão associados à ocorrência de eventos tromboembólicos (39). Entretanto, Mammen (1982) sugeriu que os fatores da coagulação circulam em níveis elevados, mesmo sob condições fisiológicas ou patológicas que não estão associadas a um risco aumentado de trombose, e que certos aumentos em alguns fatores da coagulação não podem ser interpretados como efeitos trombogênicos dos COCs (32). Deve-se lembrar também que as atividades dos fatores da coagulação foram medidas no sangue periférico e que nenhum fator que promove ou impede a coagulação no sítio de formação do trombo foi avaliado.
Um importante mecanismo de ação dos hormônios sexuais esteroidais, como a progesterona e o 17-ß-estradiol, é a alteração da expressão gênica. Este efeito pode ser de forma indireta, através da alteração da quantidade de cálcio intracelular, ou de forma direta através da ligação a receptores de hormônios que são ligados a fatores nucleares que são capazes de controlar a transcrição se ligando a uma sequência específica de DNA. Esse mecanismo já foi descrito para o gene do fator XII, onde um aumento da taxa de transcrição gênica foi observado no tratamento com 17-ß-estradiol, o que pode explicar o aumento da atividade desse fator encontrado nas usuárias do COC do grupo III (40). Muitos aspectos sobre as bases moleculares dos efeitos dos hormônios sexuais sobre a hemostasia precisam ser esclarecidos (13).
Com relação à concentração plasmática de fibrinogênio e a atividade do fator VII, não encontramos alterações estatisticamente significantes (Tabela 1). Esses resultados discordam da maioria dos autores, que relatam um aumento desses parâmetros em usuárias de COCs (20). Kelleher (1990) relatou que o uso de COCs aumenta os riscos de ocorrência de eventos tromboembólicos, particularmente, pelos efeitos sobre o fator VII e fibrinogênio (21).
O tratamento com o COC promoveu aumento acentuado na atividade do plasminogênio (Gráfico 6), o que poderia sugerir um aumento da atividade fibrinolítica compensatório ao efeito pró-coagulante. Esse mecanismo de restabelecimento do equilíbrio hemostático é descrito pela maioria dos autores, e é evidenciado de maneira acentuada por uma redução da concentração plasmática e da atividade do PAI-1, por uma redução da concentração plasmática e um aumento da atividade do t-PA e por um aumento dos PDF (8, 12, 18, 20, 22, 41). Entretanto, nossos dados não apontam alterações estatisticamente significantes em nenhum desses parâmetros, o que não contribui para a hipótese anterior. Petersen et al. (1993) também encontraram que o COC contendo 20 µg EE e 150 µg desogestrel não altera os níveis dos PDF (20).
Levi et al. (1998) sugeriram que os progestágenos de terceira geração atuam diminuindo os efeitos pró-fibrinolíticos do componente estrogênico dos COCs, o que explicaria o aumento do risco de tromboembolismo venoso em usuárias de COCs que contêm esses progestágenos, quando comparado aos COCs de segunda geração (15). Os dados obtidos nesse estudo estão de acordo com essa hipótese, já que não encontramos alterações pró-fibrinolíticas suficientes para sugerir que um restabelecimento do equilíbrio hemostático é alcançado.
Sugerimos que a alteração do plasminogênio pode estar relacionada a um aumento da sua síntese pelo fígado, que pode ser mediada pela ação estrogênica sobre a síntese de proteínas nos hepatócitos. Dessa forma, um mecanismo compensatório não poderia ser garantido, já que o aumento na gênese e na degradação de fibrina seriam independentes. Gevers Leuven et al. (1987) relataram que as alterações pró-coagulantes e pró-fibrinolíticas observadas em usuárias de COCs não são balanceadas individualmente, de forma que o suposto efeito compensatório pode não ocorrer (30). Kluft & Lansink (1997) concluíram que o equilíbrio entre a coagulação e a fibrinólise pode ser alcançado em usuárias de COCs, mas que eles não fazem parte de um processo regulado e que fatores individuais contribuem para que isso ocorra ou não (2).
Além do aumento do plasminogênio, a única alteração pró-fibrinolítica, é o aumento da atividade do fator XII (Gráfico 5). Entretanto, esse fator apresenta menor importância fisiológica na ativação do plasminogênio (42).
Com relação aos inibidores naturais da coagulação, nossos resultados estão de acordo com vários autores, que também encontraram uma redução de proteína S total (Gráfico 8) e um aumento de proteína C (Gráfico 7) (11, 20, 31, 43). A diminuição de proteína S total poderia estar relacionada a um aumento da sua requisição como cofator da proteína C, estando associada a um aumento da inibição da coagulação. Entretanto, uma segunda hipótese é que a produção de proteína S está diminuída, de forma que a atividade da proteína C ativada fica prejudicada pela redução dos níveis do seu cofator. Já o aumento no inibidor natural da coagulação proteína C poderia estar associado a um efeito compensatório, devido às alterações pró-coagulantes, de maneira que a atividade inibitória sobre a coagulação estaria aumentada. Entretanto, devido à diminuição de proteína S, o aumento de proteína C pode não estar relacionado a uma maior atividade anti-coagulante, mas a uma redução dessa atividade devido à falta do seu cofator.
Deve ser ressaltado que uma resistência à proteína C ativada adquirida é observada em usuárias de COCs (4-46). Rosing et al. (1999) demonstraram que usuárias de COCs contendo desogestrel apresentam esse efeito de forma mais acentuada quando comparado aos COCs contendo levonorgestrel, e que ele foi acompanhado de uma diminuição dos níveis de proteína S (45). Olivieri et al. (1995), além desses resultados, encontraram um aumento nos níveis de proteína C e redução do TTPA (46). Entretanto, Henkens et al. (1995) descreveram que o nível plasmático de proteína S não interfere na sensibilidade a proteína C ativada, de forma que nenhuma correlação entre esses dois parâmetros pode ser estabelecida (44).
Não encontramos alterações estatisticamente significantes na atividade da antitrombina (Tabela 1). Esses resultados estão de acordo com os obtidos por outros autores, que também não encontraram mudanças na antitrombina em usuárias de COCs de terceira geração (8, 19). Entretanto, os relatos sobre alterações causadas pelos COCs na antitrombina têm sido conflitantes, já que alguns autores relatam uma atividade e concentração plasmática reduzidas. Além disso, a capacidade de inibição do fator Xa é significativamente reduzida de uma maneira dose-dependente entre mulheres na pré e pós-menopausa que fazem uso de estrógenos (17).
Não se tem encontrado alterações na atividade da alfa-2-antiplasmina em usuárias de COCs, o que está de acordo com os resultados obtidos nesse estudo (17).
Leck et al. (1991), em um estudo envolvendo quatro centros diferentes, demonstraram que fatores étnicos/geográficos influenciam nas alterações sobre o sistema hemostático causadas pelos COCs. Tal autor relata que diferentemente dos demais resultados, não foram encontradas alterações sobre a atividade fibrinolítica em mulheres negras e mulatas de Salvador (35). Famodu & Osadebe (1998) encontraram o mesmo resultado em mulheres africanas (47). Portanto, as alterações descritas em estudos com populações caucasianas podem não se repetir em outras populações, de forma que as diferenças observadas em nossos resultados, quando comparados com tais estudos, são esperadas. É interessante observar que não há relatos na literatura sobre os efeitos hemostáticos dos COCs em mulheres brasileiras, impossibilitando assim uma comparação dos dados obtidos nesse estudo sem a interferência dos fatores étnicos-geográficos.
Effects of the oral contraceptive containing 20 µg of etinilestradiol and 150 µg of desogestral on the coagulation and fibrinolise systems
Abstract
The aim of this work is to evaluate the effects on coagulation and fibrinolysis of the oral contraceptives of third generation in Brazilian women and the impact on these effects by reducing ethinyl estradiol dosage. Eleven Brazilian women taking monophasic oral contraceptive containing 20 µg of ethinyl estradiol combined with 150 µg of desogestrel for six cycles consecutively entered this study. The effects on parameters pro-coagulants, anticoagulants, pro-fibrinolytics and fibrin turnover index were evaluated. The results from oral contraceptive increased significatively the factors VIII, IX, X and XII. With respect to coagulation inhibitors, no antithrombin changes were noted in both groups, increase in the levels of protein C and decrease in the levels of protein S total were noted. Concerning the fibrinolytic parameters, the oral contraceptive increased the plasminogen activity, although no changes on t-PA, and alpha-2-antiplasmin were observed. Similary, no changes on the levels of fibrin degradation products were observed, thus indicating that oral contraceptives did not interfere with generation and degradation of fibrin. The results obtained indicate that the oral contraceptives studied did not promote enough pro-fibrinolytic changes so as to state that a re-establishment occurs on haemostatic balance. Therefore, we suggest the use of this oral contraceptive can result in thromboembolic episode mainly in association with other factors such as congenital deficiency of natural clotting inhibitor antithrombin, protein C or protein S.
Key-words: Contraceptives, coagulation, fibrinolysis
Departamento de Análises Clínicas, Toxicológicas e Bromatológicas da Faculdade de Ciências Farmacêuticas de Ribeirão Preto USP
Correspondência para: Ana Carla Pereira Ferreira
Depto. de Análises Clínicas, Toxicológicas e Bromatológicas da Fac. de Ciências Farm. de Ribeirão Preto da USP
Avenida do Café s/no. CEP: 14040-903. Ribeirão Preto. São Paulo. E-mail: anacarla@fcfrp.usp.br. Fone: (16) 602-4189
Prêmio Marcello Pio da Silva de melhor trabalho em Hemostasia do XXIV Congresso Brasileiro de Hematologia e Hemoterapia, Rio de Janeiro, Maio de 2000
- 1. Verstraete, M.; Vermylen, J. Determinantes celulares, químicos e reológicos da trombose e fibrinólise Trombose São Paulo, Sarvier, 1989. Cap.1,p.1-45:.
- 2. Kluft, C.; Lansink, M. Effect of oral contraceptives on haemostasis variables. Thrombosis and Haemostasis, v.78, n.1, p.315-26, 1997.
- 3. Kuhl, H. Effects of progestogens on haemostasis Maturitas, v.24, n.1/2, p.1-19, 1996.
- 4. Winkler, U.H. et al. Ethinylestradiol 20 versus 30 µg combined with 150 µg desogestrel: a large comparative study of the effects of two low-dose oral contraceptives on the hemostatic system Gynecol. Endocrinol, v.10, p.265-71, 1996.
- 5. Bonnar, J. Coagulation effects of oral contraception. Am. J. Obstet. Gynecol., v.157, n.4, p.1042-8, 1987.
- 6. Quehenberger, Q. et al. Studies on oral contraceptives-induced changes in blood coagulation and fibrinolysis and the estrogen effect on endothelial cells. Ann. Hematol, v.67, p.33-6, 1993.
- 7. Jespersen, J.; Petersen, K.R.; Skouby, S.O. Effects of newer oral contraceptives on the inhibition of coagulation and fibrinolysis in relation to dosage and type of steroid Am. J. Obstet. Gynecol, v.163, n.1, p.396-403, 1990.
- 8. Abbate, R. et al. Effects of long-term gestodene-containing oral contraceptive administration on hemostasis. Am. J. Obstet. Gynecol, v.163, n.1, p.424-9, 1990.
- 9. Melis, G.B. et al. A comparative estudy on the effects of a monophasic pill containing desogestrel plus 20 micrograms ethinylestradiol, a triphasic combination containing levonorgestrel and a monophasic combination containing gestodene on coagulatory factors. Contraception, v.43, n.1, p.23-31, 1991.
- 10. Basdevant, A. et al. Hemostatic and metabolic effects of lowering the ethinyl-estradiol dose from 30 mcg to 20 mcg in oral contraceptives containing desogestrel Contraception, v.48, n.3, p.193-204, 1993.
- 11. Winkler, U.H. et al. A comparative study of the effects of the hemostatic system of two monophasic gestodene oral contraceptives containing 20 micrograms and 30 micrograms ethinylestradiol Contraception, v.53, n.2, p.75-84, 1996.
- 12. Norris, L.A.; Bonnar, J. Haemostatic changes and the oral contraceptive pill Baillieres Clin. Obstet. Gynaecol., v.11, n.3, p.545-64, 1997.
- 13.Samsioe, G. Coagulation and anticoagulation effects of contraceptive steroids. Am. J. Obstet. Gynecol, v.170, p.1523-7, 1994.
- 14. Comp, P.C.; Zacur, H.A. Contraceptive choices in women with coagulation disorders. Am. J. Obstet. Gynecol., v.168, p.1990-3, 1993.
- 15. Levi, M.; Middeldorp, S.; Büller, H.R. Oral contraceptives and hormonal replacement therapy cause na imbalance in coagulation and fibrinolysis which may explain the increased risk of venous thromboembolism Cardiovascular Research, v.41, p.21-4, 1999.
- 16. Vandenbroucke, J.P. et al. Third-generation oral contraceptive and deep venous thrombosis: from epidemiologic controversy to new insight in coagulation. Am. J. Obstet. Gynecol., v.177, n.4, p.887-91, 1997.
- 17. Wessler, S. Estrogen-associated thromboembolism. Ann. Epidemiol., v.2, n.4, p.439-43, 1992.
- 18. Norris, L.A.; Bonnar, J. The effect of oestrogen dose and progestogen type on haemostatic changes in women taking low dose oral contraceptives Br. J. Obstet. Gynaecol, v.103, n.3, p.261-7, 1996.
- 19. Bonnar, J.; Daly, L.; Carroll, E. Blood coagulation with a combination pill containing gestodene and ethinylestradiol Int. J. Fertil., p.21-8, 1987. Supplement 32.
- 20. Petersen, K.R. et al. Effects of monophasic low-dose oral contraceptives on fibrin formation and resolution in young women. Am. J. Obstet. Gynecol, v.168, p.32-8, 1993.
- 21. Kelleher, C.C. Clinical aspects of the relationship between oral contraceptives and abnormalities of the hemostatic system: relation to the development of cardiovascular disease Am. J. Obstet. Gynecol, v.163, n.1, p.392-5, 1990.
- 22. Winkler, U.H. et al. Hemostatic effects of two oral contraceptives containing low doses of ethinyl estradiol and either gestodene or norgestimate: na open, randomized, parallel-group study Int. J. Fertil., v.40, n.5, p.260-8, 1995.
- 23. Winkler, U.H. et al. A randomized controlled double-blind study of the effects on hemostasis of two progestogen-only pills containing 75 microgram desogestrel or 30 microgram Levonorgestrel Contraception, V.57, N.6, P.385-92, 1998.
- 24. Creatsas, G. et al. Effects of two combined monophasic and triphasic ethinylestradiol/gestodene oral contraceptives on natural inhibitors and other hemostatic variables Eur. J. Contracept. Reprod. Health Care, v.2, n.1, p.31-8, 1997.
- 25. Comp, P.C. Thrombophilic mechanisms of Ocs Int. J. Fertil. Womens Med., p.170-6, 1997. Supplement 1.
- 26. Leisha, D.; Bonnar, J. Comparative studies of 30 µg ethinyl estradiol combined with gestodene and desosgestrel on blood coagulation, fibrinolysis and platelets. Am. J. Obstet. Gynecol, v.163, n.1, p.430-7, 1990.
- 27. Daume, E. Influence of modern low-dose oral contraceptives on hemostasis. Adv. Contracept., p.51-67, 1990. Supplement 6.
- 28. David, J.L. et al. Hemostasis profile in women taking low-dose oral contraceptives. Am. J. Obstet. Gynecol., v.163, n.1, p.420-3, 1990.
- 29. Farag, A.M. et al. Oral contraceptives and the hemostatic system. Obstetrics and Gynecology, v.71, n.4, p.584-8, 1988.
- 30. Gevers, L.J.A. et al. Effects of two low dose oral contraceptive on circulating components of the coagulation and fibrinolytic systems. J. Lab. Clin. Med., v.109, n.6, p.631-6, 1987.
- 31. Quehenberger, P. et al. Increased levels of activated factor VII and decreased plasma protein S activity and circulating thrombomodulin during use of oral contraceptives. Thrombosis and Haemostasis, v.76, n.5, p.729-34, 1996.
- 32. Mammen, E.F. Oral contraceptives and blood coagulation: a critical review. Am. J. Obstet. Gynecol., v.142, n.6, p.781-90, 1982.
- 33. Beller, F.K.; Ebert, C. Effects of oral contraceptives on blood coagulation. A review. Obstetrical and Gynecological Survey, v.40, n.7, p.425-36, 1985.
- 34. Winkler, U.H. Blood coagulation and oral contraceptives. A critical review. Contraception, v.57, n.3, p.203-9, 1998.
- 35. Leck, I. et al. A multicentre study of coagulation and haemostatic variables during oral contraception: variations with geographical special programme of research, development and research training in human reproduction Int. J. Epidemiol., v.20, n.4, p.913-20, 1991.
- 36. Vessey, M.P. et al. Mortality among oral contraceptives users: 20 years follow up of women in a cohort study. Br. Med. J., v.299, p.1487-91, 1989.
- 37. Zeerleder, S. et al. Reevaluation of the incidence of thromboembolic complications in congenital factor XII deficiency. A study on 73 subjects from 14 Swiss families. Thrombosis and Haemostasis, v.82, n.4, p.1240-6, 1999.
- 38. Stone, S. Clinical review of a monophasic oral contraceptive containing desogestrel and ethinyl estradiol Int. J. Fertil., v.37, n.5, p.286-9, 1992.
- 39. Bloemenkamp, K.W. et al. Venous thrombosis, oral contraceptives and high factor VIII levels Thrombosis and Haemostasis, v.82, n.3, p.1024-7, 1999.
- 40. Farsetti, A. et al. Orphan receptor hepatocyte nuclear factor-4 antagonizes estrogen receptor a-mediated induction of human coagulation factor XII gene Endocrinology, v.139, n.11, p.4581-9, 1998.
- 41. Gram, J.; Munkvad, S.; Jespersen, J. Enhanced generation and resolution of fibrin in women above the age of 30 years using oral contraceptives low in estrogen Am. J. Obstet. Gynecol, v.163, p.438-42, 1990.
- 42. Kooistra, T. et al. Studies on the mechanisms of action of oral contraceptives with regard to fibrinolytic variables Am. J. Obstet. Gynecol., v.163, p.404-12, 1990.
- 43. Abdelmonem, M.F. et al. Oral contraceptives and the hemostatic system Obstet. Gynecol, v.71, p.584-8, 1988.
- 44. Henkens, C.M.A. et al. Sensitivity to activated protein c; influence of oral contraceptives and Sex Thrombosis and Haemostasis, v.73, n.3, p.402-4, 1995.
- 45. Rosing, J. et al. Low-dose oral contraceptives and acquired resistance to activated protein C: a randomised cross-over study. The Lancet, v.354, p.2036-40, 1999.
- 46. Olivieri, O. et al. Resistance to activated protein C in healthy women taking oral contraceptives Britsh Journal of Haematology, v.91, n.2, p.465-70, 1995.
- 47. Famodu, A.A.; Osadebe, W.C. Effects of oral contraceptives on coagulation factors in african women Thrombosis Research, v.90, p.27-30, 1998.
Datas de Publicação
-
Publicação nesta coleção
23 Jun 2003 -
Data do Fascículo
Ago 2000