Resumos
O advento da AIDS trouxe novos desafios para a Dermatologia. A terapia antirretroviral mudou drasticamente a morbimortalidade associada à infecção pelo HIV/AIDS, mas contribuiu para o surgimento de outras novas situações que exigem abordagem adequada do dermatologista. A Síndrome Lipodistrófica Associada ao HIV/AIDS tem origem multifatorial, mas está fortemente associada ao uso dos antirretrovirais. Compreende alterações na distribuição da gordura corporal, acompanhada ou não de alterações metabólicas. A perda da gordura da face, chamada lipoatrofia facial, é dos sinais mais estigmatizantes da síndrome. Esta condição, muitas vezes reveladora da doença, trouxe de volta o estigma da AIDS. É necessário que os especialistas que atuam com pacientes com HIV/AIDS identifiquem estas alterações e busquem opções de tratamento, dentre as quais se destaca o implante com polimetilmetacrilato, que é disponibilizado para tratamento da lipoatrofia facial associada ao HIV/AIDS no Sistema Único de Saúde
HIV; Polimetil metacrilato; Procedimentos cirúrgicos ambulatórios; Síndrome de lipodistrofia associada ao HIV; Terapêutica
The advent of AIDS has brought new challenges to Dermatology. Antiretroviral therapy dramatically changed the morbidity and mortality associated with HIV / AIDS, but contributed to the emergence of other new situations that require adequate approach by the dermatologist. The HIV / AIDS Associated Lipodystrophy Syndrome is multifactorial in origin, but it is strongly associated with the use of antiretroviral drugs. It includes changes in body fat distribution, with or without metabolic changes. The loss of facial fat, called facial lipoatrophy, is one of the most stigmatizing signs of the syndrome. This condition, often revealing of the disease, brought back the stigma of AIDS. It is necessary that the specialists working with patients with HIV / AIDS identify these changes and seek treatment options, amongst which stands out the implant with polymethylmethacrylate, which is available for the treatment of HIV / AIDS facial lipoatrophy in the Brazilian Public Health System
Ambulatory surgical procedures; HIV; HIV-associated lipodystrophy syndrome; Polymethyl methacrylate; Therapeutics
EDUCAÇÃO MÉDICA CONTINUADA
Lipoatrofia facial associada ao HIV/AIDS: do advento aosconhecimentos atuais* * Trabalho realizado no Hospital Universitário de Brasília - Universidade de Brasília (HUB - UnB) - Brasília (DF), Brasil.
Flávia Machado Gonçalves SoaresI; Izelda Maria Carvalho CostaII
IMestre em Ciências da Saúde pela Universidade de Brasília (UnB) - Médica da Secretaria de Saúde do Distrito Federal - Brasília (DF), Brasil
IIDoutora em Dermatologia pela Universidade de São Paulo (USP) - Professora- adjunta de Dermatologia da Universidade de Brasília (UnB) - Brasília (DF), Brasil
Correspondência Endereço para Correspondência: Flávia Machado Gonçalves Soares SHIS QI 27 conj 01 casa 07 Lago Sul 71675-010 Brasília-DF E-mail: flaviamachadosoares@gmail.com
RESUMO
O advento da AIDS trouxe novos desafios para a Dermatologia. A terapia antirretroviral mudou drasticamente a morbimortalidade associada à infecção pelo HIV/AIDS, mas contribuiu para o surgimento de outras novas situações que exigem abordagem adequada do dermatologista. A Síndrome Lipodistrófica Associada ao HIV/AIDS tem origem multifatorial, mas está fortemente associada ao uso dos antirretrovirais. Compreende alterações na distribuição da gordura corporal, acompanhada ou não de alterações metabólicas. A perda da gordura da face, chamada lipoatrofia facial, é dos sinais mais estigmatizantes da síndrome. Esta condição, muitas vezes reveladora da doença, trouxe de volta o estigma da AIDS. É necessário que os especialistas que atuam com pacientes com HIV/AIDS identifiquem estas alterações e busquem opções de tratamento, dentre as quais se destaca o implante com polimetilmetacrilato, que é disponibilizado para tratamento da lipoatrofia facial associada ao HIV/AIDS no Sistema Único de Saúde.
Palavras-chave: HIV; Polimetil metacrilato; Procedimentos cirúrgicos ambulatórios; Síndrome de lipodistrofia associada ao HIV; Terapêutica
INTRODUÇÃO
Tendo a AIDS se tornado uma doença crônica e manejável, reconhecer e tratar os quadros associados à própria infecção e aos efeitos adversos dos antirretrovirais é imprescindível. A lipoatrofia facial associada ao HIV/AIDS tem se tornado epidêmica, e todos os envolvidos na assistência a este grupo de pacientes devem reconhecer os sinais da síndrome lipodistrófica, bem como os tratamentos indicados, que devem sempre ser incorporados ao arsenal terapêutico dos pacientes portadores de HIV/AIDS.
1. SÍNDROME DA IMUNODEFICIÊNCIA ADQUIRIDA
1.1 HISTÓRICO
Em junho de 1981, o Morbidity and Mortality Weekly Report (MMWR), do Centers for Disease Control (CDC), instituição responsável pela vigilância epidemiológica nos Estados Unidos, divulgou artigo relatando 5 casos de pneumonia causada pelo então chamado Pneumocystis carinii em homens jovens, anteriormente saudáveis, que tinham em comum o fato de serem homossexuais.1 Um mês depois, o MMWR divulgou outro artigo histórico sobre a epidemia da Acquired Immunodeficiency Syndrome (AIDS) relatando, desta vez, um surto de sarcoma de Kaposi e pneumonia por Pneumocystis carinii entre as comunidades homossexuais masculinas de Nova York e Los Angeles.2 Em dezembro de 1981, concluíram tratar-se de uma doença infecciosa. A procura de um agente causador de imunossupressão, constatada invariavelmente em todos os casos, tornou-se, então, uma prioridade.
A primeira indicação de que a Aids seria causada por um retrovírus aconteceu em 1983, quando foi isolado um vírus com atividade de transcriptase reversa. Este vírus é atualmente designado como vírus da imunodeficiência humana tipo 1 (HIV-1). Em 1986, um outro retrovírus foi isolado, sendo denominado vírus da imunodeficiência humana tipo 2 (HIV-2).3
Os modos de transmissão da AIDS tornaram-se conhecidos antes mesmo da identificação de seu agente etiológico, por meio da investigação epidemiológica. Foi quando surgiu a noção de grupo de risco, que acabou por colaborar com o aumento da discriminação a homossexuais e usuários de drogas, e para o surgimento de um pesado estigma para os portadores da AIDS. Posteriormente, verificou-se uma tendência à generalização da doença a toda a população em alguns países afetados.4
As práticas sexuais foram identificadas como importante via de transmissão do HIV desde as primeiras investigações sobre a doença. Estima-se que 75% a 85% das infecções por HIV ocorridas em todo o mundo tenham se dado por meio das práticas sexuais. Outra forma de transmissão do HIV, a perinatal ou vertical, pode ocorrer intraútero, durante o trabalho de parto, ou por meio da amamentação. A taxa de transmissão mãe/filho varia de 15 a 35%, na ausência da terapia antirretroviral. A transmissão do HIV pelo sangue, por sua vez, é a via mais eficiente. O desenvolvimento de testes sorológicos cada vez mais sensíveis para a detecção do HIV reduziu enormemente o risco de transfusão sanguínea contaminada. O compartilhamento de material de injeção entre os usuários de drogas injetáveis exibe um grande potencial de disseminação do HIV e em alguns países representa o principal fator de risco para a infecção pelo vírus. Transplantes, diálises e outros procedimentos hospitalares, como a inseminação artificial, já foram descritos na literatura como formas de transmissão do HIV.4
A primeira definição de caso de AIDS foi publicada no MMWR, em setembro de 1982, baseada exclusivamente na presença de infecções oportunistas, quando ainda não se dispunha de um teste que identificasse o HIV. O teste para identificar a presença do vírus passa a ser um item fundamental na definição de casos a partir de 1985. Em 1993, o CDC expandiu a definição de caso, incluindo as pessoas infectadas pelo HIV com contagem de células CD4+ inferior a 200 células/mm3 de sangue, e ampliando a lista préexistente de doenças indicativas de AIDS. A definição de caso elaborada pelo CDC foi adotada e modificada por vários países, inclusive o Brasil. A primeira definição de caso de AIDS adotada pelo Brasil foi em 1987.5
1.2 IMUNOPATOGÊNESE
Na década de 1990, começaram a ser esclarecidos os aspectos da infecção pelo HIV bem como o próprio funcionamento do sistema imune dos seres humanos. A integração do genoma viral nas células infectadas, principalmente das células T, é a causa das principais alterações na expressão de genes da célula hospedeira, levando à destruição destas células bem como à de células não-infectadas. Os pacientes apresentam queda progressiva da função e do número de células T helper, acompanhada de hipergamaglobulinemia. Um desequilíbrio na rede de citocinas nos pacientes infectados poderia ser responsável, ao menos em parte, pelas alterações imunológicas que levam à AIDS. A infecção viral também causa mudanças na homeostase não-imunológica, com consequências no processo imunológico, como a elevação no nível da substância P que, por sua vez, aumenta a expressão do HIV nos monócitos. Ocorrem, ainda, mudanças nos processos celulares básicos, como o ciclo de regulação celular, resultando em morte celular programada prematura.6
Três importantes populações de células são infectadas pelo HIV: os linfócitos T helper ou CD4+, os monócitos e os macrófagos. A maior parte da replicação viral ocorre em linfócitos CD4+, em sangue periférico ou em tecido linfoide. A marca da infecção pelo HIV é uma depleção seletiva de linfócitos CD4+.6
A história natural da infecção por HIV varia de indivíduo para indivíduo. Os níveis plasmáticos de ácido ribonucleico (RNA) do HIV-1 e a contagem de linfócitos CD4+ são as variáveis mais importantes que determinam a taxa de progressão. O resultado da deterioração progressiva do sistema imune, que ocorre na maioria dos pacientes com infecção pelo HIV, é o desenvolvimento de doença clinicamente aparente ou AIDS.5
Na ausência de tratamento, a duração típica da soroconversão até o desenvolvimento da Aids é de 10 anos. No estudo San Francisco Clinical Cohort, 54% dos pacientes apresentaram progressão para a Aids em 11 anos. A sobrevivência após a queda da contagem de CD4+ para 200 células/mm3 é de, em média, 38 a 40 meses. Alguns pacientes progridem rapidamente para o desenvolvimento da Aids, entre 3 e 5 anos. Por outro lado, os chamados não-progressores a longo prazo, cerca de 1% dos infectados, podem ter contagem normal de CD4+ e baixas cargas virais por mais de 10 a 20 anos. Na ausência de tratamento, a mediana de sobrevivência, após o diagnóstico de Aids clinicamente definida, é de cerca de 9 meses.7
1.3 EPIDEMIOLOGIA
O número de infectados pelo HIV no mundo ainda é desconhecido. A Organização Mundial de Saúde (OMS) e a United Nations Programs on HIV/AIDS (UNAIDS) estimam que, em 2008, era de 33,4 milhões o número de pessoas vivendo com HIV/AIDS no mundo. Apenas em 2008, 2,7 milhões de pessoas foram infectadas e houve 2 milhões de mortes associadas ao HIV. Na América Latina, em 2008, eram estimadas 2 milhões de pessoas vivendo com HIV/AIDS, e 170.000 novos infectados no ano.8 Estima-se que 2/3 dos infectados pelo HIV na América Latina residam no Brasil.9
Dos casos notificados nas Américas até 2001, 67,19% ocorreram nos Estados Unidos, seguidos pelo Brasil, com 17,99%. O Brasil, do início de 1980 a 31 de dezembro de 2003, registrou 348.250 casos. A região Sudeste concentra 65,3% desses casos. Embora inicialmente concentrada em um grupo de homens que fazem sexo com homens, a epidemia alcançou usuários de drogas injetáveis e a população geral, com um aumento no número de mulheres infectadas. A partir de 1990, constatou-se uma transição do perfil epidemiológico, resultando na heterossexualização, feminização, pauperização e interiorização da epidemia. A relação masculino/feminino que era de 25/1 em 1985 atingiu 1 mulher para 1,6 homens em 1996. É estimado que a maior proporção de transmissão entre as mulheres se dê por contato sexual com seus parceiros. Entretanto, o sexo sem proteção entre homens continua um importante fator, respondendo por cerca de metade das infecções que são transmitidas sexualmente no Brasil.9,10
Os dados permitem afirmar que a epidemia de AIDS no Brasil está em processo de estabilização, embora em patamares elevados, tendo atingido, em 2003, 18,4 casos por 100 mil habitantes e, em 2008, 18,2 casos por 100 mil habitantes. Entretanto, observa-se, ainda, o crescimento da epidemia entre as mulheres. Em 1986, a razão de sexo (M/F) era de 15,1/1 e a partir de 2002 atingiu a razão de 1,5/1. Até junho de 2007, foram identificados cerca de 474 mil casos da doença no Brasil.10-12
Os óbitos pela doença até junho de 2006 somam cerca de 192 mil. As taxas de mortalidade são crescentes até meados da década de 90. A partir do ano 2000, essa taxa estabilizou-se em cerca de 6,4 óbitos por 100 mil habitantes, sendo que o coeficiente de mortalidade por AIDS no Brasil em 2008 foi de 6,1/100 mil habitantes.11,12
1.4 TERAPIA ANTIRRETROVIRAL
A história natural da infecção pelo HIV vem sendo alterada, consideravelmente, pela terapia antirretroviral (TARV), que retarda a evolução da infecção até o seu estágio final, em que surgem as manifestações definidoras de AIDS. Juntamente com as campanhas de prevenção, os antirretrovirais (ARV) parecem estar contribuindo para a estabilização do progresso desta epidemia no Brasil e no mundo, refletindo-se na redução da incidência de AIDS e na redução, em cerca de 50%, da taxa de letalidade nos últimos anos.12
Segundo a OMS, há 42% de cobertura de uso de ARV dentre os infectados pelo HIV no mundo. Na América Latina, a cobertura é maior do que a média mundial, sendo de 54%.8
A TARV conta, hoje, com 17 medicamentos que estão divididos em 4 classes: os inibidores de transcriptase reversa análogos de nucleotídeos (ITRN), que atuam na enzima transcriptase reversa, incorporandose à cadeia de DNA que o vírus cria, tornando essa cadeia defeituosa e impedindo que o vírus se reproduza; os inibidores de transcriptase reversa não-análogos de nucleotídeos (ITRNN), que bloqueiam diretamente a ação da enzima, sua multiplicação e o desenvolvimento da infestação no organismo; os inibidores de protease (IP), que impedem a produção de novas cópias de células infectadas com HIV e os inibidores de fusão (IF), que impedem a entrada do vírus na célula.13
Para combater o HIV, é necessário utilizar pelo menos 2 medicamentos de classes diferentes, sendo que a maioria dos pacientes recebe de 3 a 4 medicamentos antirretrovirais. Porém, muitos medicamentos não podem ser utilizados juntos, pois interagem entre si, potencializando os efeitos tóxicos ou inibindo a sua ação.13
O uso de esquemas contendo associação de 3 medicamentos antirretrovirais sobrepujou a emergência de resistência viral facilmente observada com o uso da monoterapia ou terapia dupla contendo inibidores nucleosídicos da transcriptase reversa. Ao esquema combinado de 3 antirretrovirais contendo inibidores de protease foi dado o nome de Highly Active Antiretroviral Therapy (HAART) nos Estados Unidos e de tratamento antirretroviral altamente ativo ou simplesmente "coquetel" no Brasil.13
Com o advento do TARV, foi aventada a possibilidade de erradicação viral, mas os estudos demonstraram a impossibilidade da completa eliminação do HIV no organismo. Portanto, considerando-se os conhecimentos atuais, os pacientes com AIDS terão que fazer uso dos antirretrovirais por toda a vida. Os critérios adotados para o início da terapêutica levam em consideração o estado clínico do paciente e a contagem de linfócitos CD4+. A medida da carga viral é importante para a escolha adequada dos diversos esquemas disponíveis, assim como para o acompanhamento do resultado terapêutico, que tem por objetivo reduzir a carga viral para níveis abaixo de 50 cópias de RNA/mL, medida por meio da técnica da reação em cadeia da polimerase (PCR) ou similar.7
Há uma relação bem estabelecida entre o número de linfócitos circulantes CD4+ e a susceptibilidade à infecção. Além de doenças causadas pela imunossupressão, o vírus HIV pode causar doenças devido a danos diretos a certos órgãos ou a processos imunológicos. Numerosos estudos têm demonstrado que a resposta à terapia antirretroviral combinada de alta potência, quando medida pela contagem de CD4+ e carga viral do HIV, está associada à diminuição da progressão da doença e da incidência de morte. Esses estudos também demonstraram que as maiores reduções na carga viral estão associadas às maiores melhoras no resultado clínico. Mesmo diminuições modestas do RNA do HIV no plasma estão associadas a uma redução no risco subsequente de infecções oportunistas.7
O conhecimento da dinâmica viral e o surgimento de métodos laboratoriais capazes de mensurar a quantidade de vírus circulante no plasma (carga viral), bem como a contagem dos linfócitos CD4+, tornaram possível a monitorização confiável e objetiva da evolução e do tratamento da infecção pelo HIV.
O tratamento bem sucedido dos pacientes infectados depende da intervenção com agentes antirretrovirais, modalidades terapêuticas e profiláticas específicas que evitarão danos diretos aos órgãos pelo próprio HIV, não permitirão ou diminuirão o declínio imunológico e reduzirão a probabilidade de que infecções oportunistas e neoplasmas produzam morbidade e mortalidade.7
O Brasil é um dos primeiros países a adotar políticas de saúde significativas para a melhoria do atendimento aos portadores de HIV/AIDS. Entre essas políticas, destaca-se o acesso universal e gratuito da população aos medicamentos usados no tratamento da AIDS. Aproximadamente 181 mil pacientes estão em tratamento com os 16 antirretrovirais mais a talidomida 100mg, distribuídos pelo Sistema Único de Saúde (SUS). Estes medicamentos retardam o desenvolvimento da AIDS e possibilitam maior qualidade de vida ao portador do vírus. Agem na redução da carga viral e na reconstituição do sistema imunológico. Como resultado desta política de saúde, observa-se, no país, uma redução significativa da mortalidade e do número de internações por doenças oportunistas.12
A introdução da terapia antirretroviral como se conhece atualmente levou ao aumento da sobrevida dos pacientes soropositivos para o HIV, mas também está relacionada ao advento de problemas novos e importantes. Martinez e colaboradores mostraram que a redistribuição da gordura corpórea e as anormalidades metabólicas, a então chamada síndrome da lipodistrofia, estão entre os mais prevalentes e preocupantes efeitos colaterais da TARV.14
2. LIPODISTROFIA ASSOCIADA AO HIV/AIDS
2.1 HISTÓRICO
A partir de 1996, uma série de novas alterações anatômicas e metabólicas passou a ser descrita nos pacientes portadores de HIV/AIDS, particularmente naqueles em uso de terapia antirretroviral de alta eficácia. Os pacientes apresentavam atrofia da gordura periférica, bem como acúmulo da gordura central. Ao mesmo tempo, notou-se que a redistribuição de gordura corporal era acompanhada de resistência à insulina e várias anormalidades nos lípides séricos.15 Estas alterações foram, posteriormente, descritas de maneira genérica como lipodistrofia e/ou síndrome lipodistrófica do HIV (SLHIV).
A SLHIV foi oficialmente descrita pelo Food and Drug Administration (FDA), órgão norte-americano regulador da liberação e uso de medicamentos, em 1997.16
Os primeiros sinais morfológicos da SLHIV foram descritos cerca de 2 anos após a introdução dos inibidores de protease (IP). Contudo, a introdução dos IP coincide com a inclusão de um segundo inibidor da transcriptase reversa análogo do nucleosídeo, a estavudina.17
Inicialmente, a SLHIV foi denominada de "Crixbelly", pois os primeiros casos de redistribuição da gordura corporal foram observados após a utilização do Crixivan® (indinavir), medicamento da classe dos IP.18 A associação entre o uso do indinavir e a redistribuição da gordura corporal foi descrita em 1998, com o emprego de tomografia computadorizada, demonstrando o aumento da gordura visceral nesses indivíduos.15 Com o surgimento de novos IP, concluiu-se que a redistribuição da gordura corporal não era um efeito exclusivo do indinavir, sendo esta denominação abandonada.
Miller e colaboradores, após observarem as semelhanças clínicas entre pacientes com SLHIV e síndrome de Cushing, passaram a denominá-la de "pseudo-síndrome de Cushing".19 Porém, estudos posteriores não demonstraram alterações no eixo hipotálamohipófise-adrenal dos pacientes soropositivos para o HIV, sendo esta nomenclatura também abandonada.
Atualmente, várias sinonímias são utilizadas para a SLHIV, tais como síndrome da redistribuição da gordura corporal, síndrome metabólica associada à terapia antirretroviral ou, mais recentemente, lipodistrofia dislipidêmica associada ao HIV/TARV.20
2.2 ASPECTOS CLÍNICOS
As primeiras alterações corporais percebidas foram o acúmulo de gordura na região abdominal e na parte posterior do pescoço, as chamadas gibas.17
Outras alterações anatômicas compreendem a lipoatrofia da face, membros superiores e inferiores e uma proeminência das veias superficiais, associadas ou não a um acúmulo de gorduras na região do abdome, região cervical e nas mamas. As alterações metabólicas compreendem alterações lipídicas e anormalidades na homeostase da glicose. As alterações metabólicas podem estar associadas ou não às alterações anatômicas.16
As alterações lipídicas encontradas na SLHIV são o aumento dos níveis séricos de triglicérides (TGC) e/ou colesterol total, à custa das lipoproteínas de baixa densidade ou low-density lipoproteins (LDL), com tendência à diminuição dos níveis de lipoproteínas de alta densidade ou high-density lipoproteins (HDL).17
A hipertrigliceridemia deve-se, principalmente, às elevadas taxas de lipogênese de novo e à depuração retardada dos TGC no período pós-prandial.21 Estudos revelaram, ainda, que uma proporção significativamente aumentada de pacientes em uso de IP apresentava elevação dos níveis séricos de jejum de apoliproteínas B e E, possivelmente por síntese aumentada das mesmas, o que poderia estar relacionado à manifestação da hiperlipidemia.21 Além disso, a chamada síndrome plurimetabólica, na qual a obesidade abdominal, componente da SLHIV, correlaciona-se a alterações no metabolismo dos lipídeos, esteve presente em 18% dos pacientes em uso de ARV, sobretudo em pacientes em uso de IP.22
As anormalidades da glicose podem manifestarse como intolerância à glicose, resistência periférica à insulina ou diabetes mellitus (DM).17
Os mecanismos de ação pelos quais os ARV, como os inibidores de protease, causam a resistência à insulina seriam a redução da captação da glicose mediada por insulina em musculatura esquelética e adipócitos, interferindo nos transportadores transmembrana de glicose GLUT-4, além do efeito no fator de transcrição steroid regulatory element binding protein-1c (SREBP-1), afetando o metabolismo da glicose ao produzir expressões imperfeitas do receptor gama ativado por proliferador de peroxisoma (PPAR-gama).23
A acidose lática que ocorre na síndrome é, principalmente, causada por inibidores da transcriptase reversa análogo de nucleosídeos. É secundária à disfunção mitocondrial decorrente da inibição do ácido desoxirribonucleico (DNA) polimerase mitocondrial por esta classe de drogas. O estabelecimento da acidose lática é lento e os sintomas não são específicos.24
Ainda não está claro se a perda da densidade mineral óssea é componente da mesma síndrome.22 A necrose avascular tem sido considerada complicação da SLHIV, uma vez que a hiperlipidemia e a própria infecção pelo HIV são conhecidos fatores de risco para osteonecrose da cabeça do fêmur.21
As alterações metabólicas estão associadas ao aumento do risco de eventos cardiovasculares.17,24
A hiperinsulinemia associada à resistência à insulina é fator de risco reconhecido em pacientes não-infectados pelo HIV e pode contribuir para o risco aumentado de infarto agudo do miocárdio em pacientes recebendo ARV.23
Assim, pacientes HIV positivos, com prevalência significativamente maior de níveis elevados de glicemia de jejum e triglicerídeos e níveis baixos de colesterol HDL, têm risco aumentado de aterosclerose, doença coronariana e diabetes mellitus.23 O risco de desenvolver diabetes é de 6 a 10% nestes pacientes, e está ainda mais aumentado em pacientes obesos, coinfectados pelo vírus da hepatite C ou com história familiar de DM.24 Há relatos de aumento de 16% na incidência de infarto de miocárdio por ano de tratamento com antirretrovirais.24
Dentre as alterações anatômicas de redistribuição de gordura, identificam-se 3 grupos: a lipoatrofia, a lipo-hipertrofia e as formas mistas.
A lipoatrofia e a lipo-hipertrofia podem ocorrer de forma independente ou podem ocorrer juntas no mesmo paciente.24
Na lipo-hipertrofia ocorre acúmulo de gordura central ou localizado. O acúmulo de gordura pode ocorrer no abdome, na região cervical, no dorso, nas mamas e em outros locais de forma localizada. O abdome adquire aspecto globoso e o tecido gorduroso é comumente depositado intra-abdominal, nas vísceras ou entre elas. O aumento da pressão intra-abdominal pode predispor a hérnias abdominais que, eventualmente, podem necessitar de correção cirúrgica17.
Foi verificado, também, um lipoacúmulo no tronco superior, estendendo-se até as axilas em pacientes do sexo masculino, bem como na região cervical anterior e suprapúbica em ambos os sexos.22,24
O aumento do volume das mamas, no sexo feminino, se dá, basicamente, pelo componente gorduroso, sem associação obrigatória com a hipertrofia glandular. No sexo masculino, pode ocorrer ginecomastia (hipertrofia glandular) ou pseudo-ginecomastia (acúmulo de gordura).17
A lipo-hipertrofia está mais associada a pacientes com idade mais avançada ao início do tratamento, índice de massa corporal mais elevado, e ao uso de inibidores de protease.24
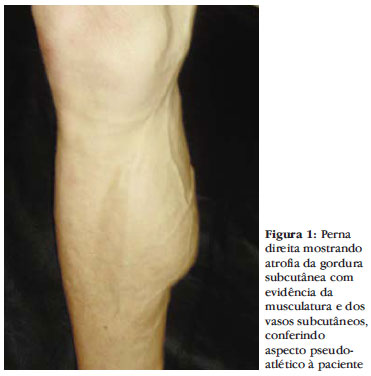
Na lipoatrofia, observa-se uma perda periférica do tecido subcutâneo. Há um afinamento dos membros superiores e inferiores, a pele fica mais adelgaçada e permite a visualização, quase anatômica, dos grupamentos musculares e vasos sanguíneos superficiais. Este quadro pode conferir ao paciente uma imagem pseudo-atlética (Figuras 1 e 2). A evidência do desenho vascular é, também, frequentemente confundida com insuficiência venosa (pseudo-varizes).17
Para alguns autores, a heterogenicidade dos achados na lipodistrofia associada ao HIV pode refletir a existência de mais de uma síndrome.23
2.3 DIAGNÓSTICO
Ainda não existe uma definição universalmente aceita para a SLHIV, o que explica a dificuldade em determinar um caso, bem como sua prevalência, etiologia e tratamento.
O método mais utilizado para determinar um caso de lipodistrofia inclui a descrição subjetiva de alterações na gordura corporal. Dois estudos multicêntricos foram realizados na tentativa de definir um caso de lipodistrofia. O Lipodystrophy Case Definition Study comparou pacientes com e sem evidências clínicas de lipodistrofia, concordantes entre pacientes e médicos. Dados laboratoriais, antropométricos e de radiologia, como a absorciometria de feixe duplo ou dual X-ray absorptiometry (DEXA) e Tomografia Computadorizada (TC), foram comparados entre os 2 grupos de pacientes. A definição de lipodistrofia gerada teve uma sensibilidade e especificidade de 80%, mas se mostrou muito complexa para ser usada na prática clínica.25 O Fat Redistribution and Metabolic Changes Study in HIV Infection comparou testagens laboratoriais e dados antropométricos e radiológicos de distribuição de gordura corporal entre pacientes infectados e não-infectados pelo HIV. Esse estudo mostrou que a única alteração de gordura corporal associada à infecção pelo HIV foi a lipoatrofia generalizada. Este resultado não explica a alta prevalência de obesidade intra-abdominal em pacientes HIV-positivos, mas concorda com outros estudos no que tange ser a lipoatrofia a grande marca nas alterações corpóreas em indivíduos infectados pelo HIV.26
Alguns critérios diagnósticos foram propostos no Primeiro Workshop Internacional da Lipodistrofia e Reações Adversas a Drogas, ocorrido em junho de 1999, em San Diego. Os critérios clínicos descritos foram face encovada, têmporas deprimidas, olhos encovados, arco zigomático proeminente, aspecto emagrecido, veias não-varicosas proeminentes em braços e pernas, perda das dobras cutâneas, perda do contorno e da gordura da região glútea. O acúmulo de gordura foi categorizado em 5 áreas: aumento da circunferência abdominal, ampliação peitoral, acúmulo de gordura dorsocervical, acúmulo de gordura facial (embora possível, mais raro do que a lipoatrofia facial), e a presença de lipomas. Os métodos para avaliação e monitoração da gordura incluem depoimento do paciente, avaliações clínicas, medidas antropométricas e exames de imagem.21
Critérios objetivos para o diagnóstico da lipodistrofia ainda não foram estabelecidos. A falta de valores padronizados em relação à gordura na população geral e a heterogenicidade das manifestações clínicas da lipodistrofia dificultam ainda mais o diagnóstico. Ainda não está disponível uma técnica padrãoouro para aferir a gordura corporal. No entanto, alguns métodos vêm sendo utilizados, como a antropometria, bioimpedância, DEXA, tomografia computadorizada, ressonância magnética e ultrassonografia.27
A antropometria e a impedanciometria não conseguem medir a gordura regional. CT e RM são métodos caros, que restringem seu uso. O uso do US é promissor porque é simples, não-invasivo, disponível e de baixo custo, embora seja mais operador-dependente do que as outras técnicas. O fato de as medidas de valores absolutos da gordura regional não elucidarem a ocorrência de alterações na gordura também é um fator limitante.27
A ressonância magnética de alta resolução permitiu a identificação de uma clara desorganização do tecido adiposo dos pacientes portadores do HIV e as alterações na arquitetura do tecido parecem aparecer mais precocemente do que as alterações detectadas pela DEXA ou pelo exame clínico.28
O US mostrou uma concordância moderada entre seus achados e a lipoatrofia reportada pelo paciente ou pelo médico em avaliação clínica. Segundo os autores, a anatomia da face, a idade do paciente e a qualidade da pele interferem em como a gordura do subcutâneo é percebida exteriormente. Ainda assim, eles apontam o US como instrumento potencialmente útil na avaliação dos pacientes, tendo em vista o baixo custo, acessibilidade e ausência de radiação.29
Com todas essas limitações, as descrições de perda ou acúmulo de gordura em áreas específicas e a determinação do grau de intensidade avaliado clinicamente e acordadas pelo médico e paciente permanecem como a melhor maneira de definir o problema individualmente.27
A maior parte dos estudos sobre a síndrome lipodistrófica é baseada na presença de sintomas subjetivamente reportados por pacientes, na presença de sinais clínicos observados na avaliação física pelo médico ou na combinação de ambos. Estas observações podem ou não ser confirmadas por métodos diagnósticos.30
As medidas objetivas da gordura facial são ainda mais difíceis de ser obtidas do que as medidas de gordura corporal. Um questionário do FRAM study pediu que os pacientes avaliassem qualquer mudança na gordura na região das bochechas, próximo ao nariz e boca, e conferir uma nota de 1 a 6 às mudanças. Um sistema similar de notas de 1 a 7 foi utilizado por profissionais de saúde para avaliar a gordura na região das bochechas dos participantes. Uma razão longitudinal dos dados obtidos dos pacientes e profissionais de saúde pode ser usada ou, ainda, acompanhamento por fotografias seriadas, se o paciente consentir.26
O diagnóstico da lipoatrofia continua sendo, frequentemente, baseado na percepção do paciente e na avaliação clínica, que tem mostrado uma boa correlação.31
2.4 EPIDEMIOLOGIA
É muito difícil avaliar a prevalência da SLHIV, já que não existe uma definição clara da doença, com critérios bem definidos para caracterização de um caso. Tampouco existem métodos diagnósticos precisos para detecção da redistribuição da gordura ou quantificação da perda ou ganho da gordura corporal.
Como o quadro é composto de várias alterações da morfologia corporal, sejam elas atrofia, hipotrofia ou hipertrofia, que podem estar presentes em conjunto ou isoladamente, torna-se mais difícil o enquadramento dos pacientes em grupos bem determinados.
A prevalência da lipodistrofia descrita na literatura varia muito, com artigos que descrevem taxas de 7 a 84% entre os pacientes portadores de HIV/AIDS, em uso ou não de antirretrovirais. Tamanha variação deve-se, possivelmente, aos critérios diagnósticos utilizados, em que pese a inexistência de padronização dos mesmos.17,21,32,33
A prevalência, como um todo, de ao menos uma alteração corporal é de aproximadamente 50%.32,34,35
Um estudo realizado por Cabrero e colaboradores com 965 pacientes atendidos em 98 diferentes estabelecimentos de saúde mostrou que a percepção dos pacientes de alguma alteração corporal ocorreu em 55,1% dos casos. Já a percepção dos médicos em relação às alterações corpóreas nos pacientes ocorreu em 55,2% dos casos. A alteração mais comum descrita foi a lipoatrofia, mencionada por 46,8% dos pacientes e 49,4% dos médicos, seguida da lipohipertrofia. Não houve diferença entre os sexos na percepção das alterações do corpo. A concordância das alterações detectadas entre pacientes e médicos foi de 83%.32
Hendrickson e colaboradores também concordam que a lipoatrofia é uma das manifestações mais comuns associada ao uso dos ARV e cita uma variação de frequência de 13 a 63%.36
Viskovic e colaboradores consideram que a lipoatrofia é a mais comum e a mais desfiguradora das alterações corporais da síndrome. Foram avaliados 151 pacientes portadores do HIV, dos quais cerca de 39% reportaram lipoatrofia em algum sítio, enquanto cerca de 45% dos médicos perceberam presença de perda de gordura ao exame clínico. Entre os pacientes, 11% reportaram lipoatrofia facial, enquanto os médicos perceberam lipoatrofia da face, clinicamente detectável, em 15% dos pacientes.37
2.5 FISIOPATOGÊNESE
O mecanismo exato que leva ao desenvolvimento das alterações anatômicas e metabólicas ainda não está claro. Várias hipóteses foram aventadas e, individualmente, nenhuma delas explica todos os aspectos destas alterações, sendo provavelmente de origem multifatorial. São citados: toxicidade mitocondrial relacionada ao uso dos ITRN; desregulação do fator de necrose tumoral α (TNFα); inibição do citocromo p 450 relacionada aos inibidores de protease; efeito local do HIV sobre a produção do cortisol e alterações de outros hormônios esteroides, dentre outros.38
Quando a SLHIV surgiu, ela foi inicialmente associada ao uso dos IP, componentes frequentes da TARV. Os estudos sugeriram que os IP mediavam a lipoatrofia alterando o elemento regulador dos esteroides, ligando-se à proteína 1, que está envolvida na diferenciação de adipócitos.
Ledru e colaboradores mostraram, ainda, que os IP têm efeito nas proteases celulares, o que contribui para o acúmulo de células T, que produzem TNFα. Isso parece favorecer a lipodistrofia contribuindo com mudanças no metabolismo lipídico. Outros autores também mostraram que os níveis de TNF e seus receptores parecem estar associados ao desenvolvimento da lipodistrofia em pacientes sob TARV.39
Mais recentemente, os ITRN, outros frequentes componentes da TARV, têm sido implicados como causa da lipodistrofia.
Dentre os INTR, a lipoatrofia está mais associada ao uso da estavudina e zidovudina. A lipoatrofia ocorre em 30% dos pacientes após 2 anos de uso da estavudina, mas apenas em 6% dos pacientes usando tenofovir.24
Os ITRN depletam o ácido desoxirribonucleico (DNA) da mitocôndria inibindo a DNA polimerase mitocondrial, que pode resultar em apoptose dos adipócitos. Tem sido sugerido que os ITRN análogos da timidina (estavudina, zidovudina) são mais tóxicos para o DNA mitocondrial do que os novos ITRN nãoanálogos da timidina, como o abacavir, embora todas as drogas desta classe possam causar depleção do DNA mitocondrial.24
A lipo-hipertrofia está mais associada ao uso dos IP, embora o efavirenz, um ITRNN, esteja envolvido no aparecimento de pseudo-ginecomastia. Ainda que a lipoatrofia esteja mais relacionada aos ITRN, o efavirenz também está implexo na progressão da lipoatrofia.17
Pacenti e colaboradores identificaram genes modulados por IP e INTR na adipogênese precoce e propõem que a regulação de fatores de transcrição e modulação do gene Wnt são a via pela qual os IP levam à inibição da diferenciação adipocitária e à regulação negativa da expressão de marcadores específicos para adipócitos como a leptina, MRAP, Cd36/FAT e S100A8. O efeito dos INTR na diferenciação dos adipócitos e no perfil de expressão gênica mostrou-se mais brando do que o dos IP, ainda que os INTR tenham mostrado modulação na expressão de inibidores teciduais de metaloproteinases e de fatores de transcrição, como o Aebp1, que podem atuar na determinação do fenótipo dos adipócitos. Os autores concluem que a expressão anormal desses genes pode ser a base da lipodistrofia associada à TARV.40
A predisposição genética é outro fator importante na gênese da lipodistrofia. Ranade e colaboradores identificaram um subgrupo de pacientes que era especialmente vulnerável aos efeitos colaterais metabólicos causados pela TARV. Após análise genética, identificaram o gene da resistina como estando implicado na susceptibilidade à lipodistrofia associada ao HIV.41
O halogrupo H do DNA mitocondrial também foi identificado como tendo forte associação com a presença de atrofia em pacientes tratados com inibidores da transcriptase reversa análogo de nucleosídeo. Já o halogrupo T mostrou significância limítrofe como fator protetor ao desenvolvimento da lipoatrofia neste mesmo grupo de pacientes.36
Alguns estudos sugerem que a redistribuição da gordura e as anormalidades metabólicas na infecção pelo HIV estão relacionadas a alterações da função endócrina do tecido adiposo. O tecido adiposo, além de sua função de armazenamento de gorduras, é um tecido endócrino ativo e o maior determinante da sensibilidade à insulina, modulando o metabolismo da glicose e de lípides por meio da secreção de adipocitocinas.
Verkauskiene e colaboradores mostraram que crianças infectadas pelo HIV com sinais de redistribuição da gordura corporal possuem níveis mais baixos de adiponectina, associada à resistência à insulina e dislipidemia. Nesse estudo, a concentração de leptina não mostrou efeito significativo na redistribuição da gordura corpórea.42
A lipoatrofia pode ocorrer na ausência da terapia com IP ou ITRN, com estudos sugerindo que as drogas antirretrovirais não são o único fator causal. No HIV Outpatient Study, 1.077 pacientes foram avaliados em relação às alterações da distribuição da gordura corporal. A lipoatrofia esteve associada ao uso de indinavir, um IP, por mais de 2 anos e a qualquer uso da estavudina, um INTR. No entanto, independentemente, fatores de risco não relacionados ao uso das drogas estiveram fortemente associados à lipoatrofia, incluindo idade avançada (> 40 anos), raça branca, contagem de CD4 < 100 células/mm3, diminuição do índice de massa corporal, e maior duração e severidade da própria doença pelo HIV. O número de fatores de risco não- farmacológicos aumentou a probabilidade de desenvolvimento da lipoatrofia. Os resultados sugerem que a causa da lipoatrofia seja multifatorial e que possa ser resultado de uma infecção por HIV de longa duração. A expressão do fator de necrose tumoral (TNFα) por adipócitos subcutâneos in vitro é maior entre os pacientes com lipoatrofia, e isto sugere que a ativação permanente de citocinas inflamatórias na infecção pelo HIV pode mediar a lipoatrofia.35
A interleucina 6 (IL-6) é uma citocina multifuncional que atua como mediador inflamatório, imune e metabólico. Assim, questiona-se o seu envolvimento em vários eventos relacionados à infecção pelo HIV. A produção aumentada de IL-6 em pacientes infectados pelo HIV e em uso de terapia antirretroviral é conhecida.43 Saumoy e colaboradores avaliaram a influência do genótipo 174G>C da IL-6 no risco de desenvolvimento da síndrome de redistribuição da gordura em pacientes infectados pelo HIV em uso de terapia antirretroviral combinada. Nenhuma diferença significativa foi encontrada na distribuição do genótipo da IL-6 entre pacientes com e sem a síndrome de redistribuição da gordura, bem como o genótipo da IL-6 não se mostrou um fator modulador da rapidez da instalação dessa síndrome. A expressão do RNA mensageiro da IL-6 no tecido adiposo subcutâneo não apresentou diferença significativa entre os pacientes infectados pelo HIV-1 com ou sem síndrome da redistribuição da gordura, embora tenha sido significativamente maior do que no grupo-controle de pacientes não- infectados (p < 0,001). Entre os pacientes infectados, o nível plasmático de IL-6 não diferiu nos pacientes com ou sem lipodistrofia (p = 1). Não houve diferença significativa também nos níveis plasmáticos de IL-6 entre os pacientes que receberam e não receberam análogos da timidina (p = 0,8).44
Outros fatores de risco para a lipodistrofia facial do HIV já identificados são o uso de inibidores de protease, idade, CD4 baixo, carga viral elevada, duração da ARV, raça branca e sexo feminino.45
Outras influências ainda não identificadas podem também estar associadas ao desenvolvimento da SLHIV.
Seja qual for a etiologia da SLHIV, pela terapia medicamentosa, por predisposição genética, pela reconstituição imune, pela ativação de citocinas, por ação direta do vírus HIV, por influências hormonais ou outras influências não identificadas, fato é que a perda da gordura é aparentemente irreversível.46
3. LIPOATROFIA FACIAL
3.1 Definição
Dentre as áreas acometidas pela lipoatrofia, um dos componentes mais frequentes da síndrome, a face é a região na qual a perda de gordura é mais evidente e impactante.
A lipoatrofia facial consiste em uma perda progressiva da gordural facial, devido especialmente à diminuição da gordura malar (gordura de Bichat) e da gordura temporal. A LF proporciona o surgimento de sulcos cutâneos novos e a acentuação dos sulcos de expressão, além de áreas de depressão e evidenciação do arcabouço ósseo (Figuras 3 a 6). Tudo isso leva a um enrugamento da face e confere ao indivíduo um aspecto de envelhecimento precoce e, na mulher, a perda da gordura facial leva a uma perda da feminilidade da face.47 Além disso, o aspecto da face emagrecida e abatida retornou com uma "fácies de doença", trazendo de volta o velho estigma da "cara da AIDS", além do medo da revelação involuntária do diagnóstico.27
3.2 Classificação
A falta de critérios para diagnóstico e aferição da perda da gordura na lipoatrofia facial é também fator complicador para se estabelecer uma classificação de gravidade da doença.
O Índice de Lipoatrofia Facial (ILA) foi desenvolvido por médicos brasileiros, tendo por base osparâmetros utilizados para classificação de gravidade na psoríase. Este instrumento tem por objetivo mensurar o grau de atrofia e o grau de melhora com o tratamento, de maneira objetiva.17
O ILA avalia 3 regiões da face (Figura 7). A região malar corresponde às áreas das regiões zigomáticas e bucal, tendo como limites a borda infraorbitária e a borda inferior da mandíbula. Outros acidentes anatômicos considerados são o osso zigomático, a projeção do corpo da mandíbula, o músculo zigomático maior, a fossa canina e a maxila.17
A região temporal corresponde à porção anterior da fossa temporal, limitada pela linha temporal do osso frontal e o arco zigomático (processo zigomático do osso temporal e processo temporal do osso zigomático).17
A região pré-auricular corresponde à região masseterina, entre o arco zigomático e o ângulo e a borda inferior da mandíbula.17
São avaliadas a profundidade e extensão da área acometida nas regiões malar, temporal e pré-auricular, separadamente.17 A profundidade das áreas atróficas é pontuada de 0 a 4, sendo 0 ausência de atrofia, 1 profundidade leve, 2 moderada, 3 grave e 4 muito grave. A extensão da área acometida é pontuada de 0 a 5, sendo 0 ausência de acometimento, 1 acometimento inferior a 20% da região avaliada, 2 de 21 a 50%, 3 de 51 a 70%, 4 de 71 a 90% e 5 de 91 a 100%.
Um número parcial é calculado para cada área avaliada, multiplicando-se a pontuação relativa à profundidade pela pontuação relativa à área acometida e ainda por um fator de correção.
O fator de correção foi estipulado para cada região da face e corresponde ao grau de importância de cada uma delas na lipoatrofia facial. Os fatores de correção utilizados são 0,7 para a região malar, 0,2 para a região temporal e 0,1 para a região pré-auricular.
Como a perda da gordura não é simétrica, considera-se o lado mais acometido na avaliação.
Ao final, somam-se as notas parciais das três regiões, chegando-se ao índice final.
O Ministério da Saúde utiliza uma classificação da lipoatrofia facial em graus de I a IV, a partir da aplicação do ILA.17
O grau I, ou lipoatrofia facial leve, corresponde ao ILA de 0 a 5,9. Nestes casos, existe uma leve depressão, mas não há evidências dos acidentes anatômicos da região nem perda do contorno facial. A pele é normal à digitopressão (Figura 8).
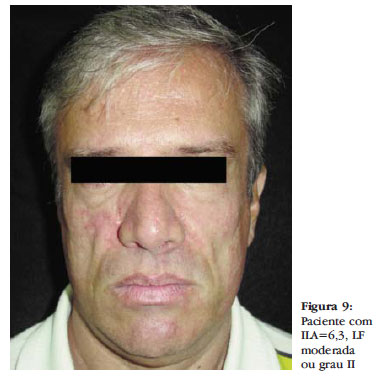
O grau II, ou moderada, corresponde ao ILA de 6,0 a 10. A depressão é mais visível com início da visualização dos acidentes anatômicos, principalmente o arco zigomático e o aumento do sulco nasolabial. Não há perda do contorno facial ou projeção da maxila. À digitopressão, a pele deprime normalmente, mas há retardo no seu retorno ao estado de repouso (Figura 9).
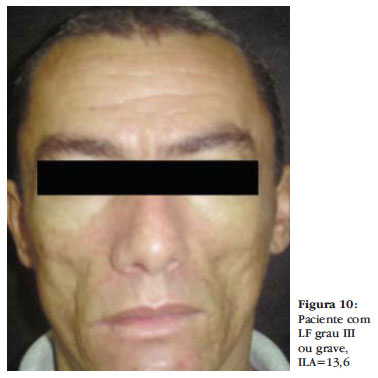
O grau III, ou grave, corresponde ao ILA de 10,1 a 15. Observam-se bem os acidentes da região malar, como o osso zigomático, visualização da fossa canina, visualização parcial do músculo zigomático maior e depressão leve ou moderada da borda inferior da mandíbula. Pode ocorrer perda do contorno facial e projeção da maxila. À digitopressão, a pele deprime pouco e demora a retornar ao estado de repouso (Figura 10).
O grau IV, ou muito grave, corresponde ao ILA de 15,1 a 20 (Figura 11). Há quase completa visualização dos contornos anatômicos, revelando o arcabouço ósseo e muscular da face. Há perda do contorno facial, com visualização das faces superiores e inferiores do arco zigomático nas regiões temporal e préauricular. À digitopressão, a pele quase não deprime.
O ILA pode variar de 0 a 20, e o Ministério da Saúde preconiza o tratamento para pacientes com pontuação no ILA igual ou maior que 6.17
Outras classificações são adotadas na literatura internacional, todas com um grau de subjetividade por ser avaliador-dependente.
3.3 IMPACTO PSICOLÓGICO
Mudanças na imagem corporal podem ser extremamente perturbadoras em termos de bem-estar psicossocial, aumentando o estigma da doença. Embora seja também visível em braços, pernas e glúteos, a lipodistrofia é mais aparente na face.30
Com a progressão do quadro, vários pacientes começaram a apresentar fáscies típica, característica da síndrome lipodistrófica. Isso trouxe de volta o estigma da AIDS e trouxe a necessidade de que os especialistas que atuam com pacientes com HIV/AIDS identifiquem estas alterações e busquem opções de tratamento.38, 48, 49
Os pacientes têm descrito a lipodistrofia facial como sendo um visível marcador para a identificação de portadores do HIV, percebida como a "cara da AIDS", ou ainda, o "sarcoma de Kaposi do século 21". Além disso, causa problemas nas relações sociais e familiares que, em alguns casos, engatilham distúrbios nas relações sociais, levando ao isolamento dos pacientes. Uma das maiores consequências da lipodistrofia é o abandono do tratamento pelos pacientes em decorrência dos efeitos psicossociais da redistribuição de gordura corporal.16, 48
Diante da prevalência das alterações da redistribuição da gordura, é certo que a lipoatrofia facial associada ao HIV está se tornando epidêmica. Ela estigmatiza os indivíduos afetados, com um grande impacto sobre a qualidade de vida desses pacientes. Usualmente, esses pacientes têm um bom controle da doença e têm bom estado de saúde, mas suas aparências faciais sugerem o contrário e os efeitos psicológicos são, geralmente, devastadores.45
Os pacientes com lipoatrofia facial ficam expostos e não têm como manter sob controle a discrição de sua condição. Isso pode resultar em discriminação no trabalho, afetar os relacionamentos, a função sexual e até a aderência ao tratamento. Isto influencia a sensação de bem-estar do paciente, bem como a imagem corporal e a autoestima. Em alguns casos, os pacientes tornam-se socialmente isolados.47
É fato que a lipoatrofia facial traz um grande impacto psicológico e pode reduzir a complacência dos pacientes com o tratamento.50
3.4 TRATAMENTO
Em que pesem as causas da lipodistrofia associada ao HIV não serem bem conhecidas, assim como ainda não é evidente como a síndrome se desenvolve, as tentativas de tratamento são difíceis de ser delineadas. Até o momento, estão disponíveis alguns tratamentos para a lipodistrofia facial, sejam eles conservadores ou intervencionistas, medicamentosos ou cirúrgicos, com resultados e efeitos colaterais variáveis.
3.4.1 TRATAMENTOS CONSERVADORES
Entre os tratamentos conservadores da LF, aventou-se a possibilidade de ajuste da terapia antirretroviral, alocando-se drogas menos relacionadas ao desenvolvimento da SLHIV. A mudança da terapia antirretroviral em resposta à lipoatrofia deve ser cautelosa devido ao risco de um rebote viral ou eventos adversos às drogas introduzidas.14
Alguns estudos mostraram que a troca de um inibidor da transcriptase reversa nucleosídico análogo da timidina para um não-análogo da timidina resulta em um aumento discreto na gordura periférica após 24 semanas, medida por tomografia computadorizada e DEXA, embora o efeito não tenha se mostrado clinicamente evidente.14 A troca da estavudina por abacavir ou tenofovir demonstrou manutenção no padrão imunológico, com a vantagem de não-progressão das alterações anatômicas, e, até mesmo, uma melhora discreta das mesmas.17 A interrupção prolongada ao tratamento (maior que 6 meses), contudo, não rende uma melhora clinicamente evidente na lipoatrofia em alguns estudos.
Não obstante, nas mudanças dos regimes terapêuticos, o médico deve considerar a sensibilidade do vírus às drogas e a severidade da doença em adição aos potenciais riscos da terapêutica medicamentosa.14
Uma das intervenções possíveis, no tratamento medicamentoso, é o uso de agentes antidiabéticos.
Os tiazolinedones (rosiglitazone, pioglitazone) são agentes antidiabéticos que melhoram a resistência à insulina no diabetes melittus tipo 2. Eles podem proporcionar ganho de gordura em alguns pacientes e podem aumentar a massa gorda em algumas formas familiares de lipoatrofia. Alguns estudos mostram resultados conflitantes em relação ao ganho de tecido adiposo subcutâneo com uso de rosiglitazone. Estudos em grande escala são necessários.14
Os estudos com a metformina também não são consensuais e a maioria possui um seguimento curto. Alguns dados sugerem diminuição da gordura subcutânea com seu uso, inclusive visceral e dos membros, sendo mais útil em pacientes com distúrbios da glicemia.51
Dentre os efeitos do hormônio de crescimento (HC) sobressaem-se as ações anabólicas. O uso terapêutico do HC humano teve início há 49 anos. Desde 1985, utiliza-se o HC recombinante, que propiciou a reposição hormonal hipofisária com menores riscos para os pacientes. As indicações mais comuns para o uso do HC são o crescimento deficitário, seja ele idiopático ou secundário, adultos com deficiência ou insuficiência de HC e perda de peso corporal por AIDS.52 O FDA aprovou um tipo de hormônio de crescimento para tratar perda muscular em soropositivos quando eles apresentam supressão hormonal. O uso deste tratamento em programas de saúde pública é limitado pelo alto custo, cerca de 36.000 dólares por ano. A literatura internacional relata que o tratamento por curto prazo aumenta o peso total e a massa magra corporal, com consequente melhora da capacidade física e qualidade de vida. Em HIV/AIDS, o regime a ser empregado e a duração de tratamento ainda não foram bem definidos.53
Ainda que sejam comumente utilizados para combater a perda de massa corpórea, os esteroides anabólicos podem, em alguns casos, diminuir a gordura subcutânea e agravar a lipoatrofia do HIV. Assim, o hormônio de crescimento humano não é um tratamento rotineiramente usado para a lipoatrofia facial.14 Contudo, Honda e colaboradores verificaram um aumento significativo da espessura dos tecidos moles da face nos meses 3 e 6 em pacientes com HIV-1 que apresentavam lipoatrofia facial moderada a severa e que receberam 5 unidades de HC recombinante diariamente por 6 meses. Os autores concluíram que o HC é efetivo e relativamente seguro para o tratamento da lipoatrofia facial moderada a severa e que o custo-benefício de seu uso deve ser melhor discutido.54
O fato de os benefícios obtidos com o HC não persistirem por mais de 12 semanas após a interrupção do HC e o fato de causar a diminuição da sensibilidade à insulina, já comprometida na síndrome, também limitam o seu uso.55
Alguns novos tratamentos medicamentosos têm sido sugeridos na SLHIV, mas aguardam mais estudos científicos para dimensionar sua verdadeira aplicabilidade clínica.
A leptina é um aminoácido, produto do gene da leptina humana. Ela regula a homeostase energética, neuroendócrina e funcional do organismo. A leptina humana recombinante é uma possibilidade terapêutica emergente para a lipoatrofia causada por sua deficiência genética, e pode ter alguma aplicação na lipoatrofia associada ao HIV/AIDS.56
Como uma das causas da lipoatrofia seria a toxicidade mitocondrial causada pelos ARV, antioxidantes e cofatores mitocondriais também poderiam ter algum valor na sua prevenção ou terapêutica.
A orientação nutricional e os exercícios físicos constituem tratamento adjuvante nas alterações corporais e metabólicas da SLHIV. Os exercícios aeróbicos diminuem os níveis de TGC e colesterol, principalmente o LDL e, pela queima de gordura, ajudam a reverter algumas alterações corpóreas referentes ao acúmulo de gordura central. Os exercícios de resistência auxiliam no ganho de massa muscular, melhorando o aspecto do tórax e membros superiores e inferiores, além de serem úteis no tratamento da osteopenia. Uma dieta rica em fibras e adequada em energia e proteínas pode prevenir o desenvolvimento de depósitos de gordura corporal.17 Todavia, estas medidas não têm impacto sobre a gordura subcutânea facial perdida.
3.4.2 TRATAMENTOS CIRÚRGICOS
Na atualidade, considera-se que os transtornos da distribuição da gordural corporal associados ao tratamento antirretroviral são irreversíveis e não existem estratégias terapêuticas, exploradas em vários estudos, que permitam a recuperação suficiente do tecido adiposo para uma percepção clínica consistente.
Para a Fundação de Formação e Informação sobre Tratamentos em HIV/AIDS da Espanha, o tratamento cirúrgico é o único tratamento para reverter as manifestações da lipodistrofia, sejam elas de atrofia, hipertrofia ou um quadro misto.57
Uma técnica promissora para o tratamento da lipoatrofia facial consiste no preenchimento subcutâneo.
O uso de preenchedores cutâneos foi introduzido em 1981, quando o colágeno bovino começou a ser implantado na pele para atenuar a aparência de rugas faciais. Desde então, novos materiais têm sido desenvolvidos para melhorar os parâmetros de efetividade e segurança.58
O preenchedor ideal deve ser um material nãotóxico, que não induza à hipersensibilidade nem a reações a corpo estranho, que não degenere com o tempo nem induza à calcificação, que seja quimicamente inerte e facilmente implantável. Estas substâncias devem ser biocompatíveis, não produzir reações alérgicas, ser de fácil manejo e estáveis com o tempo. Além disso, o custo do tratamento deve ser acessível aos pacientes.
3.4.2.1 Os preenchedores cutâneos
Os preenchedores injetáveis são, atualmente, ferramentas importantes no arsenal não- invasivo dos procedimentos de rejuvenescimento, na correção de defeitos faciais congênitos ou adquiridos e, mais recentemente, na terapêutica da lipoatrofia facial associada ao HIV/AIDS.
De acordo com sua disponibilidade, composição química e degradação, os preenchedores podem ser classificados como temporários ou permanentes, orgânicos ou inorgânicos e autólogos ou heterólogos.58
Em relação à durabilidade, alguns estudos utilizam, ainda, um terceiro subgrupo, que seria o dos preenchedores semipermanentes. Alguns autores definem os produtos semipermanentes como os que têm durabilidade entre 1 e 2 anos. Os permanentes seriam, então, aqueles com duração superior a 2 anos e os temporários com duração inferior a 1 ano.59
Alguns preenchedores, quando implantados, aumentam o volume facial por preenchimento e expansão direta dos sítios receptores. É o caso do silicone, colágeno e certas poliacrilamidas.59 Outros também criam volume diretamente, mas estimulam o tecido a uma reação de corpo estranho durante determinado período de tempo, estimulando o depósito de colágeno, progressivo e duradouro. Seriam exemplos desta segunda categoria o PMMA, o ácido polilático e a hidroxiapatita de cálcio.59
3.4.2.1.1 Polimetilmetacrilato
O PMMA ocupa, hoje, um papel de destaque no tratamento da LF porque é o produto disponibilizado pelo Ministério da Saúde para o tratamento da lipodistrofia facial associada ao HIV/AIDS no SUS.
Na expectativa de encontrar um preenchedor de maior durabilidade, uma série de partículas nãoreabsorvíveis foram testadas em ratos, e as moléculas de polimetilmetacrilato mostraram-se as mais bem toleradas, com o menor índice de reações alérgicas.
O ácido acrílico e seus derivados já eram bem conhecidos por volta de 1890, mas foi somente em 1901 que foram disponibilizados polímeros de ácido acrílico na forma sólida e transparente.61
O polimetilmetacrilato foi sintetizado, pela primeira vez, em 1902. Ele foi patenteado como Plexiglas em 1928, e sua principal aplicação médica era como cimento ósseo.62,63 Inicialmente disponível na forma de lâminas, em 1937 o material era também encontra do na forma de grânulos e em pó moldável.61
Os neurocirurgiões começaram a utilizar o PMMA durante a Segunda Guerra Mundial na realização de cranioplastias, devido à resistência e leveza do material. O PMMA continua sendo utilizado na reconstrução dos defeitos cranianos devido à sua excelente compatibilidade tissular, à facilidade com que é manipulado nas cirurgias, à resistência e à radioluscência do material, além da acessibilidade, baixa condutância térmica e elétrica e leveza do produto.61 Já em 1946, o PMMA representava aproximadamente 95% do mercado de próteses.
As pesquisas médicas progrediram e o PMMA começou a ser também usado para fixação de próteses ortopédicas femurais. O uso do PMMA como cimento ósseo foi introduzido por Charnley e Smith na década de 60. Desde então, ele tem sido largamente utilizado nas cirurgias para preencher os espaços entre as próteses e os ossos.61
A química inerte e a biocompatibilidade do polimetilmetacrilato foram aceitas desde que Jude introduziu a primeira prótese de quadril feita com polimetilmetacrilato em 1947.64
A aplicação na Oftalmologia também trouxe muitos conhecimentos acerca do PMMA. As primeiras lentes oftálmicas rígidas de PMMA foram fabricadas por Kevin Tuohey em 1948. Embora o PMMA possua propriedades ópticas favoráveis, a baixa permeabilidade ao oxigênio deste material limita o uso a longo prazo destas lentes. O PMMA tem sido o materialpadrão nas cirurgias de inserção de lentes intraoculares desde sua introdução em 1949, por Harold Ridley. Embora este material venha sendo usado há mais de 40 anos, os maiores problemas ainda são consequência de sua energia de superfície relativamente baixa, que pode resultar tanto em dano do endotélio córneo quanto em adesão pós-operatória de células inflamatórias à lente intraocular.61
Até a atualidade, o PMMA continua sendo usado como cimento ósseo na Ortopedia, como material de reparação crânio-facial na Neurocirurgia, como material de lentes intraoculares na Oftalmologia e como cimento dental na Odontologia.61,65
A molécula de PMMA tem se mostrado quimica-mente inerte e a realização de teste de alergenicidade prévio não é necessária, quando não-associado a outros preenchedores.66 Experiências animais têm mostrado que as chaves para a biocompatibilidade com a pele são a forma esférica das partículas, a superfície lisa e regular e o tamanho das microesferas de polimetilmetacrilato.60,67 O tamanho das moléculas é importante porque partículas muito pequenas podem ser facilmente fagocitadas e as maiores não passam facilmente por uma agulha número 26. A lavagem repetida das microesferas reduz as impurezas e confere maior tolerância ao produto, ao reduzir o número de células gigantes de corpo estranho ao redor das partículas de PMMA injetadas.67
As microesferas injetadas provocam um estímulo tecidual que acaba por induzir a uma neoformação de fibras colágenas.
A estimulação tissular induzida pelas microesferas de PMMA ocorre devido ao processo inflamatório discreto produzido por monócitos, histiócitos e fibroblastos no local da aplicação e que podem, posteriormente, fabricar fibras colágenas.68 Allen e colaboradores, em um estudo longitudinal, verificaram as reações celulares após a injeção de implantes inertes. Tais reações eram seguidas por uma série de eventos de magnitude variável. Nas primeiras 24 horas, neutrófilos e pequenas células redondas predominam; em 48 horas, há predomínio de monócitos; em 7 dias, já ocorre formação de células gigantes tipo corpo estranho. Em 2 semanas, a resposta celular já está moderada; em 4 semanas, os fibroblastos aparecem; com 6 semanas, a deposição de colágeno intensifica-se; em 8 semanas, as células inflamatórias crônicas estão dispersas ao longo de uma maciça deposição de colágeno. A partir daí, a reação celular ao corpo estranho estabiliza-se e, em seis meses, algumas células gigantes e um pequeno grau de resposta celular estão presentes, e há conversão dos fibroblastos em fibrócitos. A partir de então, constatou-se uma permanência maior do implante no local, tendo, nesse contexto, os compostos de colágeno misturados a microesferas de PMMA causado grandes expectativas para os pesquisadores e para a comunidade médica.69
Nas apresentações disponibilizadas internacionalmente, as microesferas de PMMA foram inicialmente suspensas em gelatina. Dos 578 pacientes que inicialmente receberam o produto, 15 desenvolveram granulomas em 6 a 18 meses após a aplicação. Concluiu-se, assim, que as impurezas estimularam os macrófagos e foram a causa da formação dos granulomas. Além disso, alguns pacientes apresentaram nodulações palpáveis que foram atribuídas à rápida absorção da gelatina que carreava as microesferas, o que permitia uma aglutinação das mesmas. Esse veículo foi, então, substituído por uma solução de colágeno que, por ser mais viscosa, mostrou-se mais duradoura no tecido. Após a aplicação do produto na derme profunda, o colágeno é degradado pelo corpo em 1 a 3 meses e completamente substituído por colágeno do próprio paciente em período semelhante, garantindo um resultado de aumento de volume.70
O colágeno utilizado na apresentação das formulações estrangeiras é de origem bovina. A antigenicidade do colágeno bovino é diminuída pela ação de uma pepsina, que remove a porção final mais antigênica da molécula de colágeno, sem destruir a natureza helicoidal das fibras colágenas.71
As apresentações comerciais disponíveis internacionalmente são uma suspensão de 20% de microesferas de PMMA purificadas de 30 a 42 micrômetros de diâmetro em uma solução de colágeno bovino a 3,5%. Contém, ainda, 0,3% de lidocaína para reduzir o desconforto após a aplicação.67 Esse produto foi aprovado e disponibilizado em mais de 50 países desde 1994, com uma estimativa de 400.000 pacientes tratados desde então e uma taxa de complicação de 0,01%. É comercializado sob o nome de Artecoll, desde 1996, na União Europeia, no Canadá, desde 1998, e no México, desde 1999. O produto foi aprovado pelo FDA em outubro de 2006, sendo comercializado nos EUA sob o nome de Artefill, com a mesma composição do Artecoll, mas com nanopartículas reduzidas e o tamanho das esferas mais uniforme.63
Sendo o colágeno bovino uma proteína estranha, 3% dos pacientes podem desenvolver reação imunológica, possivelmente uma reação alérgica do tipo IV, embora anticorpos para colágeno bovino possam ser demonstrados no soro dos pacientes. Desta forma, um teste alérgico prévio é imprescindível. Uma pequena quantidade de solução de colágeno puro, usualmente 0,05 a 0,1 ml, é injetada intradermicamente na superfície do antebraço. A leitura é feita em 72 horas e, novamente, após 1 mês. Presença de edema e/ou eritema torna o teste positivo. Cerca de 1,2% dos pacientes com teste negativo desenvolvem reação imunológica em aplicação subsequente; assim, um segundo teste deve ser realizado 30 dias após o primeiro. Alguns autores sugerem, ainda, um novo teste para tratamento após um período de 12 meses.70
A associação do colágeno bovino ao PMMA aumenta substancialmente o custo do produto, o que se torna um fator limitante para situações em que grandes volumes do preenchedor são necessários, como no tratamento da lipodistrofia facial, e praticamente inviável para uso em programas de saúde pública.
A maior parte dos artigos publicados na literatura internacional sobre implantes de PMMA diz respeito a produtos com associação de colágeno (Artecoll ou Artfill).
O produto injetável utilizado no Brasil consiste em microesferas de PMMA polimerizadas variando de 30 a 50 micrômetros de tamanho, envoltas em gel de carboxi-gluconato-hidrolático de magnésio. A proporção microesferas/gel é 3:10. Ele é apresentado em frascos de 10 ml ou seringas de 1 ou 3 ml prontas para o uso, conservadas em temperatura ambiente.58,66 Ele foi inicialmente introduzido no Brasil em 1996. Como não possui nenhum componente animal em sua estrutura não exige realização de teste alérgico prévio.
O implante com PMMA confere um resultado imediato e de longa duração, considerando tratar-se de um preenchedor biocompatível e inerte, o que lhe confere características de um implante permanente.
Sendo as microesferas de PMMA não-biodegradáveis e muito grandes para migrarem ou serem fagocitadas por macrófagos, espera-se um aumento tecidual permanente, consistindo 80% do volume em tecido conjuntivo autólogo. No entanto, estudos animais utilizando microesferas de PMMA têm mostrado resultados conflitantes. Lemperle e colaboradores sugerem que as partículas de PMMA sejam resistentes à fagocitose e à degradação e não tenham potencial carcinogênico. Esse estudo atribui a resistência à fagocitose à superfície lisa das partículas e relata que, após 4 meses, uma cápsula fibrosa delicada é formada em volta de cada partícula, o que previne o deslocamento do material implantado.60 No entanto, McClelland e colaboradores sugerem que o PMMA em colágeno heterólogo tem a capacidade de evocar resposta imune e que as microesferas são susceptíveis à fagocitose e eliminação.72 Espera-se, de toda forma, um resultado duradouro a permanente.
A Agência Nacional de Vigilância Sanitária -ANVISA aprovou o uso do PMMA para tratamento da lipodistrofia facial do HIV.73 No entanto, este produto tem sido também usado no tratamento de sulcos nasogenianos, na correção da atrofia de eminências ósseas, principalmente malar e mentoniana, na atrofia hemifacial de Romberg, na correção do dorso nasal, na correção de cicatrizes e do lóbulo de orelha atrófico.68
Vários países utilizam o PMMA e o número de pacientes tratados no mundo já ultrapassava os 250.000 em 2005. Entre esses, apenas 0,01% apresentaram formação de granuloma.74,75
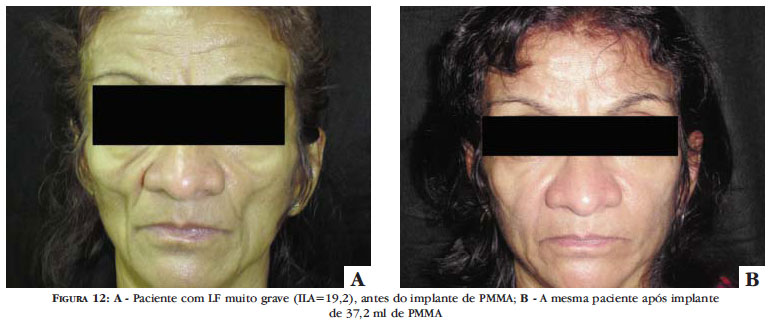
O Brasil é um dos países com maior experiência no uso do PMMA para preenchimento cutâneo. Ainda que resultados muito satisfatórios venham sendo alcançados com o tratamento da LF com o implante de PMMA, ainda são poucos os trabalhos científicos que abordam este tema (Figura 12).
3.4.2.1.2 Outros preenchedores cutâneos
A literatura descreve a utilização de outros preenchedores no tratamento da LF. Nos Estados Unidos e no Canadá, algumas formas de silicone líquido injetável têm sido usadas com sucesso para tratar a lipoatrofia facial do HIV. O termo silicone foi designado para uma família de polímeros com um elemento básico: silicon. Estes polímeros variam, em sua viscosidade, de um óleo até a forma de geleia. O silicone puro indicado no preenchimento cutâneo é o siloxane, que é uma classe de compostos químicos com cadeias alternadas de silicon, oxigênio e metane. A forma pura, filtrada e estéril é a recomendada para uso como preenchedor.76
A combinação de punctura e do depósito de silicone leva a uma reação inflamatória com migração de polimorfonucleares, seguida de um infiltrado moderado linfocítico. Este infiltrado pode ser observado durante 6 meses. Ocorre uma atividade fagocítica discreta e pode-se evidenciar pequeno número de células gigantes que, em geral, não progridem para a formação de granulomas. Os pequenos volumes de silicone injetados logo se acomodam na derme profunda e tecido subcutâneo e são circundados por pseudo-cápsulas de colágeno preexistente que, posteriormente, dá lugar a uma fina cápsula de colágeno neoformado.76
As reações imediatas são eritema, edema e, eventualmente, equimoses. Logo após a injeção, pode ocorrer a formação de pequenas pápulas no local que desaparecem após algumas horas ou em até 3 semanas. Existem relatos de discromias, mas não são frequentes. A elevação excessiva pode ocorrer por excesso de volume aplicado e hipercorreção. Os casos de formação de granulomas estão ligados à impureza do material, injeção do produto em localização inadequada ou injeção de grandes volumes. A migração do silicone, que é muitas vezes o principal temor dos profissionais e pacientes, só ocorre quando se utilizam volumes acima de 1 ml em um único local, o que geralmente é necessário no tratamento da LF.76
Em alguns estudos, o silicone líquido injetável pareceu ser o tratamento de melhor custo-benefício nos Estados Unidos.77 No entanto, um seguimento mais longo dos pacientes tratados é necessário para determinar a eficácia, a durabilidade e a segurança a longo prazo do silicone líquido injetável no tratamento da lipoatrofia facial do HIV.77
Um fator limitante a este preenchimento é o fato de seu uso ser proibido em grande número de países, dentre os quais o Brasil.
O gel de poliacrilamida é um polímero não-biodegradável, não-alergênico e não-tóxico, composto por 96% de água não-pirogênica e 4% de poliacrilamida. Ele é o único entre os preenchedores em que uma fina camada capsular de colágeno desenvolve-se em torno do gel, isolando-o do tecido do hospedeiro.
Como resultado do processo de encapsulamento, o implante pode ser prontamente identificado e, na necessidade de ser retirado, pode ser facilmente removido pela expressão da cápsula, expulsando o material do seu interior.78 Por isso, a poliacrilamida é tida como uma prótese injetável.79
O gel de poliacrilamida é não-biodegradável e é proposto que seja biologicamente inerte.79 Os efeitos cosméticos do preenchimento com poliacrilamidas são permanentes, evitando a necessidade de tratamentos posteriores.78
O alto custo das poliacrilamidas torna o uso deste preenchedor praticamente inviável em saúde pública.78
O ácido polilático foi o primeiro preenchedor a ser aprovado pelo FDA para o tratamento da lipoatrofia facial associada ao uso dos ARV. A decisão do FDA baseou-se em 4 estudos que documentaram a segurança e eficácia do produto em 278 pacientes com lipoatrofia facial.80
O ácido lático é um polímero sintético, biodegradável e imunologicamente inerte. Após injetado, as micropartículas de ácido polilático podem estimular a produção de colágeno, o que permite um aumento gradual e progressivo do volume da área lipoatrófica.81 O ácido polilático é da família dos alfa-hidroxiácidos e está disponível há mais de 30 anos para variados usos na Medicina.47
O ácido polilático é injetado na derme profunda com o intuito de aumentar o número de fibroblastos e sua atividade, resultando em aumento da síntese de colágeno. Ele tem duas formas de ação. Inicialmente, há um aumento de volume temporário da área tratada e é essencial que os pacientes sejam bem orientados para não se desapontarem quando esse volume inicial reduzir-se.47 O volume inicial é criado pela injeção do volume de água estéril utilizada para reconstituir o ácido polilático, que é reabsorvida em 48 a 72 horas.50 A segunda forma de ação é o estímulo à formação de colágeno.
Podem ser necessárias várias sessões antes que o efeito desejado no contorno da face seja notado.47 O ácido polilático é totalmente degradado em 9 meses.47
Carey e colaboradores realizaram um estudo randomizado, multicêntrico, com seguimento de 24 semanas e 96 semanas, comparando os pacientes adultos com lipoatrofia facial induzida por antirretrovirais que receberam injeção de ácido polilático em sua derme profunda com um grupo-controle. Esses autores mostraram que o tratamento da lipoatrofia facial com o ácido polilático em pacientes adultos infectados pelo HIV proporcionou apenas um aumento modesto na espessura facial, mas não no volume facial. Em contraste, a percepção dos pacientes de melhora do bem-estar, da qualidade de vida e dos benefícios estéticos foi significativa. O ácido polilático não interfere na perda de gordura de outras regiões do corpo. Os autores pontuam, ainda, que outros estudos comparativos são necessários para definir o tratamento ótimo para a lipoatrofia facial do HIV.81
Entretanto, por ser um produto biodegradável, o efeito do ácido polilático é temporário e o re-tratamento é eventualmente necessário. Além disso, múltiplas sessões de aplicação são necessárias para administrar o ácido polilático. Ainda, nódulos subcutâneos têm sido descritos após a injeção deste material. Soma-se a isso o elevado custo deste preenchedor. Desta forma, outras opções alternativas para o paciente com lipoatrofia facial são importantes.80
O ácido hialurônico é um polissacarídeo componente dos tecidos moles e ele é idêntico em todas as espécies e tipos de tecidos. Existem apresentações comerciais já aprovadas pelo FDA.
O ácido hialurônico injetável é obtido por meio da fermentação bacteriana e possui baixa incidência de reações adversas. Essa incidência caiu ainda mais nos últimos anos, de 1/1400 pacientes em 1999 para 1/1800 pacientes em 2000. Esta queda é explicada pela produção de formas mais purificadas de ácido hialurônico pelas indústrias farmacêuticas.82
O ácido hialurônico tem sido usado com sucesso para tratar a lipoatrofia facial do HIV. No entanto, como em outros preenchimentos temporários, grandes volumes são frequentemente necessários para atingir uma correção completa, que tende a diminuir passados 6 a 12 meses. O alto custo de grandes volumes e a necessidade de repetição do tratamento são grandes fatores limitantes.45
O gel de hidroxiapatita de cálcio é um preenchedor injetável composto de 30% de microesferas de hidroxiapatita de cálcio e 70% de um gel carreador aquoso. Apesar de sintético, seus componentes são idênticos à porção mineral dos ossos e dentes. É um material biocompatível, não-tóxico e não-antigênico.24
Foi aprovado pelo FDA em 2006 para correção dos sinais de perda da gordura facial em pacientes com HIV.24
Este implante provê uma correção imediata. O gel carreador é absorvido em poucas semanas, deixando as microesferas, que servem de matriz para neocolagênese e formação de novo tecido. O grande fator limitador para seu uso é também o alto custo, somando-se o fato de ser um preenchedor novo e não existirem estudos a longo prazo.
Estudos comparativos com grupos tratados com diferentes preenchedores disponíveis no mercado devem ser realizados para melhor estabelecer o custo-benefício de cada produto; o alto custo da maior parte dos preenchedores limita o uso destes materiais no tratamento da LF.
Na tentativa de se obter novos preenchedores para serem utilizados, sobretudo nos tratamentos para rejuvenescimento da face, a tendência é a de que novos produtos sejam desenvolvidos e disponibilizados no mercado. O custo dos produtos recém-lançados, a durabilidade dos materiais e a existência de pesquisas que assegurem eficácia e segurança são fatores importantes que devem amparar a utilização desses preenchedores na prática médica, em particular, sua utilização no tratamento da LF.
Recebido em 12.11.2010.
Aprovado pelo Conselho Editorial e aceito para publicação em 28.11.2010.
Conflito de interesse: Nenhum
Suporte financeiro: Nenhum
QUESTÕES
- 1. Center for Disease Control and Prevention. Pneumocystis pneumonia - Los Angeles. Morbid Mortal Wkly Repor. 1981;30:250-2.
- 2. Center for Disease Control and Prevention. Kaposi's Sarcoma and Pneumocycstis Pneumonia Among Homosexual Men - New York City and California. Morbid Mortal Wkly Repor. 1981;30:305-8.
- 3. Sabino EC, Barreto CC, Sanabani S. AIDS: Etiologia e Subtipos do HIV. In: Veronesi R, Focaccia R, editores. Tratado de infectologia. São Paulo: Atheneu; 2005. p. 111-7.
- 4. Veronesi R, Focaccia R, editores. Tratado de infectologia. São Paulo: Atheneu; 2005. p.118-137.
- 5. Marques AR, Masur H. História Natural da Infecção pelo HIV. In: Veronesi R, Focaccia R, editores científicos. Tratado de infectologia. São Paulo: Atheneu; 2005. p.143-6.
- 6. Rizzo LV. Imunopatogênese. In: Veronesi R, Focaccia R, editores científicos. Tratado de infectologia. São Paulo: Atheneu; 2005. p.138-142.
- 7. Lomar AV, Diament D. Terapia Anti-retroviral. In: Veronesi R, Focaccia R, editores científicos. Tratado de infectologia. São Paulo: Atheneu; 2005. p. 235-241.
-
8World Health Organization (WHO). [Internet]. Joint United Nations Programme on HIV/AIDS (UNAIDS). AIDS epidemic update. Geneva, 2009. [cited 2010 Sep 7]. Available from: http://data.unaids.org/pub/Report/2009/JC1700_Epi_Update_2009_en.pdf
-
9World Health Organization (WHO). [Internet]. Joint United Nations Programme on HIV/AIDS (UNAIDS). AIDS epidemic update. Geneva, 2007. [cited 2008 Jul 21]. Available from: http://www.aids.gov.br/data/documents/storedDocuments/
- 10. Sadala MLA, Marques AS. Vinte anos de assistência a pessoas vivendo com HIV/aids no Brasil: a perspectiva de profissionais de saúde. Cad Saúde Publ. 2006;22:2369-78.
-
11Ministério da Saúde. [Internet]. Boletim Epidemiológico DST/AIDS. Ano IV nº 01.Brasília, 2007. [acesso 15 Jul. 2007]. Disponível em http://www.aids.gov.br/main.asp?ViewID
- 12. Brasil. Ministério da Saúde. Fundação Nacional de Saúde. Guia de Vigilância Epidemiológica. 5. ed. Brasília: Funasa; 2002. 842 p. (Aids/Hepatites Virais; vol. 1).
- 13. Brasil. Ministério da Saúde. Secretaria de Assistência a Saúde. Programa Nacional de DST/Aids. Consenso sobre a terapia anti-retroviral em adultos. Brasília: Ministério da Saúde; 1996.
- 14. Martinez E, Mocroft A, García-Viejo MA, Pérez-Cuevas JB, Blanco JL, Mallolas J, et al. Risk of Lipodystrophy in HIV-1-infected patients treated with protease inhibitors: a prospective cohort study. Lancet. 2001;357:592-8.
- 15. Carr A, Samaras K, Burton S, Law M, Freund J, Chisholm DJ, et al. A syndrome of peripheral lipodystrophy, hyperlipidaemia and insulin resistance in patients receiving HIV protease inhibitors. AIDS. 1998;12:F51-8.
- 16. Collins E, Wagner C, Walmsley S. Psychosocial impact of the lipodystrophy syndrome in HIV infection. AIDS Read. 2000;10:546-51.
- 17. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de DST, AIDS e Hepatites Virais. Manual de tratamento da lipoatrofia facial: recomen dações para o preenchimento facial com polimetilmetacrilato em portadores de HIV/AIDS. Série A. Normas e Manuais Técnicos. Série Manuais 81. Brasília: Ministério da Saúde; 2009. 44 p.
- 18. Miller KD, Jones E, Yanovski JA, Shankar R, Feuerstein I, Falloon J. Visceral abdominal-fat accumulation associated with use of indinavir. Lancet. 1998;351:871-5.
- 19. Miller KD, Jones E, Yanovski JA, Shankar R, Feuerstein I, Falloon J. Pseudo-Cushing's syndrome in human immunodeficiency virus-infected patients. Clin Infect Dis. 1998;27:68-72.
- 20. Valente AM, Reis AF, Machado DM, Succi RC, Chacra AR. HIV lipodystrophy syndrome. Arq Bras Endocrinol Metab. 2005;49:871-81.
- 21. Behrens GMN, Stoll M, Schimidt RE. Lipodystrophy Syndrome in HIV Infection: What is it, What Causes it and How Can it Be Managed? Drug Saf. 2000;23:57-76.
- 22. Gkrania-Klotsas E, Klotsas AE. HIV and HIV treatment: effects on fats, glucose and lipids. Br Med Bull. 2007;84:49-68.
- 23. Castelo Filho A, Abrão P. Alterações metabólicas do paciente infectado por HIV. Arq Bras Endocrinol Metab. 2007;51:93-6.
- 24. Finucane KA, Archer CB. Dermatological aspects of medicine: highly active antiretroviral therapy and the treatment of human immunodeficiency virus. Clin Exp Dermatol. 2010;35:107-9.
- 25. Carr A, Emery S, Law M, Puls R, Lundgren JD, Powderly WG, et al. An objective case definition of lipodystrophy in HIV-infected adults. Lancet. 2003;361:726-35.
- 26. Tien PC, Benson C, Zolopa AR, Sidney S, Osmond D, Grunfeld C. The study of fat redistribution and metabolic change in HIV infection (FRAM): methods, design, and sample characteristics. Am J Epidemiol. 2006;163:860-9.
- 27. Milinkovic A, Martinez E. Current perspectives on HIV-associated lipodystrophry syndrome. J Antimicrob Chemother. 2005;56:6-9.
- 28. Josse G, Gensanne D, Aquilina C, Bernard J, Saint-Martory C, Lagarde JM, et al. Human immundeficiency vírus atrophy induces modification of subcutaneous adipose tissue architecture: in vivo visualization by high-resolution magnetic resonance imaging. Br J Dermatol. 2009;160:741-6.
- 29. Viskovic K, Richman I, Klasnic K, Hernandez A, Krolo I, Rutherford GW, et al. Assessment of Ultrasound for Use in Detecting Lipoatrophy in HIV-Infected Patients Taking Combination Antiretroviral Therapy. AIDS Patient Care STDS. 2009;23:79-84.
- 30. Baril JG, Junod P, Leblanc R, Dion H, Therrien R, Laplante F, et al. HIV-associated lipodystrophy syndrome: A review of clinical aspects. Can J Infct Dis Med Microbiol. 2005;16:233-43.
- 31. Bacchetti P, Gripshover B, Grunfeld C, Heymsfield S, McCreath H, Osmond D, et al. Fat distribution in men with HIV infection. J Acquire Immune Defic Synd. 2005;40:121-31.
- 32. Cabrero E, Griffa L, Burgos A; HIV Body Physical Changes Study Group. Prevalence and Impact of Body Physical Changes in HIV Patients Treated with Highly Active Antiretroviral Therapy: Results from a Study on Patient and Physician Perceptions. AIDS Patient Care STDS. 2010;24:5-13.
- 33. Chen D, Misra A, Garg A. Clinical review 153: Lipodystrophy in human immunodeficiency virus-infected patients. J Clin Endocrinol Metab. 2002;87:4845-56.
- 34. Carter VM, Hoy JF, Bailey M, Colman PG, Nyulasi I, Mijch AM. The prevalence of lipodystrophy in an ambulant HIV-infected population: It all depends on the definition. HIV Med. 2001;2:174-80.
- 35. Carr A. HIV lipodystrophy: Risk factors, pathogenesis, diagnosis and management. AIDS. 2003;17(Suppl 1):S141-8.
- 36. Hendrickson SL, Kingsley LA, Ruiz-Pesini E, Poole JC, Jacobson LP, Palella FJ, et al. Mitochondrial DNA Halogroups Influence Lipoatrophy After Highly Active Antiretroviral Therapy. J Acquir Immune Defic Syndr. 2009;51:111-6.
- 37. Bugge H, Negaard A, Skeie L, Bergersen B. Hyaluronic acid treatment of facial fat atrophy in HIV-positive patients. HIV Med. 2007;8:475-82.
- 38. Li HY, Silva ACCM, Santos S. Síndrome Lipodistrófica e HIV/AIDS. J Bras AIDS. 2002;3:23-35.
- 39. Ledru E, Christeff N, Patey O, de Truchis P, Melchior JC, Gougeon ML. Alteration of tumor necrosis factor- T-cell homeostasis following potent antiretroviral therapy: contribution to the development of human immunodeficiency virus-associated lipodystrophy syndrome. Blood. 2000;95:3191-8.
- 40. Pacenti M, Barzon L, Favaretto F, Fincati K, Romano S, Milan G, et al. Microarray analasys during adipogenesis identifies new genes altered by antiretroviral drugs. AIDS. 2006;20:1691-1705.
- 41. Ranade K, Geese WJ, Noor M, Flint O, Tebas P, Mulligan K, et al. Genetic analysis implicates resistin in HIV lipodystrophy. AIDS. 2008;22:1561-8.
- 42. Verkauskiene R, Dollfus C, Levine M, Faye A, Deghmoun S, Houang M et al. Serum Adiponectin and Leptin Concentrations in HIV-Infected Children with Fat Redistribution Syndrome. Pediatric Research. 2006;60:225-30.
- 43. Breen EC, Rezai AR, Nakajima K, Beall GN, Mitsuyasu RT, Hirano T, et al. Infection with HIV is associated with elevated IL-6 levels and production. J Immunol. 1990;144:480-4.
- 44. Saumoy M, López-Dupla M, Veloso S, Alonso-Villaverde C, Domingo P, Broch M, et al. The IL-6 system in HIV-1 infection and in HAART-related fat redistribution szndromes. AIDS. 2008;22:893-903.
- 45. Baril JG, Junod P, Leblanc R, Dion H, Therrien R, Laplante F, et al. HIV-associated lipodystrophy syndrome: A review of clinical aspects. Infect Dis Med Microbiol. 2005;16:233-43.
- 46. Jones D. HIV Facial Lipoatrophy: Causes and Treatment Options. Dermatol Surg. 2005;31:1519-29.
- 47. Kavouni A, Catalan J, Brown S, Mandalia S, Barton SE. The face of HIV and AIDS: can we erase the stigma? AIDS Care. 2008;20:485-7.
- 48. Paton NI, Earnest A, Ng YM, Karim F, Aboulhab J. Lipodystrophy in a cohort of human immunodeficiency virus-infected asian patients: prevalence, associated factors, and psychological impact. Clinical Infectious Disease. 2002;35:1244-9.
- 49. Pujol RM, Domingo P, Xavier-Matias-Guiu, Francia E, Sanbeat MA, Alomar A, et al. HIV-1 protease inhibitor associated partial lipodystrophy: clinicopathologic review of 14 cases. J Am Acad Dermatol. 2000;42:193-8.
- 50. Narins RS. Minimizing adverse events associated with poly-L-latic acid injection. Dermatol Surg. 2008;34(Supp1):S100-4.
- 51. Wohl DA, Brown TT. Management of Morphologic Changes Associated with Antiretroviral Use in HIV-Infected Patients. J Acquir Immune Defic Syndr. 2008;49(Supply 2):S93-100.
- 52. Wannmacher L. Hormônio de crescimento: uma panacéia? Organização Pan-Americana da Saúde/Organização Mundial da Saúde - Brasil. 2006;3:1-6.
- 53. Yin MT, Glesby MJ. Recombinant human growth hormone therapy in HIV-associated wasting and visceral adiposity. Expert Rev Anti Infect Ther. 2005;3:727-38.
- 54. Honda M, Yogi A, Ishizuka N, Genka I, Gatanaga H, Teruya K, et al. Effectiveness of Subcutaneous Growth Hormona in HIV-1 Patients with Moderate to Severe Facial Lipoatrophy. Intern Med. 2007;46:359-62.
- 55. Spinola-Castro AM, Siviero-Miachon AA, Silva MTN, Guerra-Junior GO papel do hormônio de crescimento no tratamento dos distúrbios endócrino-metabólicos do paciente com a síndrome da imunodeficiência adquirida (Aids). Arq Bras Endocrinol Metab. 2008;52:818-32.
- 56. Kelesidis T, Kelesidis I, Chou S, Mantzoros CS. Narrative Review: The Role of Leptin in Human Physiology: Emerging Clinical Applications. Ann Intern Med. 2010;152:93-101.
- 57. Fundación para la Formación e Información sobre Tratamiento en el VIH/sida(FIT). Tratamiento quirurgico de la lipodistrofia asociada a la infección por VIH. Conclusiones de uma Reunión Multidisciplinar. Enferm Infecc Microbiol Clin. 2007;25:26-38.
- 58. Odo MEY, Chichierchio AL. Práticas em Cosmiatria e Medicina Estética - Evolução dos Implantes e Toxina Botulínica.1. ed. São Paulo: Tecnopress; 2000.
- 59. Sturm LP, Cooter RD, Mutimer KL, Graham JC, Maddern GJ. A Systematic Review of Permanent and Semipermanent Dermal Fillers for HIV-Associated Facial Lipoatrophy. AIDS Patient Care STDS. 2009;23:699-714.
- 60. Lemperle G, Ott H, Charrier U, Hecker J, Lemperle M. PMMA microspheres for intradermal implantation. I. Animal Research. Ann Plast Surg. 1991;26:57-63.
- 61. Frazer RQ, Byron RT, Osborne PB, West KP. PMMA: an Essential Material in Medicine and Dentistry. J Long Term Eff Med Implants. 2005;15:629-39.
- 62. Alster TS, West TB. Human-derived and new synthetic injectable materials for soft-tissue augmentation: Current status and role in cosmetic surgery. Plast Reconstr Surg. 2000;105:2515-25.
- 63. Lemperle G, Gauthier-Hazan N, Lemperle M. PMMA microspheres (Artecoll) for long-lasting correction of wrinkles: Refinements and statistical results. Aesthetic Plast Surg. 1998;22:356-65.
- 64. Cohen SRMD, Holmer REMD. A long-lasting injectable wrinkle filler material: report of a controlled, randomized, multicenter clinical trial of 251 subjects. Plast Reconstr Surg. 2004;114:964-76.
- 65. Reichnberger MA, Stoff AF, Ritcher D. Polymethilmethacrylate for managing frontal bone deformities. Aesth Plast Surg. 2007;31:397-400.
- 66. Carvalho Costa IM, Salaro CP, Costa MC. Polymethylmethacrylate facial implant: a successful personal experience in Brazil for more than 9 years. Dermatol Surg. 2009;35:1221-7.
- 67. Lemperle F, Morhenn V, Charrier U. Human histology and persistence of various injectable filler substances for soft tissue augmentation. Aesthetic Plast Surg. 2003;27:354-66.
- 68. Wolfram D, Tzankov A, Pisa-Katzer H. Surgery for Foreign Body Reactions due to Injectable Fillers. Dermatology. 2006;213:300-4.
- 69. Allen O. Response to subdermal implantation of textured microimplants in humans. Aesthetic Plast Surg. 1992;16:227-30.
- 70. Haneke E. Polymethyl methacrylate microspheres in collagen. Semin Cutan Med Surg. 2004;23:227-232.
- 71. Lemperle G, Hazan-Gauthier N, Lemperle M. PMMA microspheres (Arte cool) for skin and soft tissue augmentation. II. Clinical investigations. Plast Reconstr Surg. 1995;96:627-34.
- 72. McClelland M, Egbert B, Hanko V, Berg RA, DeLustro F. Evaluation of artcoll ploymethylmethacrylate implant for soft-tissue augmentation: biocompatibility and chemical characterization. Plast Reconstr Surg. 1997;100:1466-74.
- 73. Ministério da Saúde. Programa Nacional de DST/AIDS. Secretaria de Vigilância em Saúde. Tratamento da lipoatrofia facial em pacientes de HIV/AIDS com polimetil metacrilato (PMMA). Brasília: Ministério da Saúde; 2006.
- 74. Gelfer A, Carruthers A, Carruthers J, Jang F, Berstein S. The natural History of Polymethylmethacrylate Microspheres Granulomas. Dermatol Drug. 2007;33:614-20.
- 75. Carruthers A, Carruthers J. Polymethylmethacrylate Microspheres / Collagen as an tissue augmentation agent: Personal experience over 5 years. Dermatol Surg. 2005;31:1561-4.
- 76. Pinheiro AMC, Oliveira Filho J, Costa IMC. Preenchimentos Cutâneos: Principais Preenchedores Cutâneos: Indicações e Técnicas. In: Gadelha AR, Costa IMC. Cirurgia Dermatológica em Consultório. São Paulo: Atheneu; 2009. p. 527-48.
- 77. Orentreich D, Leone AS. A case of HIV-associated facial lipoatrophy treated with 1000-cs liquid injectable silicone. Dermatol Surg. 2004;30:548-51.
- 78. Loutfy MR, Raboud JM, Antoniou T, Kovacs C, Shen S, Halpenny R, et al. Immediate versus delayed polyalkylimide gel injections to correct facial lipoatrophy in HIVpositive patients. AIDS. 2007;21:1147-55.
- 79. Jones DH, Carruthers A, Fitzgerald R, Sarantopoulos GP, Binder S. Late-Appearing Abscesses after Injections of Nonabsorbable Hidrogel for HIV-Associated Facial Lipoatrophy. Dermatol Surg. 2007;33(Suppl 2):S193-8.
- 80. Carruthers J, Carruthers A. Facial and Tissue Augmentation. Dermatol Surg. 2005;31:1604-12.
- 81. Carey DL, Baker D, Rogers GD, Petoumenos K, Chuah J, Easey N, et al. A randomized, open-label study of poly-L-lactic acid for HIV-1 facial lipoatrophy. J Acquir Immune Defic Syndr. 2007;46:581-9.
- 82. Denton AB, Tsaparas Y. Injectable hyaluronic acid for the correction of HIV-associated facial lipoatrophy. Otolaryngol Head Neck Surg. 2007;136:563-7.
Datas de Publicação
-
Publicação nesta coleção
01 Dez 2011 -
Data do Fascículo
Out 2011
Histórico
-
Recebido
12 Nov 2010 -
Aceito
28 Nov 2010