Resumos
O objetivo deste estudo foi avaliar a suscetibilidade do Trypanosoma evansi in vitro e in vivo à anfotericina B. Nos testes in vitro, foram utilizadas quatro concentrações (0,06; 0,25; 1,0; 4,0µg mL-1) de anfotecicina B frente a uma suspensão de T. evansi em solução tampão fosfato rico em glicose (PBS - glicose). Para avaliar a eficácia in vivo, foram utilizados 15 ratos parasitados com T. evansi. Em dois grupos de cinco ratos infectados, doses únicas diárias de 1 (grupo A) e de 3mg kg-1 (grupo B) foram administradas via intraperitonial durante 10 dias, e a parasitemia foi avaliada por meio de esfregaço sanguíneo. Grupo C (n=5) foi utilizado como grupo controle positivo, infectados com T. evansi e não tratados, e o grupo D (n=5), como controle negativo. Os ensaios in vitro evidenciaram suscetibilidade de 100% do T. evansi à anfotericina B após 7h, em todas as concentrações avaliadas. Nos ratos, nem a maior dose testada curou os roedores, apesar de ter prolongado a vida destes em comparação à vida dos animais infectados, mas não tratados. Foi também investigada a função hepática e renal dos ratos após a terapia, e os parâmetros bioquímicos analisados mantiveram-se dentro da normalidade. Conclui-se que o T. evansi in vitro é suscetível à anfotericina B. A dose 3mg kg-1 testada aumentou a expectativa de vida de ratos infectados, porém não teve efeito curativo.
Tripanossomose; tratamento; antibiótico; ratos
The aim of this study was to evaluate the Trypanosoma evansi susceptibility to amphotericin B in vitro and in vivo. Four concentrations (0.06, 0.25, 1.0, and 4.0µg mL-1) of amphotericin B were tested against a suspension containing T. evansi and phosphate buffer solution with glucose in the in vitro assay. Fifteen rats infected with T. evansi were used for the in vivo assay. Groups A (n=5) and B (n=5) received daily doses of 1 and 3mg kg-1 during 10 days and the parasitemia was estimated daily by microscopic examination of smears. The rats from group C (n=5) were the positive control and were infected but not treated. Rats from group D (n=5) were used as negative control. in vitro assays showed a 100% of susceptibility of T. evansi to amphotericin B after 7 hours, at all concentrations tested. The higher dose tested did not cure the rats, although treated rats had a longer life span in comparison to the non-treated group. Adverse effects on renal and hepatic hemodynamics were also researched. Biochemical parameters obtained were within the normal ranges. It was concluded that T. evansi is susceptible to amphotericin B in vitro. The dose of 3 mg kg-1 tested in rats increased life span, but did not cure the animals.
Trypanosomosis; treatment; antibiotic; rats
ARTIGOS CIENTÍFICOS
PARASITOLOGIA
Suscetibilidade de Trypanosoma evansi à anfotericina B
Trypanosoma evansi susceptibility to amphotericin B
Aleksandro Schafer da SilvaI; Juliano BottonII; Patrícia WolkmerII; Régis Adriel ZanetteIII; Sonia Terezinha dos Anjos LopesIV; Sydney Hartz AlvesV; Silvia Gonzalez MonteiroV,1 1 Autor para correspondência.
IPrograma de Pós-graduação em Medicina Veterinária, Universidade Federal de Santa Maria (UFSM), Santa Maria, RS, Brasil
IICurso de Medicina Veterinária, UFSM, Santa Maria, RS, Brasil
IIIPrograma de Pós-graduação em Ciências Veterinária, Universidade Federal do Rio Grande do Sul (UFRGS), Porto Alegre, RS, Brasil
IVDepartamento de Pequenos Animais, Centro de Ciências Rurais (CCR), UFSM, Santa Maria, RS, Brasil
VDepartamento de Microbiologia e Parasitologia, Centro de Ciências da Saúde (CCS), UFSM, Campus Universitário, km 9, Prédio 20, sala 4232, Camobi, 97105-900, Santa Maria, RS, Brasil. E-mail: sgmonteiro@uol.com.br
RESUMO
O objetivo deste estudo foi avaliar a suscetibilidade do Trypanosoma evansi in vitro e in vivo à anfotericina B. Nos testes in vitro, foram utilizadas quatro concentrações (0,06; 0,25; 1,0; 4,0µg mL-1) de anfotecicina B frente a uma suspensão de T. evansi em solução tampão fosfato rico em glicose (PBS - glicose). Para avaliar a eficácia in vivo, foram utilizados 15 ratos parasitados com T. evansi. Em dois grupos de cinco ratos infectados, doses únicas diárias de 1 (grupo A) e de 3mg kg-1 (grupo B) foram administradas via intraperitonial durante 10 dias, e a parasitemia foi avaliada por meio de esfregaço sanguíneo. Grupo C (n=5) foi utilizado como grupo controle positivo, infectados com T. evansi e não tratados, e o grupo D (n=5), como controle negativo. Os ensaios in vitro evidenciaram suscetibilidade de 100% do T. evansi à anfotericina B após 7h, em todas as concentrações avaliadas. Nos ratos, nem a maior dose testada curou os roedores, apesar de ter prolongado a vida destes em comparação à vida dos animais infectados, mas não tratados. Foi também investigada a função hepática e renal dos ratos após a terapia, e os parâmetros bioquímicos analisados mantiveram-se dentro da normalidade. Conclui-se que o T. evansi in vitro é suscetível à anfotericina B. A dose 3mg kg-1 testada aumentou a expectativa de vida de ratos infectados, porém não teve efeito curativo.
Palavras-chave: Tripanossomose, tratamento, antibiótico, ratos.
ABSTRACT
The aim of this study was to evaluate the Trypanosoma evansi susceptibility to amphotericin B in vitro and in vivo. Four concentrations (0.06, 0.25, 1.0, and 4.0µg mL-1) of amphotericin B were tested against a suspension containing T. evansi and phosphate buffer solution with glucose in the in vitro assay. Fifteen rats infected with T. evansi were used for the in vivo assay. Groups A (n=5) and B (n=5) received daily doses of 1 and 3mg kg-1 during 10 days and the parasitemia was estimated daily by microscopic examination of smears. The rats from group C (n=5) were the positive control and were infected but not treated. Rats from group D (n=5) were used as negative control. in vitro assays showed a 100% of susceptibility of T. evansi to amphotericin B after 7 hours, at all concentrations tested. The higher dose tested did not cure the rats, although treated rats had a longer life span in comparison to the non-treated group. Adverse effects on renal and hepatic hemodynamics were also researched. Biochemical parameters obtained were within the normal ranges. It was concluded that T. evansi is susceptible to amphotericin B in vitro. The dose of 3 mg kg-1 tested in rats increased life span, but did not cure the animals.
Key words: Trypanosomosis, treatment, antibiotic, rats.
INTRODUÇÃO
Trypanosoma evansi é um flagelado com ampla distribuição geográfica e importância econômica na África, Ásia e América latina (LUN & DESSER, 1995). Esse protozoário afeta um grande número de animais domésticos e silvestres, dentre eles, equinos, cães, coelhos, capivaras, quatis, bovinos, búfalos e tatus, além do próprio homem (DÁVILA & SILVA, 2000; HERRERA et al., 2004; JOSHI et al., 2005; DA SILVA et al., 2008). A disseminação do T. evansi é feita principalmente por tabanídeos (Tabanus sp., Chrysops sp. e Hematopota sp.), havendo também a possibilidade de transmissão por morcegos hematófagos (HOARE, 1972).
Nos vasos sanguíneos de vertebrados, o T. evansi apresenta-se na forma de tripomastigota. A tripanossomose causada por essa espécie pode causar doença aguda, que cursa com morte rápida em equinos e cães não tratados, e crônica, que afeta animais silvestres considerados possíveis reservatórios, como a capivara (Hydrochaeris hydrochaeris) e o quati (Nasua nasua) (SILVA et al., 2002; HERRERA et al., 2004). A doença causada por T. evansi é caracterizada por rápida perda de peso, graus variáveis de anemia, febre intermitente, edema dos membros pélvicos e das partes baixas do corpo e fraqueza progressiva. Os animais afetados podem morrer dentro de semanas ou poucos meses, mas podem ocorrer infecções crônicas com evolução de muitos meses (LEVINE 1973; BRUN et al., 1998). Sinais neurológicos centrais têm sido raramente descritos na fase terminal (SEILER et al., 1981).
A anfotericina B é um antibiótico isolado do actinomiceto Streptomyces sp., com atividade antimicótica principalmente, dependente de sua ligação ao ergosterol, um esterol presente na membrana de fungos (LACAZ & SAMPAIO, 1958). Sabe-se que esse antifúngico também tem ação antiparasitária, sendo por isso utilizado como segunda opção no tratamento de pacientes com leishmaniose quando o parasito se manifesta resistente à pentamidina (GOLENSER et al., 1999), com mais de 97% de cura registrada (THAKUR et al., 1999). Os gêneros Leishmania e Trypanosoma pertencem à mesma família (Trypanosomatidae) e, em virtude disto, objetivou-se realizar uma avaliação da suscetibilidade do T. evansi in vitro e in vivo à anfotericina B.
MATERIAL E MÉTODOS
Foi utilizado um isolado de T. evansi proveniente de um cão naturalmente infectado (COLPO et al., 2005). Os parasitos foram mantidos em laboratório, criopreservados em nitrogênio líquido e em ratos Wistar por meio de passagens sucessivas entre os roedores (SILVA et al., 2002).
O estudo foi realizado em duas etapas, sendo a primeira in vitro e outra in vivo. Para o estudo in vitro, foi utilizado sangue de dois ratos com elevada parasitemia por T. evansi. As amostras de sangue foram acrescidas de solução tampão fosfato rico em glicose (PBS - glicose), pH 7,0, na proporção de 1:1 (12/12mL). No sangue assim diluído foi realizada a contagem dos parasitos em câmara de Neubauer. Em seguida, volumes de 1,5ml do sangue diluído foram colocados em microtubos (tipo eppendorf) e mantidos à temperatura de 23ºC. Quatro concentrações finais de anfotericina B (0,06, 0,25, 1,0 e 4,0µg mL-1) foram utilizadas nos ensaios in vitro, em três repetições/dose. A curva de sobrevivência dos flagelados foi avaliada comparativamente a um grupo controle, não tratado com o fármaco. As contagens dos parasitos foram realizadas em triplicata a intervalos de 60min, durante 8h. Foram contadas apenas tripomastigotas móveis na suspensão.
Para o teste in vivo, foram utilizados 20 ratos (Rattus norvergicus) adultos, fêmeas, pesando em média 200g (±21,4). Os animais foram divididos em quatro grupos de cinco animais. Os animais dos grupos A, B e C foram inoculados pela via intraperitonial, com a dose 1x105 tripanossomas/roedor. O grupo D (controle negativo) não foi infectado. O desenvolvimento da parasitemia foi avaliado por meio de esfregaço sanguíneo periférico, realizado diariamente (DA SILVA et al., 2006). Após 48h da inoculação do parasito, foi iniciado o tratamento com anfotericina B nos grupos A e B, com doses de 1 e 3mg kg-1, respectivamente. O fármaco era administrada via intraperitonial em intervalos de 24h por um período de 10 dias. Nesse período, foram avaliados a parasitemia, os sinais clínicos e a longevidade dos ratos. O grupo C (controle positivo) não recebeu tratamento. No 11o dia após a inoculação, todos os animais foram anestesiados (éter dietílico 96%) para punção de 1ml de sangue intracardíaco para avaliação da função hepática (dosagens de alanina aminotransferase - ALT e fosfatase alcalina - FA) e função renal (dosagens de uréia e creatinina) (FELDMAN et al., 2000; BUSH, 2004). O teste de suscetibilidade do T. evansi em ratos tratados com anfotericina B teve duração de 32 dias, quando foram eutanasiados os animais sobreviventes.
Os resultados foram analisados estatisticamente por meio da análise de variância (ANOVA) para comparação entre as médias, seguida por aplicação do teste de Tukey, para avaliar a precisão dos dados (SILVA & AZEVEDO, 2002). O experimento foi aprovado pelo Comitê de Ética e Bem-Estar Animal da Universidade Federal de Santa Maria (UFSM), n° 23081.006402/2006-64, de acordo com legislação vigente e os Princípios Éticos publicados pelo Colégio Brasileiro de Experimentação Animal (COBEA).
RESULTADOS
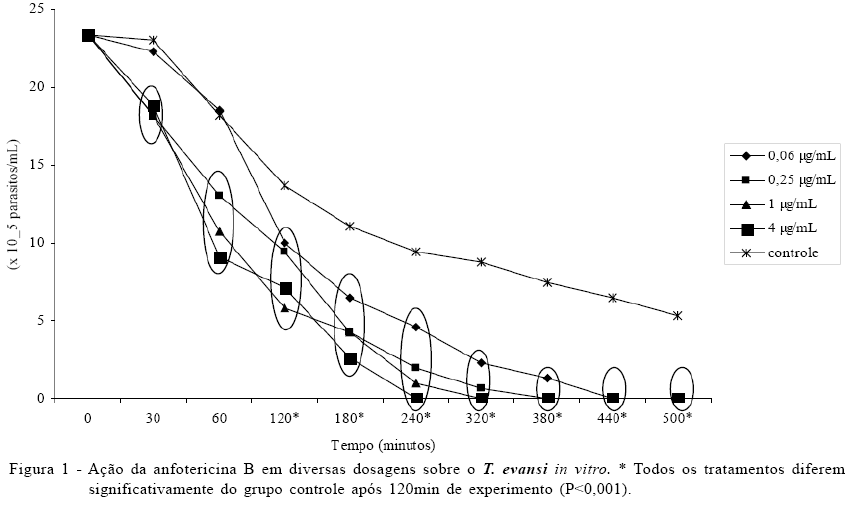
A suspensão para uso nos ensaios in vitro continha 2,34 x 106 parasitos ml-1. Trinta minutos após a adição da anfotericina B nas concentrações 0,25, 1 e 4µg mL-1, observou-se significativa redução do número de tripomastigotas vivos (Figura 1).
A curva de sobrevivência das formas tripomastigotas do T. evansi foi proporcional às concentrações de anfotericina B: na concentração de 4µg mL-1 após 4h, os parasitos estavam imóveis e o mesmo efeito só foi observado após 7h, quando se utilizou a menor concentração (0,06µg mL-1). Após 8h de contato com o antibiótico, a suspensão de parasitos do grupo controle apresentava 5,3 x 105 dos flagelados moveis (Figura 1). Nas demais concentrações-teste, eram observadas apenas formas tripomastigotas imóveis e/ou com membrana celular desestruturada ou somente núcleos do T. evansi livres na suspensão.
Nos ensaios in vivo (Tabela 1), foi verificado que todos os animais apresentavam esfregaço sanguíneo positivo para T. evansi após 48h da inoculação. A avaliação da parasitemia ao longo do experimento indicou que todos os animais dos grupos A, B e C mantiveram formas tripomastigotas circulantes, mostrando que as doses (1 e 3mg kg-1) de anfotericina B não eliminaram os parasitos. Cabe ressaltar que todos os ratos dos grupos A e C, além de dois roedores do grupo B, morreram apresentando elevada parasitemia (mais de 100 parasitos/campo em 1000x) durante o experimento.
O grupo A recebeu anfotericina B na dose de 1mg kg-1 e apresentou uma longevidade média de 15,8 dias, não diferindo significativamente do grupo C, que tiveram longevidade média de 13,2 dias. Quando foi avaliada a terapêutica com anfotericina na dose de 3mg kg-1 (grupo B), a longevidade média dos animais alcançou 24,8 dias, diferindo significativamente (P<0,05) da longevidade média dos grupos A e C.
Os parâmetros bioquímicos para avaliação de danos hepáticos e renais causados pela anfotericina B não indicaram diferenças estatisticamente significativas em relação aos controles negativos, ou seja, não houve efeitos adversos decorrentes do uso do fármaco (Tabela 1).
DISCUSSÃO
A anfotericina B é o fármaco leishmanicida que atua nas formas promastigotas e amastigotas, tanto in vitro, quanto in vivo (CARVALHO, 2000). Analisando a curva de sobrevivência, foi observado que a anfotericina B também tem ação sobre formas tripomastigotas de T. evansi, em consequência da redução de flagelados móveis, de estruturas de membrana rompida e núcleos livres na suspensão após 8h.
Este estudo não estabeleceu como e o fármaco agiu para acarretar a morte do T. evansi. Porém, sabe-se que, no caso da Leishmania sp., a anfotericina B interage especificamente com o ergosterol, esteroide da membrana do parasito, causando aumento de permeabilidade e consequentemente morte deste (BERMAN, 1997). Como o ergosterol também é um constituinte da membrana celular dos tripanossomas (GROS et al., 2006), pode ter sido esse o mecanismo de ação do fármaco sobre o flagelado. Foi evidenciado que a anfotericina apresenta algum efeito nocivo sobre o parasito, sendo necessárias pesquisas mais específicas a fim de identificar como o T. evansi é afetado pela anfotericina B.
No experimento in vivo, a dose de 3mg kg-1 aumentou a expectativa de vida dos ratos infectados com T. evansi, mas não curando os animais. Porém, no tratamento de hamsters infectados com Leishmania sp., a anforeticina B mostrou eficácia superior a 90% na cura dos roedores (MANANDHAR et al., 2008).
O fármaco mais utilizada para o tratamento de T. evansi em animais é o aceturato de diminazeno (PEREGRINE & MAMMAN, 1993). Esse medicamento tem potencial de eliminar o parasito da circulação poucas horas depois de administrado. Porém, quando utilizado na dose recomendada pelo fabricante, muitas vezes os animais têm recidiva da parasitemia (TUNTASUVAN et al., 2003). Em infecção experimental de ratos, foi constatado que, quando o aceturato de diminazeno é utilizado em dose única de 3,5mg kg-1, os roedores voltam a apresentar parasitemia crescente, com morte dos animais (DOYLE et al., 2007). Um ponto a ser pesquisado é se o aceturato e a anfotericina têm sinergismo capaz de potencializar a ação contra o parasito e assim proporcionar a cura definitiva dos animais.
A anfotericina B administrada por 10 dias não acarretou alteração no fígado e nos rins dos roedores. Comparando os animais dos grupos C e D, foi verificado que o T. evansi também não acarretou alteração nos níveis de ALT, FA, ureia e creatinina, portanto não foram encontradas evidências de lesão hepática ou renal (Tabela 1). Esses resultados diferem de outra pesquisa, utilizando o mesmo isolado de T. evansi em ratos, em que as concentrações plasmáticas de ALT e creatinina aumentaram consideravelmente em consequência do elevado número de parasitos na circulação (DA SILVA et al., 2007). Tanto a anfotericina B (BERMAN, 1997; THAKUR, et al., 1999), quanto à infecção por T. evansi (SILVA et al., 2002; DA SILVA et al., 2007), poderiam ser responsáveis por eventuais alterações das funções hepáticas e renais. Provavelmente, não ocorreu mudança nesses parâmetros bioquímicos em consequência de o número de parasitos circulantes estar reduzido no grupo B, isto é, infecção crônica (entre 5 e 30 flagelados/campo em 1000x), ao contrário do que ocorreu em outro estudo em ratos que apresentaram infecção aguda e longevidade de cinco dias pós-infecção com parasitemia superior a 50 tripomastigotas por campo em 1000x (DA SILVA et al., 2007).
CONCLUSÃO
Com base nos resultados obtidos, conclui-se que o T. evansi é suscetível à anfotericina B nas doses 0,06, 0,25, 1,0 e 4,0µg mL-1 e que, quanto maior a concentração do fármaco, menor é a taxa de sobrevivência de tripomastigotas de T. evansi in vitro. O protocolo terapêutico de 3mg kg-1 de anfotericina B utilizado em ratos aumenta o período de vida, porém não tem efeito curativo.
Recebido para publicação 21.07.09
Aprovado em 10.08.09
- BERMAN, J.D. Human leishmaniasis: clinical, diagnostic and chemotherapeutic developments in the last 10 years. Clinical Infections Diseases, v.24, n.4, p.684-703, 1997. Disponível em: <http://www.jstor.org/pss/4481074>. Acesso em: 07 ago. 2009.
- BUSH, B.M. Interpretação de resultados laboratoriais para clínicos de pequenos animais São Paulo: Roca, 2004. 376p.
- BRUN, R. et al. Trypansosoma evansi and T. equiperdum: distribution, biology, treatment and phylogenetic relationship (a review). Veterinary Parasitology, v.79, n.2, p.95-107, 1998. Disponível em: <http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6TD7-3TTCHCS-J&_user=10&_rdoc=1&_fmt=&_orig=search&_sort=d&_doca nchor=&view=c&_acct=C000050221&_versio n=1&_urlVersion=0&_userid=10&md5 =479d3369082db7011b256401ae71fab0>. Acesso em: 07 ago. 2009. doi: 10.1016/S0304-4017(98)00146-0.
- CARVALHO, S.F.G. Utilização de baixas doses de Desoxicolato de Anfotericina B no tratamento da leishmaniose visceral em crianças e adolescentes 2000. 107f. Dissertação (Mestrado em Pediatria) - Faculdade de Medicina, Universidade Federal de Minas Gerais, Minas Gerais, Belo Horizonte, MG.
- COLPO, C.B. et al. Infecção natural por Trypanosoma evansi em cão no Rio Grande do Sul. Ciência Rural, v.35, n.3, p.717-719, 2005. Disponível em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0103-84782005000300038>. Acesso em: 07 ago. 2009. doi: 10.1590/S0103-84782005000300038.
- DOYLE, R.L. et al. Eficácia de medicamentos no controle de infecção experimental por Trypanosoma evansi Acta Scientiae Veterinariae, v.35, n.1, p.67-71, 2007. Disponível em: <http://www.ufrgs.br/actavet/35-1/artigo706.pdf>. Acesso em: 07 ago. 2009.
- DA SILVA, A.S. et al. Método de contenção e confecção de esfregaço sanguíneo para pesquisa de hemoparasitas em ratos e camundongos. Faculdade de Zootecnia, Veterinária e Agronomia, v.13, n.2, p.153-157, 2006. Disponível em: <http://revistaseletronicas.pucrs.br/ojs/index.php/fzva/article/viewFile/2374/1861>. Acesso em: 07 ago. 2009.
- DA SILVA, A.S. et al. Alterações bioquímicas em Rattus norvergicus experimentalmente infectados com Trypanosoma evansi Caderno de Pesquisa. Série Biologia, v.19, p.17-22, 2007. Disponível em: <http://www.bioline.org.br/abstract?id=cp07010&lang=pt>. Acesso em: 07 ago. 2009.
- DA SILVA, A.S. Alterações hematológicas em coelhos infectados experimentalmente pelo Trypanosoma evansi Ciência Rural, v.38, n.2, p.538-542, 2008. Disponível em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0103-84782008000200040&lng=en&nrm=iso&tlng=pt>. Acesso em: 07 ago. 2009. doi: 10.1590/S0103-84782008000200040.
- DÁVILA, A.M.R.; SILVA, R.A.M.S. Animal trypanosomiasis in South America. Current status, partnership, and information technology. Annals of the New York Academy of Sciences, v.916, p.199-212, 2000. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/11193622>. Acesso em: 07 ago. 2009.
- FELDMAN, B.F. et al. Veterinary hematology Wilkins: Lippincott Williams, 2000. 1344p.
- GOLENSER, J. et al. Efficacious treatment of experimental leishmaniasis with amphotericin b-arabinogalactan water-soluble derivatives. Antimicrob Agents Chemother, v.43, n.9, p.2209-2214, 1999. Disponível em: <http://aac.asm.org/cgi/content/abstract/43/9/2209?maxtoshow=&HITS=10&hits=10&RES ULTFORMAT=&fulltext=%C2%B5g&s earchid=1&FIRSTINDEX=400&resourcetype=HWFIG>. Acesso em: 07 ago. 2009.
- GROS, L. et al. New azasterols against Trypanosoma brucei: role of 24-sterol methyltransferase in inhibitor action. Antimicrobial Agents and Chemotherapy, v.50, n.8, p.2595-2601, 2006. Disponível em: <http://aac.asm.org/cgi/content/abstract/50/8/2595>. Acesso em: 07 ago. 2009.
- HERRERA, H.M. et al. Enzootiology of Trypanosoma evansi in Pantanal, Brazil. Veterinary Parasitology, v.125, n.3-4, 263-275, 2004. Disponível em: <http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6TD7-4D99K9P-6&_user=10&_rdoc=1&_fmt=&_orig=search&_sort=d&_docanc hor=&view=c&_acct=C000050221&_version=1 &_urlVersion=0&_userid=10&md5 =14d981d0a24079958d46d189c70e718d>. Acesso em: 07 ago. 2009. doi:10.1016/j.vetpar.2004.07.013.
- HOARE, C.A. The Trypanosomes of mammals: a zoological monograph Oxford: Blackwell, 1972. 749p.
- JOSHI, P.P. et al. Human Trypanosomosis caused by Trypanosoma evansi in India: the first case report. American of Journal Tropical Medicine Hygiene, v.73, n.3, p.491-495, 2005. Disponível em: <http://www.ajtmh.org/cgi/content/abstract/73/3/491>. Acesso em: 07 ago. 2009.
- LACAZ, C.S; SAMPAIO, S.A.P. Tratamento da blastomicose sul-americana com anfotericina B. Resultados Preliminares. Revista Paulista de Medicina, v.52, p.443-450, 1958.
- LEVINE, N.D. Protozoan parasites of domestic animals and of man Minneapolis: Burgess Publishing, 1973. 406p.
- LUN, Z.R.; DESSER, S.S. Is the broad range of hosts and geographical distribuition of Trypanosoma evansi attributable to the loss of maxicircle kinetoplast DNA? Parasitology Today v.11, p.131-133, 1995. Disponível em: <http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6TB8-43PR47P-4J&_user=10&_rdoc=1&_fmt=&_ori g=search&_sort=d&_docanchor=&view= c&_searchStrId=975695570&_rerunOrigin=google&_acct=C000 050221&_version=1&_urlVersion=0&_userid=1 0&md5=3abd3799ee0edc8857663d624d5e476d>. Acesso em: 07 ago. 2009. doi:10.1016/0169-4758(95)80129-4.
- MANANDHAR, K.D. et al. Antileishmanial activity of nano-amphotericin B deoxycholate. Journal of Antimicrobial Chemotherapy, v.62, n.2, p.376-380, 2008. Disponível em: <http://jac.oxfordjournals.org/cgi/content/abstract/dkn189>. Acesso em: 07 ago. 2009. doi: 10.1093/jac/dkn189.
- PEREGRINE, A.S.; MAMMAN, M. Pharmacology of diminazine: a review. Acta Tropica, v.54, n.1, p.185-203, 1993. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/7902657>. Acesso em: 07 ago. 2009.
- SEILER, R.J. et al. Meningoencephalitis in naturally occurring Trypanosoma evansi infection (surra) of horses. Veterinary Pathology, v.18, p.120-122, 1981. Disponível em: <http://www.labmeeting.com/paper/16219729/seiler-1981-meningoencephalitis-in-naturally-occurring-trypanosoma-evansi-infection-(surra)-of-horses>. Acesso em: 07 ago. 2009.
- SILVA, R.A.M.S. et al. Trypanosoma evansi e Trypanosoma vivax: Biologia, Diagnóstico e controle Corumbá: Embrapa Pantanal. 2002. 137p. Disponível em: <http://www.cpap.embrapa.br/publicacoes/online/Livro015.pdf>. Acesso em: 07 ago. 2009.
- SILVA, F.A.Z.; AZEVEDO, C.A.V. Versão do programa computacional Assistat para o sistema operacional Windows. Revista Brasileira de Produtos Agroindustriais, v.4, p.71-78, 2002. Disponível em: <http://www.deag.ufcg.edu.br/rbpa/rev41/Art410.pdf>. Acesso em: 07 ago. 2009.
- THAKUR, C.P. et al. Amphotericin B deoxycholate treatment of visceral leishmaniasis with newer modes of administration and precautions: a study of 938 cases. Transactions of the Royal Society of Tropical Medicine & Hygiene, v.93, n.3, p.319-323, 1999. Disponível em: <http://www.journals.elsevierhealth.com/periodicals/trstmh/article/PIIS0035920399900378/abstract>. Acesso em: 07 ago. 2009.
- TUNTASUVAN, D. et al. Chemotherapy of surra in horses and mules with diminazene aceturate. Veterinary Parasitology, v.110, n.3-4, p.227-233, 2003. Disponível em: <http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6TD7-472JCX5-1&_user=10&_rdoc=1&_fmt=&_orig=search&_sort=d&_doca nchor=&view=c&_searchStrId=975708702&_rerunOrigin=google &_acct=C000050221&_version=1&_urlVersion=0& _userid=10&md5=4c204c757ba74c946a1a4d9fa4740a08>. Acesso em: 07 ago. 2009. doi:10.1016/S0304-4017(02)00304-7.
Datas de Publicação
-
Publicação nesta coleção
11 Dez 2009 -
Data do Fascículo
Dez 2009
Histórico
-
Recebido
21 Jul 2009 -
Aceito
10 Ago 2009