RESUMO
As enzimas fibrinolíticas podem ser obtidas de micro-organismos por meio de processos fermentativos. O presente trabalho teve como objetivo avaliar a produção e extração integrada da protease fibrinolítica de Mucor subtilissimus UCP 1262 usando sistema de duas fases aquosas (SDFA). O processo integrado foi realizado para avaliar a produção, partição e recuperação da protease fibrinolítica, segundo planejamento experimental 23, utilizando como variáveis independentes a massa molar do polietileno glicol (PEG), a concentração do PEG e a concentração do sulfato de sódio. A maior atividade fibrinolítica (15,40U/mL) foi obtida na fase rica em sulfato de sódio no ensaio composto por 10% de sal e 18% de PEG 8000 (g/mol). Recuperações superiores a 80% foram obtidas. A protease fibrinolítica apresentou pH ótimo 7,0, estabilidade entre os pH 6,0 e 8,5, temperatura ótima 50°C, sendo estável de 10°C a 50°C. A enzima foi classificada como uma serino protease, com massa molecular de 52kDa. Como resultado, o processo é notavelmente eficaz para pré-purificar a protease fibrinolítica com baixo custo e rapidez significativa. Quando comparada a outras técnicas de produção e purificação isoladas, a fermentação extrativa é um processo digno a ser substituto das etapas iniciais de separação convencionais
Palavras-chave:
fungo filamentoso; produção de enzima; fermentação extrativa; SDFA
ABSTRACT
Fibrinolytic enzymes can be obtained from microorganisms through fermentative processes. The study aimed to evaluate the fibrinolytic protease production and integrated extraction from Mucor subtilissimus UCP 1262 by extractive fermentation using Aqueous Two-Phase Systems (ATPS). The integrated process was carried out to assess the production, partition and fibrinolytic enzyme recovery, according to a 2 3 -experimental design, using as independent variables Polyethylene glycol (PEG) molar mass, PEG and sodium sulphate concentration, concentration. The highest fibrinolytic activity (15.40U/mL) was obtained in sodium sulfate rich phase in the assay comprising of 10% of salt and 18% of PEG 8000 (g/mol). Yield greater than 80% was obtained. The fibrinolytic protease presented optimum pH 7.0 and stability between pH 6.0 and 8.5, and optimum temperature 50°C, stable between 10°C to 50°C. The enzyme was classified as a serine-protease with 52kDa of molecular weight. As a result, the process is remarkably effective to pre-purify the fibrinolytic protease with a low cost and significantly faster processing time. When compared to other isolated production and purification techniques the extractive fermentation is worthy of being a candidate to replace the initial stages of conventional separation processes.
Keywords:
filamentous fungi; enzyme production; extractive fermentation; ATPS
INTRODUÇÃO
Proteases fibrinolíticas degradam a fibrina, o maior componente proteico dos coágulos sanguíneos, os quais, se acumulados, podem levar à trombose (Medeiros et al., 2013MEDEIROS, G.M.S.; MARQUES, D.A.V.; PORTO, T.S. et al. Extraction of fibrinolytic proteases from Streptomyces sp. DPUA1576 using PEG-phosphate aqueous two-phase systems. Fluid Phase Equilib., v.339, p.52-57, 2013.). O uso de ativadores de plasminogênio para o tratamento da trombose tem sido utilizado como alternativa para a terapia fibrinolítica há mais de 30 anos. Tais ativadores são sintetizados pela engenharia genética e possuem alta afinidade com a fibrina, tornando-se um agente de origem humana seguro, entretanto de alto custo (Tian et al., 2015TIAN, C.H.; SHOW, P.L.; OOI, C.W. et al. Novel lipase purification methods - a review of the latest developments. Biotechnol. J., v.10, p.31-44, 2015. ). Diante dessa dificuldade, tem-se estimulado a utilização de micro-organismos para se obterem proteases fibrinolíticas de alta eficácia, baixo custo e maior capacidade de produção (Deepak et al., 2010DEEPAK, V.; ILANGOVAN, S.; SAMPATHKUMAR, M.V. et al. Medium optimization and immobilization of purified fibrinolytic URAK from Bacillus cereus NK1 on PHB nanoparticles. Enzyme Microbiol. Technol., v.47, p.297-304, 2010. ).
O custo da produção e purificação de enzimas na indústria é o maior obstáculo para a aplicação com sucesso de proteases na medicina. Para a produção de enzimas fibrinolíticas, muitas tentativas têm sido feitas para aumentar a expressão da enzima, incluindo a seleção de um meio de cultura ideal e a otimização das condições ambientais. Além de fatores que otimizem a produção de enzimas, as indústrias têm buscado eficiência e baixo custo-benefício nos processos de separação e purificação dessa biomolécula, obtendo rendimento e pureza elevados (Nalinanon et al., 2009NALINANON, S.; BENJAKUL, S.; VISESSANGUAN, W.; KISHIMURA, H. Partitioning of protease from stomach of albacore tuna (Thunnusalalunga) by aqueous two-phase systems. Process Biochem., v.44, p.471-476, 2009.).
Fermentação extrativa ou recuperação do produto in situ tem sido sugerida como solução para superar a inibição dos produtos e a baixa produtividade dos processos biotecnológicos (Ashipala e He, 2008ASHIPALA, O.K.; HE, Q. Optimization of fibrinolytic enzyme production by Bacillus subtilis DC-2 in aqueous two-phase system (poly-ethylene glycol 4000 and sodium sulfate). Biol. Technol., v.99, p.4112-4119, 2008. ). O desenvolvimento eficiente de bioprocessos para a recuperação e purificação de produtos biológicos representa uma das principais preocupações para a indústria biotecnológica (Chavez-Santoscoy et al., 2010). Desse modo, o objetivo deste trabalho foi a produção e a purificação de protease com atividade fibrinolítica, por meio de fermentação extrativa de Mucor subtilissimus UCP 1262, utilizando PEG e sulfato de sódio, bem como a caracterização bioquímica da enzima, incluindo eletroforese e zimograma.
MATERIAL E MÉTODOS
O fungo Mucor subtilissimus UCP 1262 utilizado neste estudo foi isolado do solo da Caatinga, obtido por meio do Projeto Rennorfun/CNPq/FACEPE, e autenticado taxonomicamente pela Universidade Católica de Pernambuco (UNICAP). A linhagem fúngica foi mantida e repicada em Czapek Dox Agar, incubada em estufa microbiológica a 30°C e preservada em óleo mineral.
Para a produção, foi utilizado o meio MS-2 (Porto et al., 1996PORTO, A.L.F.; CAMPOS-TAKAKI, G.M.; LIMA FILHO, J.L. Effects of culture conditions on protease production by Streptomyces clavuligerus growing on the soy bean flour medium. Appl. Biochem. Biotechnol., v.60, p.115-122, 1996.), composto por: 2,0% de farinha de soja, 0,06% de MgSO4.7H2O, 0,1% de NH4Cl, 0,435% de K2HPO4 e 0,1mL de solução mineral (100mg de FeSO4, MnCl2.4H2O, ZnSO4, CaCl2.H2O em 100mL de água destilada, com pH inicial 7,2), e uma variação alterando o substrato de soja por trigo. A autoclavagem do meio de cultivo foi realizada a 121°C/ 1 atm de pressão, durante 20 minutos. Frascos Erlenmeyer (125mL) contendo 50mL de meio de produção foram inoculados com uma solução de esporos a 104 esporos/mL. A fermentação homogênea foi realizada em agitador orbital a 120rpm, 30°C, até 120 horas. O líquido metabólico obtido após centrifugação foi utilizado para determinações analíticas.
A fermentação extrativa utilizando sistema de duas fases aquosas (SDFA) foi realizada misturando-se diferentes massas molares do PEG (g/mol) e concentrações de PEG e sulfato de sódio (Na2SO4) de acordo com o planejamento experimental 23. O planejamento fatorial foi composto por oito ensaios e quatro repetições do ponto central, totalizando 12 ensaios. Foi utilizado o meio de soja MS-2 descrito por Porto et al. (1996PORTO, A.L.F.; CAMPOS-TAKAKI, G.M.; LIMA FILHO, J.L. Effects of culture conditions on protease production by Streptomyces clavuligerus growing on the soy bean flour medium. Appl. Biochem. Biotechnol., v.60, p.115-122, 1996.), autoclavado a 121°C por 20 minutos. Ao meio, foram adicionadas concentrações determinadas dos componentes das fases do sistema de extração (PEG e sal) para que fosse possível compor o sistema para a fermentação extrativa.
A fermentação extrativa foi realizada em agitador orbital a 120rpm, 30°C, por 72 horas. Após o período de cultivo, os ensaios da fermentação extrativa foram mantidos em repouso por uma hora para separação das fases. Após essa separação, os volumes das fases foram verificados e registrados, as fases foram separadas e centrifugadas para garantir a uniformidade da amostra. Todas as análises estatísticas e os gráficos foram realizados com o programa Statistica 8.0 (2008).
A determinação da atividade fibrinolítica foi realizada de acordo com a metodologia descrita por Wang et al. (2011WANG, S.; WU, Y.; LIANG, T. Purification and biochemical characterization of a nattokinase by conversion of shrimp shell with Bacillus subtilis TKU007. N. Biotechnol., v.28, p.196-202, 2011.), que consiste, inicialmente, em 0,4mL de fibrinogênio a 0,72%, 0,1mL de tampão fosfato de sódio a 245mM em pH 7, inserido em banho-maria por cinco minutos a 37ºC. Logo após, foi colocado 0,1mL de trombina equivalente a 20U/mL; por fim, essa solução foi incubada a 37ºC por 10 minutos. Depois disso, adicionou-se 0,1mL do líquido metabólito livre de células. Após 60 minutos, adicionou-se 0,7mL TCA a 0,2M na reação e esta foi centrifugada a 12.000rpm por 20 minutos. Por fim, foi retirado 1mL do sobrenadante para a leitura em espectrofotômetro no comprimento de onda a 275nm, portanto 1 unidade de atividade enzimática (U) foi definida como a variação da absorbância de 0,01 por minuto. O teor de proteínas dos extratos brutos foi determinado por meio do método de Bradford (1976BRADFORD, M.M. A rapid and sensitive method for the quantification of protein utilizing the principle of protein-dye binding. Anal. Biochem., v.72, p.148-254, 1976.), expresso em mg/mL.
A quantificação proteásica foi determinada pelo método de Ginther (1979GINTHER, C.L. Sporulation and the production of serine protease and cephamycin C by Streptomyces lactamdurans. Antimicrobiol. Agents Chemother., v.15, p.522-526, 1979.). A atividade amidolítica foi determinada pelo método de Chong et al. (2002CHONG, A.S.C.; HASHIM, R.; CHOW-YANG, L.; ALI, A.B. Partial characterization and activities of proteases from the digestive tract of discus fish (Symphysodon aequifasciata). Aquaculture, v.203, p.321-333, 2002.), utilizando-se o substrato cromogênico SApNA (succinyl phenylalanine proline alanine aminotransferase p-nitroanilide) para reação. Após a incubação por 10 minutos, a 37°C, a quantidade de p-nitroanilina liberada por minuto foi mensurada pela variação da absorbância a 405nm, sendo 1 unidade (U) de atividade enzimática definida pela quantidade de enzima requerida para a produção de 1mol de p-nitroanilina por minuto.
O coeficiente de partição da protease fibrinolítica (K) foi determinado pela razão entre as atividades da protease fibrinolítica na fase superior ou PEG (AFPEG) e na fase inferior ou sal (AFsal). (K= AFPEG/AFsal).
A recuperação enzimática (Y) foi determinada por Chouyyok et al. (2005CHOUYYOK, W.; WONGMONGKOL, N.; SIWARUNGSON, N.; PRICHANONT, S. Extraction of alkaline protease using an aqueous two-phase system from cell free Bacillus subtilis TISTR 25 fermentation broth. Process Biochem., v.40, p.3514-3518, 2005.), de acordo com a equação seguinte: , sendo Vr a razão entre os volumes das fases PEG e sal.
Para estudo do efeito do pH na reação, o substrato para a atividade proteásica foi solubilizado em diferentes tampões - acetato de sódio (pH 3,0-5,0), fosfato-citrato (pH 5,0-7,0), Tris-HCl (pH 7,0-8,5) e NaOH-glicina (pH 8,5-11,0), enquanto no estudo da estabilidade ao pH, o extrato enzimático purificado foi exposto aos mesmos tampões, na proporção de 1:100, e incubado a 37°C por duas horas, sendo retiradas alíquotas a cada 30 minutos. O efeito da temperatura foi determinado pela incubação da reação para determinar a atividade proteásica em temperaturas variando entre 10 e 100ºC, por um período de uma hora. Para determinação da estabilidade à temperatura, foram retiradas alíquotas a cada 30min, durante um período de exposição de duas horas a várias temperaturas.
A influência das soluções iônicas foi avaliada na concentração de 2,5mM, 5mM e 10mM. O extrato enzimático purificado foi exposto aos seguintes íons: sulfato de zinco [(ZnSO4).7H2O], sulfato de magnésio [MgSO4], sulfato de cobre [CuSO4], sulfato de ferro [FeSO4], cloreto de cálcio [CaCl2], cloreto de potássio [KCl], cloreto de sódio [NaCl], cloreto de ferro [FeCl3], cloreto de zinco [ZnCl2], e incubado a 37°C por uma hora. Os íons foram dissolvidos em tampão Tris-HCl NaCl pH 7,75 a 0,15M.
Foram realizados ensaios para avaliar o efeito de algumas substâncias na atividade da enzima. O extrato enzimático purificado foi exposto a diferentes inibidores: PMSF (fluoreto de metilfenilsulfonil - C7H7FO2S), pepstatina A (C34H63N5O9), (-mercaptoetanol ((-hidroxi-1-etanotiol - C2H6SO) e EDTA (ácido etilenodiamino tetra-acético - C10H16N2O8) e incubado por uma hora a 37°C. Os inibidores foram dissolvidos em tampão Tris-HCl NaCl pH 7,75 a 0,15M, e a concentração das soluções foi padronizada em 10mM.
A influência do SDS (dodecilsulfato de sódio - C12H25SO4Na) foi estudada nas concentrações de 0,5; 1,0 e 2,0mM. O efeito de compostos surfactantes na atividade proteásica foi avaliado utilizando-se Triton X-100 (C14H22O (C2H4O)n ), Tween 20 (monopalmitato de polioxietileno sorbitano - C58H114O26) e Tween 80 (monopalmitato de polioxietileno sorbitano - C64H124O26), que foram testados a 0,5; 1,0 e 2,0%. O extrato enzimático purificado foi exposto aos surfactantes e incubado a 37°C por uma hora. Os surfactantes foram dissolvidos em tampão Tris-HCl NaCl pH 7,75 a 0,15M.
A eletroforese SDS-PAGE foi determinada utilizando-se gel de concentração com 5% de poliacrilamida e gel de corrida com 12% de poliacrilamida. A corrida foi realizada a 25mA, segundo Laemmli (1970LAEMMLI, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, v.227, p.680-685, 1970.). Procedeu-se à coloração das proteínas pela imersão do gel, por duas horas, em uma solução contendo 0,1% de Coomassie Blue R-250. Para descoloração, o gel foi imerso em uma solução de ácido acético, metanol e água, na proporção de 7:40:53.
O zimograma foi realizado em gel de fibrina a 11%, contendo 0,12% de fibrinogênio e solução de trombina (1U/mL) (Kim, 1996KIM, W.; CHOI, K.; KIM, Y. et al. Purification and characterization of a fibrinolytic enzyme produced from Bacillus sp. strain CK 11-4 screened from chungkook-jang. Appl. Environ. Microbiol., v.62, p.2482-2488, 1996.). Após a corrida da eletroforese, o gel foi lavado com uma solução 2,5% de Triton X-100 durante uma hora, sendo submetido à lavagem com água destilada por três vezes e incubado em tampão de reação (0,1M de glicina, pH 8,4) a 37°C, por 18 horas. Os procedimentos de coloração e descoloração foram como descritos para a SDS-PAGE.
RESULTADOS
A influência de duas diferentes fontes de nitrogênio (farelo de trigo e farinha de soja) foi avaliada na produção de proteases e proteases fibrinolíticas por Mucor subtilissimus UCP 1262 em fermentação homogênea. Os resultados obtidos estão apresentados na Tab. 1.
Produção de proteases e proteases fibrinolítica por Mucor subtilissimus UCP 1262 por fermentação homogênea, em meio de cultivo composto por farinha de soja ou farelo de trigo como fonte de nitrogênio
A melhor condição da fermentação homogênea apresentou 77,0 (U/mL) de atividade proteásica e 13,43U/mL de atividade fibrinolítica após 72 horas de cultivo em meio contendo farinha de soja. Já nos ensaios contendo farinha de trigo, as atividades apresentadas foram de 64,30 para protease e 4,83U/mL para fibrinolítica após 96 horas. A farinha de soja foi a fonte de nitrogênio, e o tempo de 72 horas foi selecionado para os demais ensaios.
Sistemas de duas fases aquosas compostos por PEG e sulfato de sódio (Na2SO4) foram utilizados para a fermentação extrativa visando à produção e ao particionamento da protease fibrinolítica de forma integrada, em uma única etapa, como mostra a matriz do planejamento com os resultados (Tab. 2). Foi observado que a biomassa migrou para fase rica em PEG e, em todos os experimentos, foram obtidas atividades fibrinolíticas.
A protease fibrinolítica particionou preferencialmente para a fase superior do sistema (rica em PEG) na maioria dos ensaios do planejamento, tendo valores de coeficiente de partição maiores que 1 (K ≥1), com exceção dos ensaios 2 e 12 (Tab. 2). Entretanto, o maior valor em atividade fibrinolítica (15,40U/mL) foi obtido na fase inferior do sistema, rica em sulfato de sódio, no ensaio 2, composto por massa molar do PEG 8000g/mol, concentração de PEG 18% e concentração de sal de 10%.
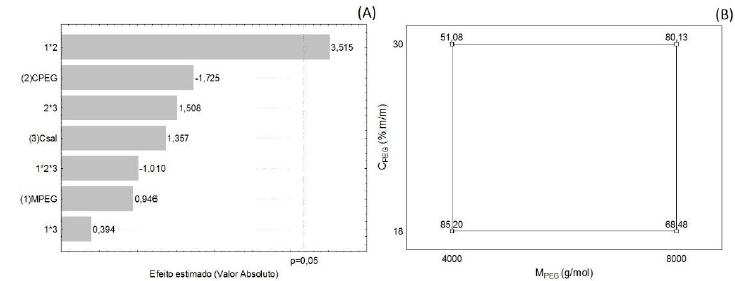
Os valores de recuperação enzimática (Y) com mais de 80% indicam uma alta atividade da protease fibrinolítica mantida nas fases (Tab. 2). Entre as variáveis independentes utilizadas nesse processo, estatisticamente, apenas a interação entre a massa molar do PEG (MPEG) e a concentração de PEG (CPEG) teve efeito significativo e positivo (Fig. 1A), ou seja, o sinergismo entre os menores valores dessas variáveis contribuiu para o aumento da recuperação enzimática (Fig. 1B). Assim, quando combinados os menores valores da MPEG e da CPEG, obtiveram-se maiores valores de Y.
(A) Gráfico de Pareto dos efeitos das variáveis sobre a recuperação enzimática (Y); (B) diagrama para interpretação geométrica dos efeitos da interação entre concentração (CPEG) e massa molar do PEG (MPEG) para a recuperação enzimática (Y).
Para verificar a pureza da protease fibrinolítica produzida por Mucor subtilissimus UCP 1262 em fermentação extrativa, foi realizada eletroforese SDS-PAGE e zimograma de fibrina (Fig. 2). Verificou-se que, após a corrida no gel, a banda referente à protease fibrinolítica, presente na fase rica em sal, ficou entre os marcadores de massa molecular 52 e 76kDa, sendo calculada como 52kDa. Pode-se observar a área clara no zimograma de fibrina correspondente à protease fibrinolítica, pois a enzima foi capaz de degradar a fibrina eficientemente.
Representação da eletroforese SDS-PAGE (12%) e do zimograma de fibrina. (A) Marcador de massa molecular; (B) extrato bruto obtido por meio da fermentação homogênea, (C) fase sal da fermentação extrativa com PEG 8000 e sulfato de sódio; (D) zimograma de fibrina da fase sal da fermentação extrativa.
Foi verificado, com o substrato SApNA, que a protease fibrinolítica produzida por Mucor subtilissimus UCP 1262 apresenta especificidade semelhante à enzima quimiotripsina, obtendo atividade de 20,03U/mg.
Em relação à caracterização bioquímica, a protease fibrinolítica purificada atuou em sua máxima eficiência na temperatura de 50°C (Fig. 3). A atividade da protease foi mantida no intervalo entre 10°C e 50°C, mantendo-se estável por 60 minutos a 37°C, com atividade residual de 104,45%. Em razão do aumento de temperatura (maior ou igual a 60°C), a protease sofreu uma redução da sua atividade devido à desnaturação.
Efeito da temperatura sobre a atividade da protease fibrinolítica produzida por Mucor subtilissimus UCP 1262 na fase sal da fermentação extrativa utilizando PEG/sulfato de sódio. Temperatura ótima (●) e estabilidade à temperatura (■) em 60min.
O pH ótimo foi 7,0, obtido no tampão citrato-fosfato (atividade residual de 111,59%) (Fig. 4). A atividade da protease foi conservada no intervalo entre o pH 6,0 e o 8,5, sendo a atividade residual mantida em torno de 100% após 60 minutos de reação. Em pH muito ácido ou muito básico, nota-se a diminuição da atividade residual da protease, que teve seu ponto mínimo em pH 4,0.
Efeito do pH sobre a atividade da protease fibrinolítica produzida por Mucor subtilissimus UCP 1262 na fase sal da fermentação extrativa utilizando PEG/sulfato de sódio. pH ótimo (●) e estabilidade ao pH (■) em 60min.
O efeito de íons metálicos sobre a atividade enzimática foi avaliado observando-se a atividade residual da protease fibrinolítica. Verificou-se um incremento da atividade enzimática pelos íons Mg2+, Fe2+, Ca2+, K+ e Na2+ em todas as concentrações testadas (2,5mM, 5mM e 10mM). Além disso, um efeito inibitório da atividade enzimática residual foi verificado em presença dos íons Zn2+ (89,56% e 54,52%), nas concentrações de 5mM e 10mM, respectivamente, e em presença dos íons Cu2+ (93,46%), Fe3+ (84,89%) e Zn2+ (56,07%), na concentração de 10mM.
O efeito dos surfactantes sobre a atividade proteásica foi avaliado e verificou-se que, com o aumento da concentração do surfactante, a atividade residual diminuiu. Esse efeito inibitório apenas não aconteceu com o SDS, o qual manteve atividade de aproximadamente 100%.
A redução da atividade residual da protease foi observada para os inibidores PMSF (44,39%), (-mercaptoetanol (52,18%) e EDTA (94,24%). A pepstatina A e o ácido iodoacético não apresentaram ação inibitória sobre a atividade proteásica. O perfil inibitório e a atividade com SApNA sugerem que a protease avaliada seja pertencente à classe das serino-proteases, pois o inibidor e o substrato utilizados caracterizam o mecanismo de ação da enzima.
DISCUSSÃO
A farinha de soja e o farelo de trigo já são conhecidamente utilizados para estimular a produção de proteases devido aos seus conteúdos proteicos e ao complexo conteúdo de nutrientes. Entretanto, no presente estudo, a produção de proteases por Mucor subtilissimus UCP 1262 foi mais acentuada nos cultivos em que se utilizou farinha de soja (77,0U/mL com 72 horas de cultivo) em comparação ao uso de farelo de trigo (64,3U/mL com 120 horas de cultivo) como fonte de nitrogênio. Resultados semelhantes foram encontrados por Palanivel et al. (2013PALANIVEL, P.; ASHOKKUMAR, L.; BALAGURUNATHAN, R. Production, purification and fibrinolytic characterization of alkaline protease from extremophilic soil fungi. Int. J. Pharm. Biol. Sci., v.4, p.101-110, 2013.). Tais autores avaliaram a produção de protease extracelular, e obtiveram valores de atividade proteásica de 80U/mL, 40U/mL e 35U/mL para os gêneros Aspergillus, Mucor e Curvularia, respectivamente, após 168 horas, com agitação de 220rpm, a 37ºC. Desse modo, com o fungo do mesmo gênero, o presente trabalho obteve quase o dobro da atividade em menos da metade do tempo de fermentação.
A produção da protease fibrinolítica no meio utilizando a farinha de soja como fonte de nitrogênio foi maior e obtida em um menor tempo de cultivo em comparação com a produção no meio onde foi utilizado o farelo de trigo como fonte de nitrogênio. Esse fato pode ser explicado pela alta concentração de proteínas presentes na farinha de soja. A farinha de soja é comumente utilizada como fonte de proteína em fermentações industriais para a produção de enzimas e antibióticos, uma vez que a produção de proteases pode ser induzida por peptideos presentes na farinha de soja (Silva et al., 2015SILVA, G.M.M.; BEZERRA, R.P.; TEIXEIRA J.A. et al., Fibrinolytic protease production by new Streptomyces sp. DPUA 1576 from Amazon lichens. Elect. J. Biotechnol., v.18, p.16-19, 2015.). Bajaj et al. (2014BAJAJ, B.K.; SINGH, S.; KHULLAR, M. et al. Optimization of fibrinolytic protease production from Bacillus subtilis I-2 using agro-residues. Braz. Arch. Biol. Technol. v.5, p.653-662, 2014.), ao avaliarem a otimização de uma protease fibrinolítica produzida por Bacillus subtilis I-2, apresentaram 280,2U/mg de atividade fibrinolítica em seu extrato bruto contendo soja, após 24 horas de cultivo sob agitação de 180rpm e a 37°C.
O grande potencial para produção de proteases pelo gênero Mucor já foi descrito na literatura inúmeras vezes, como Yegin et al. (2012YEGIN, S.; GOKSUNGUR, Y.; FERNANDEZ-LAHORE, M. Purification, structural characterization, and technological properties of an aspartyl proteinase from submerged cultures of Mucor mucedo DSM 809. Food Chem., v.133, p.1312-1319, 2012.), que usaram Mucor mucedo DSM 809 para produção de protease aspártica extracelular; Santos-Ribeiro et al. (2015), que produziram e caracterizaram protease de Mucor hiemalis URM3773; e Nascimento et al. (2015NASCIMENTO, T.P.; SALES, A.E.; PORTO, C.S. et al. Production and Characterization of New Fibrinolytic Protease from Mucor subtillissimus UCP 1262 in Solid-State Fermentation. Adv. Enzyme Res., v.3, p.81-91, 2015.), que obtiveram êxito ao utilizarem o Mucor subtilissimus UCP 1262 para produção de protease com atividade fibrinolítica em fermentações em estado sólido utilizando resíduos agroindustriais. Assim, os resultados dessa etapa reforçam o potencial desse gênero como produtor de protease fibrinolítica.
Subsequentemente, foi realizada a produção e extração integrada da protease fibrinolítica por Mucor subtilissimus UCP 1262. Apesar de alguns autores relatarem que a presença do polímero (PEG) pode desacelerar o crescimento das células microbianas, ou seja, quando ocorre a fase estacionária tardiamente e há possivelmente diminuição na produção de protease (Yasinok et al., 2010YASINOK, A.E.; BIRAN, S.; KOCABAS, A.; BAKIR, U. Xylanase from a soil isolate, Bacillus pumilus: gene isolation, enzyme production, purification, characterization and one-step separation by aqueous-two-phase system. World J. Microbiol. Biotechnol., v.26, p.1641-1652, 2010.), esse fenômeno não interferiu no desempenho de crescimento do Mucor subtilissimus UCP 1262, o qual manteve a produção da protease fibrinolítica no mesmo tempo que a fermentação homogênea (72 horas).
Ashipala e He (2008ASHIPALA, O.K.; HE, Q. Optimization of fibrinolytic enzyme production by Bacillus subtilis DC-2 in aqueous two-phase system (poly-ethylene glycol 4000 and sodium sulfate). Biol. Technol., v.99, p.4112-4119, 2008. ), ao verificarem a produção da protease fibrinolítica por Bacillus subtilis DC-2 em fermentação extrativa utilizando PEG e sulfato de sódio, apresentaram resultados semelhantes aos obtidos no presente trabalho. Os autores também relataram que o aumento da atividade foi atribuído a uma maior secreção da protease na presença de PEG. Embora o PEG seja necessário para a liberação da protease, sua presença em concentrações mais altas pode ser um fator limitante na produção, pois tal molécula restringe o crescimento do micro-organismo. A restrição do crescimento não foi observada no presente trabalho com Mucor subtilissimus UCP 1262
Os valores da variável resposta coeficiente de partição (K) indicam que a protease fibrinolítica apresentou maior afinidade pela fase superior do SDFA, rica em PEG. Apesar de as variáveis estudadas não terem apresentado efeitos estatisticamente significativos para o K, pode-se inferir que menores concentrações de sal favoreceram a migração da enzima para a fase inferior, principalmente associada à elevada massa molar do PEG na fase superior, ou seja, o fenômeno de exclusão pelo volume pode ser observado ao se analisarem os valores de coeficiente de partição.
Na eletroforese SDS-PAGE, observou-se que a banda referente à atividade fibrinolítica produzida por Mucor subtilissimus UCP 1262 na fermentação extrativa foi calculada como 52kDa. Tal massa está de acordo com o valor obtido de uma protease com atividade fibrinolítica de Asterina pectinifera (40 a 55kDa) (Choi et al., 2014CHOI, J.H; SAPKOTA, K.; KIM, S. et al. Starase: A bi-functional fibrinolytic protease from hepatic caeca of Asterina pectinifera displays antithrombotic potential. Biochem. p.1-13, 2014.) e da enzima fibrinolítica produzida por Petasites japonicus (50 a 70kDa) (Kim et al., 2015KIM, D.W.; CHOI, J.H.; PARK, S.E. et al. Purification and characterization of a fibrinolytic enzyme from Petasites japonicus. Int. J. Biol. Macromol., v.72, p.1159-116, 2015.).
Comparando-se o perfil eletroforético da fermentação homogênea e da fase sal da fermentação extrativa (Fig 2), observou-se uma diminuição do conteúdo proteico indicando que houve uma partição seletiva das biomoléculas produzidas pelo micro-organismo. Por meio do zimograma de fibrina, pode-se confirmar que a protease foi pré-purificada pela fermentação extrativa, apresentando-se ativa e com atividade fibrinolítica degradando o substrato até o peso molecular 52kDa correspondente à protease no gel SDS-PAGE.
A protease fibrinolítica obtida por fermentação extrativa de Mucor subtilissimus UCP 1262 apresentou especificidade semelhante à da enzima quimiotripsina. Majumdar et al. (2014MAJUMDAR, A.S.; SARMAH, A.B.; GOGOI A.D. et al. Characterization, mechanism of anticoagulant action, and assessment of therapeutic potential of a fibrinolytic serine protease (Brevithrombolase) purified from Brevibacillus brevis strain FF02B. Biochimie, v.103, p.1-11, 2014.) também comprovaram que a protease fibrinolítica obtida de Brevibacillus brevi FF02B possuía características semelhantes às da quimiotripsina, quando apresentou 14,3U/mg de atividade amidolítica ao se utilizar o substrato SApNA. Choi et al. (2011CHOI, D.; CHA, W.; PARK, N. et al. Purification and characterization of a novel fibrinolytic enzyme from fruiting bodies of Korean Cordyceps militaris. Bioresour. Technol., v.102, p.3279-3285, 2011. ), ao pesquisarem enzimas fibrinolíticas extraídas de estruturas de frutificação do Cordyceps militaris, também verificaram que a ação específica para o substrato N-succinil-Ala-Ala-Pro-Phe-pNA caracteriza-as como quimiotripsina.
A enzima fibrinolítica do Bacillus subtilis TKU007 apresentou pH ótimo de 8,0 e temperatura ótima de 40°C. A protease foi estável entre os pH 4,0 e 11,0, conservando sua atividade em temperaturas próximas a 50°C (Lu et al., 2010LU, C.; WANGY, J.; CHENZ, S. Protease purified from Schizophyllum commune culture broth digests fibrins without activating plasminogen. Am. J. Chin. Med., v.38, p.1223-1231, 2010.). Kim et al. (2015KIM, D.W.; CHOI, J.H.; PARK, S.E. et al. Purification and characterization of a fibrinolytic enzyme from Petasites japonicus. Int. J. Biol. Macromol., v.72, p.1159-116, 2015.), ao utilizarem uma protease fibrinolítica produzida por Petasites japonicus, apresentaram pH ótimo em torno de 7,0, sendo estável entre o pH 5,0 e o 8,0. Em relação à temperatura, conseguiram máxima eficiência com 60°C e estabilidade entre 30°C e 60°C. Tais características físico-químicas se assemelham às apresentadas pela protease fibrinolítica produzida por Mucor subtilissimus UCP 1262 por meio de fermentação extrativa.
CONCLUSÃO
Considerando as potenciais aplicações de proteases fibrinolíticas no tratamento de doenças trombolíticas, foram obtidos resultados promissores com a produção e extração integrada de protease fibrinolítica por Mucor subtilissimus UCP 1262. É possível produzir enzima fibrinolítica em um processo de baixo custo e de considerável rapidez quando comparado a outras técnicas de produção e purificação isoladas. A protease fibrinolítica é ativa e estável em pH e temperatura fisiológicos.
AGRADECIMENTOS
Os autores agradecem o financiamento, pois o presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) (Processos n° 23038.003634/2013-15 e 88881062200/2014-01) e do Conselho nacional de Desenvolvimento Científico e Tecnológico (CNPq) (471773/2013-1) e a bolsa de mestrado da Fundação de Amparo à Ciência e Tecnologia de Pernambuco (FACEPE) (IBPG 1511-2.08/13).
REFERÊNCIAS
- ASHIPALA, O.K.; HE, Q. Optimization of fibrinolytic enzyme production by Bacillus subtilis DC-2 in aqueous two-phase system (poly-ethylene glycol 4000 and sodium sulfate). Biol. Technol., v.99, p.4112-4119, 2008.
- BAJAJ, B.K.; SINGH, S.; KHULLAR, M. et al. Optimization of fibrinolytic protease production from Bacillus subtilis I-2 using agro-residues. Braz. Arch. Biol. Technol. v.5, p.653-662, 2014.
- BRADFORD, M.M. A rapid and sensitive method for the quantification of protein utilizing the principle of protein-dye binding. Anal. Biochem., v.72, p.148-254, 1976.
- CHAVEZ-SANTOSCOY, A.; BENAVIDES, J.; VERMAAS, W.; RITO-PALOMARES, M. Application of aqueous two-phase systems for the potential extractive fermentation of cyanobacterial products. Chem. Eng. Technol., v.33, p.177-182, 2010.
- CHOI, D.; CHA, W.; PARK, N. et al. Purification and characterization of a novel fibrinolytic enzyme from fruiting bodies of Korean Cordyceps militaris. Bioresour. Technol., v.102, p.3279-3285, 2011.
- CHOI, J.H; SAPKOTA, K.; KIM, S. et al. Starase: A bi-functional fibrinolytic protease from hepatic caeca of Asterina pectinifera displays antithrombotic potential. Biochem. p.1-13, 2014.
- CHONG, A.S.C.; HASHIM, R.; CHOW-YANG, L.; ALI, A.B. Partial characterization and activities of proteases from the digestive tract of discus fish (Symphysodon aequifasciata). Aquaculture, v.203, p.321-333, 2002.
- CHOUYYOK, W.; WONGMONGKOL, N.; SIWARUNGSON, N.; PRICHANONT, S. Extraction of alkaline protease using an aqueous two-phase system from cell free Bacillus subtilis TISTR 25 fermentation broth. Process Biochem., v.40, p.3514-3518, 2005.
- DEEPAK, V.; ILANGOVAN, S.; SAMPATHKUMAR, M.V. et al. Medium optimization and immobilization of purified fibrinolytic URAK from Bacillus cereus NK1 on PHB nanoparticles. Enzyme Microbiol. Technol., v.47, p.297-304, 2010.
- GINTHER, C.L. Sporulation and the production of serine protease and cephamycin C by Streptomyces lactamdurans. Antimicrobiol. Agents Chemother., v.15, p.522-526, 1979.
- KIM, D.W.; CHOI, J.H.; PARK, S.E. et al. Purification and characterization of a fibrinolytic enzyme from Petasites japonicus. Int. J. Biol. Macromol., v.72, p.1159-116, 2015.
- KIM, W.; CHOI, K.; KIM, Y. et al. Purification and characterization of a fibrinolytic enzyme produced from Bacillus sp. strain CK 11-4 screened from chungkook-jang. Appl. Environ. Microbiol., v.62, p.2482-2488, 1996.
- LAEMMLI, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, v.227, p.680-685, 1970.
- LU, C.; WANGY, J.; CHENZ, S. Protease purified from Schizophyllum commune culture broth digests fibrins without activating plasminogen. Am. J. Chin. Med., v.38, p.1223-1231, 2010.
- MAJUMDAR, A.S.; SARMAH, A.B.; GOGOI A.D. et al. Characterization, mechanism of anticoagulant action, and assessment of therapeutic potential of a fibrinolytic serine protease (Brevithrombolase) purified from Brevibacillus brevis strain FF02B. Biochimie, v.103, p.1-11, 2014.
- MEDEIROS, G.M.S.; MARQUES, D.A.V.; PORTO, T.S. et al. Extraction of fibrinolytic proteases from Streptomyces sp. DPUA1576 using PEG-phosphate aqueous two-phase systems. Fluid Phase Equilib., v.339, p.52-57, 2013.
- NALINANON, S.; BENJAKUL, S.; VISESSANGUAN, W.; KISHIMURA, H. Partitioning of protease from stomach of albacore tuna (Thunnusalalunga) by aqueous two-phase systems. Process Biochem., v.44, p.471-476, 2009.
- NASCIMENTO, T.P.; SALES, A.E.; PORTO, C.S. et al. Production and Characterization of New Fibrinolytic Protease from Mucor subtillissimus UCP 1262 in Solid-State Fermentation. Adv. Enzyme Res., v.3, p.81-91, 2015.
- PALANIVEL, P.; ASHOKKUMAR, L.; BALAGURUNATHAN, R. Production, purification and fibrinolytic characterization of alkaline protease from extremophilic soil fungi. Int. J. Pharm. Biol. Sci., v.4, p.101-110, 2013.
- PORTO, A.L.F.; CAMPOS-TAKAKI, G.M.; LIMA FILHO, J.L. Effects of culture conditions on protease production by Streptomyces clavuligerus growing on the soy bean flour medium. Appl. Biochem. Biotechnol., v.60, p.115-122, 1996.
- SANTOS-RIBEIRO, R.C.; RIBEIRO, T.R.S.; SOUZA-MOTTA, C.M. et al. Production and partial characterization of proteases from Mucor hiemalis URM3773. Acta Sci., v.37, p.71-79, 2015.
- SILVA, G.M.M.; BEZERRA, R.P.; TEIXEIRA J.A. et al., Fibrinolytic protease production by new Streptomyces sp. DPUA 1576 from Amazon lichens. Elect. J. Biotechnol., v.18, p.16-19, 2015.
- STATISTICA data analysis software systems. Version 8.0. Tulsa: Statsoft, 2008.
- TIAN, C.H.; SHOW, P.L.; OOI, C.W. et al. Novel lipase purification methods - a review of the latest developments. Biotechnol. J., v.10, p.31-44, 2015.
- WANG, S.; WU, Y.; LIANG, T. Purification and biochemical characterization of a nattokinase by conversion of shrimp shell with Bacillus subtilis TKU007. N. Biotechnol., v.28, p.196-202, 2011.
- YASINOK, A.E.; BIRAN, S.; KOCABAS, A.; BAKIR, U. Xylanase from a soil isolate, Bacillus pumilus: gene isolation, enzyme production, purification, characterization and one-step separation by aqueous-two-phase system. World J. Microbiol. Biotechnol., v.26, p.1641-1652, 2010.
- YEGIN, S.; GOKSUNGUR, Y.; FERNANDEZ-LAHORE, M. Purification, structural characterization, and technological properties of an aspartyl proteinase from submerged cultures of Mucor mucedo DSM 809. Food Chem., v.133, p.1312-1319, 2012.
Datas de Publicação
-
Publicação nesta coleção
06 Jun 2019 -
Data do Fascículo
Mar-Apr 2019
Histórico
-
Recebido
06 Out 2016 -
Aceito
13 Ago 2018