Resumos
A bactéria Streptococcus agalactiae é um potente agente causador de surtos por doenças bacterianas em peixes. O estresse provocado pelo manejo zootécnico e pela má qualidade ambiental torna a tilápia susceptível às infecções por essa bactéria. O objetivo do presente trabalho foi avaliar a resistência de tilápias-do-nilo imunizadas com soro hiperimune anti-S. agalactiae, posteriormente desafiadas com cepa homóloga da mesma bactéria. Após determinação da DL 50 de S. agalactiae, 36 tilápias foram distribuídas em quatro aquários, dois para o grupo controle e dois para inoculação celomática para produção de anticorpos anti-S. agalactiae. No 21° e 28° dias, foi coletado sangue para obtenção de soro hiperimune utilizado na transferência passiva. Em seguida, 30 tilápias foram distribuídas em três aquários e submetidas a três tratamentos: GI: controle; GII: imunizadas com o soro inativado; GIII: imunizadas com soro ativo. Após 48 horas e sete, 14, 21, 28 e 35 dias, foram realizadas coletas de sangue para titulação de anticorpos anti-S. agalactiae utilizando-se o teste de aglutinação direta. Para avaliar a taxa de sobrevivência, outras 30 tilápias foram distribuídas em três aquários e submetidas a três tratamentos (GI: controle; GII: imunizadas com soro inativado; GIII: imunizadas com soro ativo). Após 48 horas da imunização, as tilápias foram desafiadas via celomática com 100µL de S. agalactiae e avaliadas duas vezes ao dia, pelo período de 35 dias. Os resultados dos títulos séricos de anticorpos foram detectados pela aglutinação direta até o 21° dia pós-transferência passiva, e, no mesmo período, houve proteção de 80% entre os grupos imunizados com soro inativado e soro ativo contendo anticorpos anti-S. agalactiae. Ao final, os grupos soro inativado e soro ativo apresentaram 60 e 80% de proteção, respectivamente, enquanto no grupo controle 100% dos peixes adoeceram, apresentando sinais graves da infecção, e foram eutanasiados. Não houve diferença estatística significativa na taxa de proteção entre os grupos imunizados.
estreptococose; imunidade; peixes; imunoglobulina; soro
The Streptococcus agalactiae bacteria is a potent agent which causes outbreaks of bacterial diseases in fish. The stress caused by management and poor environmental quality makes tilapia susceptible to infections, including by bacterium. The aim of this study was to evaluate the resistance of the Nile tilapia immunized with hyperimmune serum against S. agalactiae subsequently challenged with homologous strain of the same bacteria. After determining the DL 50 of S. agalactiae, 36 tilapias were distributed in 4 aquariums, 2 for the control group and 2 for the group via coelomic, inoculated with the DL 50 for anti-S. agalactiae antibodies production. On the 21st and 28th day blood was collected for the obtainment of hiperimmune serum used in passive transference. Then, 30 tilapias were distributed in 3 aquariums submitted to 3 treatments (GI: control; GII: immunized with inactivated-serum; GIII: immunized with non-inactivated serum). After 48 hours, 7, 14, 21, 28 and 35 days blood collections were done for anti-S. agalactiae antibodies titration using the direct agglutination test. For survival evaluation 30 tilapias were distributed in 3 aquariums and submitted to 3 treatments (GI: control; GII: immunized with inactivated-serum; GIII: immunized with non-inactivated serum). After 48 hours of inoculation tilapias were challenged with 100µL of S. agalactiae and monitored twice a day for 35 days. The results showed that titers of antibodies were detected by direct agglutination until the 21st day after passive transference and during the same period the protection between the groups immunized with inactivated serum and non-inactivated serum contending anti-S. agalactiae antibodies was of 80% after challenge with S. agalactiae. In the end, the serum-inactivated serum and active groups had 60 and 80% protection, respectively, while 100% of the fish in the control group developed severe signs of infection and were euthanized. There was no statistical difference in the survival rate between the immunized groups.
streptococcosis; immunity; fishes; immunoglobulin; serum
INTRODUÇÃO
Entre as enfermidades que acometem a produção pesqueira, as bacterioses estão entre as de maior potencial de risco; entre as bacterioses, o Streptococcus agalactiae é considerado um importante agente causador de enfermidade microbiana em peixes (Evans et al., 2002EVANS, J.J.; KLESIUS, P.H.; GILBERT, P.M. et al. Characterization of b-haemolytic group B Streptococcus agalactiae in cultured seabream, Sparus auratus L., and wild mullet, Liza klunzingeri in Kuwait. J. Fish Dis., v.25, p.505-513, 2002.). O S. agalactiae é um patógeno cosmopolita que provoca surtos infecciosos com altas taxas de morbidade e mortalidade, especialmente na tilapicultura (Evans et al., 2004).
A mortalidade em criação de cativeiro atinge taxas de até 90% na idade pré-comercialização, quando volumes substanciais de ração já foram consumidos (Abuseliana et al., 2010ABUSELIANA, A.; HASSAN, D.; SALEHA, A.A. et al. Streptococcus agalactiae the etiological agent of mass mortality in farmed red tilapia (Oreochromis sp.). J. Anim. Vet. Adv., v.20, p.2640-2646, 2010.; Zamri-Saad et al., 2010ZAMRI-SAAD, M.; AMAL, M.N.A.; SITI-ZAHRAH, A. Pathological changes in red tilapias (Oreochromis spp.) naturally infected by Streptococcus agalactiae. J. Comp. Pathol., v.143, p.227-229, 2010.). Mundialmente, estima-se que as perdas anuais por estreptococose sejam de aproximadamente 150 milhões de dólares (Shoemaker e Klesius, 1997SHOEMAKER, C.; KLESIUS, P. Streptococcal disease problems and control: a review. Tilapia Aquac., v.2, p.671-680, 1997.).
Além das perdas econômicas na piscicultura, a bactéria S. agalactiae apresenta o potencial de infectar mamíferos, humanos e aves, representando um risco para o setor de saúde pública. Em neonatos humanos, o S. agalactiae é o principal agente etiológico de septicemia, com evolução para quadros de meningite bacteriana e, consequentemente, com uma taxa de mortalidade elevada, podendo progredir para outros quadros clínicos, como endocardite, pneumonia, infecções tegumentares, ósseas e oculares, em adultos e crianças (Domelier et al., 2008DOMELIER, A.S.; MEE-MARQUET, N.V.D.; ARNAULT, L. et al. Molecular characterizantion of erythromycin-resistant Streptococcus agalactiae strains. J. Antimicrob. Chemother., v.62, p.1227-1233, 2008. ).
Existem atualmente duas alternativas para o tratamento de infecções microbianas em peixes. O profilático pode ser feito com o uso de vacinas ativas, bacterinas ou compostas de proteínas de membrana citoplasmática de células bacterianas (Sarder et al., 2001SARDER, R.M.I.; THOMPSONA, K.D.; PENMANA, D.J.; MCANDREWA, B.J. Immune responses of Nile tilapia (Oreochromis niloticus) clones: I. Non-specific response. Develop. Comp. Immunol., v.25, p.37-46, 2001.). Entretanto o manejo vacinal, além de gerar custos de produção, como alvenaria, equipamento e mão de obra, gera estresse nos peixes, respondendo com o aumento da concentração plasmática de cortisol, que resulta na depressão do sistema imune e na baixa resposta vacinal (Van-Deberg 2004VAN-DENBERG, G.W. Oral vaccines for finfish: Academic theory or commercial reality? Anim. Health Res. Rev., v.52, p.301- 304, 2004.; Santos et al., 2005SANTOS, Y.; GARCIA-MARQUEZ, S.; PERERIA, P.G. et al. Efficacy of futunculosis vaccines in turbot, Scophthalmus maximus. Evaluation of immersion, oral and injection delivery. J. Fish Dis., v.28, p.165-172, 2005.; Lim e Webster, 2006LIM, C.; WEBSTER, C.D. Tilapia: biology, culture and nutrition. New York: Haworth Press, 2006. p.678.).
Os antibióticos são utilizados no tratamento de infecções em peixes, porém seu uso indiscriminado favorece a seleção de bactérias resistentes, acarreta impacto ambiental significante e pode deixar resíduos nos alimentos destinados ao consumo humano (Hölmstrom et al., 2003). A imunização passiva se torna uma alternativa ao uso de antibióticos por meio da transferência do soro de peixes imunizados para animais susceptíveis, representando uma hipótese interessante no controle de surtos da doença (Zeitlin et al., 2000).
Quanto à imunização passiva de tilápia-do-nilo, são escassas as informações. Esse fato justifica o presente trabalho, que teve como objetivo avaliar a proteção conferida pela transferência passiva de anticorpos anti-S. agalactiae via soro hiperimune em tilápia-do-nilo desafiadas com S. agalactiae.
MATERIAL E MÉTODOS
Este estudo foi aprovado pela Comissão de Ética no Uso de Animais - CEUA Unesp - FCAV, registrada sob o número 011687/12, e foi realizado no Laboratório de Imunologia de Peixes na Universidade Estadual do Norte do Paraná/UENP, localizado em Bandeirantes-PR, Brasil. Os peixes foram adquiridos de empresa privada e submetidos à quarentena em caixas de fibra de vidro de 500L de água e com taxa de renovação de 2L por minuto, pelo período de 40 dias. Posteriormente, os peixes foram transportados e mantidos em aclimatação por sete dias e em laboratório dotado de infraestrutura de biossegurança para descontaminação da água e do material utilizado nos procedimentos de infecção experimental.
Foram utilizadas no total 126 tilápias-do-nilo Oreochromis niloticus (100±10g), provenientes da mesma desova. Os peixes foram alimentados duas vezes ao dia, com ração extrusada comercial (30% de PB), na proporção de 3% da biomassa conforme Furuya et al. (2001)FURUYA, W.M.; PEZZATO, L.E.; PEZZATO A.C. et al. Coeficientes de Digestibilidade e Valores de Aminoácidos Digestíveis de Alguns Ingredientes para Tilápia-do-nilo (Oreochromis niloticus). Rev. Bras. Zootec., v.30, p.1143-1129, 2001. e Gonçalves (2003).
Os peixes foram acondicionados em caixas de 500L, abastecidas com água de poço artesiano livre de cloro, fluxo contínuo com vazão de 2L/minuto e aeração suplementar. Diariamente a matéria orgânica foi eliminada por sifonagem. A aferição da qualidade da água demonstrou valores dentro da faixa de conforto dos peixes (Boyd, 1990BOYD, C.E. Water quality in ponds for aquaculture. Alabama: Auburn University, Alabama Agricultural Experiment Station, 1990.; Castagnolli e Pinto, 1992CASTAGNOLLI, N.; PINTO, M.L.G. Piscicultura. 3.ed. Jaboticabal: Funep Press, 1992.) (od = 5.3±0.5mg/L, to = 28±0.9°C, pH = 6.8± 0.4, nitritos = 0.30mg/L e amônia = 0.04 mg/L).
Os peixes foram anestesiados com solução aquosa de óleo de cravo na proporção de 3,0mL/10L de água. Inicialmente, 1mL da solução concentrada de óleo de cravo foi diluída em 10mL de álcool 70ºGL. Dessa diluição, foram adicionados 3mL em um recipiente com 10L de água (Delbon, 2006DELBON, M.C. Ação da benzocaína e do óleo de cravo sobre parâmetros fisiológicos de tilápia, Oreochromis niloticus. 2006. 91f. Dissertação (Mestrado em Aquicultura) - Curso de Pós-graduação em Aquicultura, Universidade Estadual Paulista Júlio de Mesquita Filho, Jaboticabal, SP.), onde os peixes foram alocados e considerados anestesiados quando estivessem quase imóveis, com diminuição dos movimentos operculares. As amostras de sangue foram coletadas da veia caudal e centrifugadas a 2000g, por cinco minutos, e o soro obtido foi mantido à temperatura de - 40C até o momento de sua utilização.
Para a determinação da DL 50 de S. agalactiae, foi utilizada amostra de S. agalactiae isolada de tilápias infectadas naturalmente e identificadas segundo as características culturais, morfológicas, tintoriais e bioquímicas (Vandamme et al., 1997VANDAMME, P.; DEVRIESE, L.A.; POT, B. et al. Streptococcus difficileis a nonhemolytic Group B, tipe Ib Streptococcus. Int. J. Syst. Bacteriol., v.47, p.81-85, 1997.; Salvador et al., 2005SALVADOR, R.; MULLER, E.E.; FREITAS, J.C. et al. Isolation and characterization of group B Streptococcus spp. from Nile tilapia (Oreochromis niloticus) breeding in hapas nets and in earth nurseries in the north region of Parana State, Brazil. Ciênc. Rural, v.35, p.1374-1378, 2005.). A cepa de S. agalactiae foi semeada em 500mL de caldo BHI (Brain Heart Infusion - DIFICO(r) - BD - EUA) e incubada por cinco dias, a 29°C, em aerofilia. Após centrifugação a 4000gna, temperatura de 4°C durante 20 minutos, o sobrenadante foi desprezado e a massa bacteriana ressuspendida em 500mL de PBS e novamente centrifugada. Essa operação foi realizada por mais três vezes, e a massa bacteriana obtida foi diluída em PBS, de modo a conter 104, 106 e 108 UFC/mL, correspondente aos graus quatro, seis e oito da escala de MacFarland. Foram utilizados 30 peixes, distribuídos ao acaso em três aquários contendo 10 peixes cada. Os peixes dos aquários um, dois e três foram inoculados no celoma com as concentrações 104, 106 e 108 UFC/mL de S. agalactiae, respectivamente, e a DL 50 foi determinada após observação por 15 dias (Salvador et al., 2005).
Foram utilizados 36 peixes distribuídos aleatoriamente em quatro aquários contendo nove peixes cada. Os peixes do controle foram mantidos em dois aquários e inoculados no celoma com 0,5mL de PBS 0,15M, pH 7,2 estéril. Os peixes produtores de soro foram inoculados no celoma com 0,5mL de PBS contendo 1 x 108 UFC/mL (referente a DL50) de S. agalactiae inativado por calor à temperatura de 40ºC durante 30 minutos em banho-maria. Previamente à primeira inoculação foi coletado sangue de todos os peixes. Os peixes dos grupos teste foram inoculados duas vezes, com intervalo de 14 dias, e o sangue coletado no 21° e 28° dias. As amostras de soro obtidas foram tituladas individualmente e reunidas em pool, e então formaram-se duas alíquotas, uma de soro inativado a 47°C durante 30 minutos em banho-maria para inativação do complemento e outra de soro ativo. Essas alíquotas foram mantidas à temperatura de -4°C até o momento de sua utilização.
O título de imunoglobulinas M nas amostras de soro foi determinado pela técnica de aglutinação direta de S. agalactiae na presença de anticorpos específicos no soro, de acordo com Fernandes et al. (2015)FERNANDES, D.C.; ETO, S.F.; CLAUDIANO, G.S. et al. Humoral immune response of Oreochromis niloticus: modified direct agglutination test. Comp. Clin. Pathol., v.24, p.617-623, 2015.. Amostras de soro inativadas a 47°C durante 30 minutos foram depositadas em placas de microtitulação de 12 poços com fundo em U. Em todos os poços foram adicionados 25μL de PBS e, no primeiro poço, 25μL de soro inativado. Após a homogeneização da solução, foram transferidos 25μL para o poço seguinte, sendo repetido este processo até o 11° poço, e então desprezou-se o mesmo volume da solução. Em seguida, foi adicionado volume igual de antígeno bacteriano inativado de S. agalactiae em cada poço; a placa foi mantida inicialmente em estufa a 37°C por uma hora e, a seguir, a 4°C por 22 horas. A leitura visual das placas foi realizada comparando-se o padrão de sedimentação do poço controle (12° poço), contendo apenas PBS e antígeno bacteriano de S. agalactiae, com os padrões de sedimentação dos demais poços. O título de anticorpos totais foi identificado como a maior diluição em que se observou reação de aglutinação. O resultado da titulação foi expresso em números decimais após o cálculo do logaritmo base dois (Log2) dos títulos. Esse procedimento foi realizado em todas as amostras de soro analisadas neste trabalho.
Foram utilizados 30 peixes, distribuídos ao acaso em três aquários contendo 10 peixes cada. Cada peixe do grupo I (controle) foi inoculado com 100µL PBS 0,15M, pH 7,2 estéril, via celomática; do grupo II, com 100µL do pool de soro inativado, via celomática; do grupo III, com 100µL do pool de soro ativo, via celomática. Antes da imunização passiva, foram coletadas amostras de sangue de cada peixe dos três grupos para se avaliar a titulação de anticorpos anti-S. agalactiae. Foram realizadas coletas de sangue de todos os peixes dos três grupos 48 horas e sete, 14, 21, 28 e 35 dias após a inoculação. A titulação dos anticorpos séricos foi realizada em cada amostra de soro pelo método de aglutinação direta.
Foram utilizados 30 peixes, distribuídos ao acaso em três aquários contendo 10 peixes cada e submetidos ao mesmo tratamento do experimento anterior, sendo o grupo I (controle) inoculado via celomática com 100µL PSB 0,15M, pH 7,2 estéril; o grupo II com 100µL do pool de soro inativado; e o grupo III com 100µL do pool de soro ativo. Após 48 horas da inoculação, os 30 peixes foram desafiados por via celomática com a DL50 (1 x 108 UFC/mL de S. agalactiae). Os grupos foram observados diariamente, no período da manhã e da tarde, acompanhando-se os sinais clínicos. Os peixes que apresentaram sinais graves de estreptococose foram submetidos à eutanásia pelo aprofundamento do plano anestésico anteriormente descrito. Todos os peixes mortos foram necropsiados para avaliação de lesões macroscópicas e isolamento e identificação de S. agalactiae do cérebro, baço e rim cefálico.
Para análise estatística, foi empregado o software GraphPadPrim com teste qui- quadrado e Graph Prisma para análise de variância (ANOVA) seguida do teste de Tukey a 5% de probabilidade.
RESULTADOS
Nos peixes inoculados com S. agalactiae para a produção de soro hiperimune, foram detectados títulos médios (Log2) de anticorpos nas amostras de soro, coletado no 21° e no 28° dia, de 1,44 e 2,39, respectivamente (Fig. 1).
Média dos títulos séricos (Log2) de anticorpos anti-Streptococcus agalactiae produzidos em tilápias-do-nilo (Oreochromis niloticus) após duas inoculações com 14 dias de intervalo da DL50 (1 x 108 UFC/mL) de S. agalactiae.
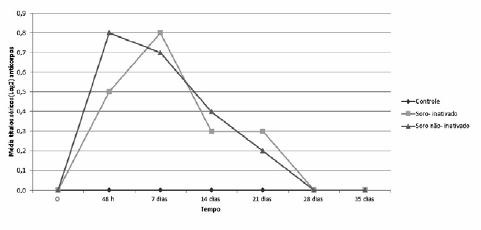
Após a inoculação de anticorpos anti-S. agalactiae, a maior média de títulos de anticorpos nos peixes do grupo II (soro inativado) foi detectada na coleta realizada no 7° dia, e no grupo III (soro ativo) na coleta com 48 horas. No grupo II, foi detectada, aos 14 dias, a diminuição da média do título de anticorpos, que se manteve igual no 21° dia, enquanto no grupo III a diminuição da média do título de anticorpos ocorreu no sétimo dia, diminuindo gradativamente no 14° e 21° dias. Em ambos os grupos, os títulos de anticorpos foram detectados somente até o 21° dia pós-inoculação (Fig. 2).
Média dos títulos séricos (Log2) de anticorpos anti-Streptococcus agalactiae em tilápias-do- nilo (Oreochromis niloticus), inoculadas com soro inativado e soro não inativado contendo anticorpos anti-S. agalactiae.
Na avaliação da sobrevivência após desafio bacteriano, o grupo I (controle) apresentou 100% de peixes doentes, que foram submetidos à eutanásia no 10° dia de experimento. Nos grupos II e III, no 21° dia de experimento, a porcentagem relativa de sobrevivência (PRS) foi de 80%, e, ao final do experimento, com 35 dias, o grau de proteção foi de 40% no grupo II e 70% no grupo III (Fig. 3). Os peixes sobreviventes não apresentaram sinais clínicos da enfermidade. Não houve diferença estatística significativa (P<0,05) entre os grupos II e III, mas ambos diferiram (P<0,05) do grupo I (controle).
Porcentagem relativa de sobrevivência em tilápias-do-nilo (Oreochromis niloticus) inoculadas com soro inativado e soro não inativado contendo anticorpos anti-Streptococcus agalactiae e desafiadas 48 horas após com DL50 (1 x 108 UFC/mL) de S. agalactiae.
DISCUSSÃO
O sistema imune dos peixes foi capaz de reconhecer e produzir anticorpos específicos para antígenos de S. agalactiae. O padrão da resposta imune humoral obteve o maior pico de produção de anticorpos no 21° e 28° dias após a segunda inoculação com intervalo de 14 dias entre a primeira dose. Fernandes et al. (2015) compararam o efeito da dose única e da dose reforço com intervalos de 14 dias entre as doses, na cinética da produção de anticorpos específicos para hemácia de carneiro em tilápias. Os resultados foram semelhantes, com dois picos de produção de anticorpos também no 21° e 28° dias. Shelby et al. (2002)SHELBY, R.A.; KLESIUS, P.H.; SHOEMAKER, C.H.; EVANS, J.J. Passive immunization of tilapia, Oreochromis niloticus (L.), with anti-Streptococcus iniae whole sera. J. Fish Dis., v.25, p.1-6, 2002. inocularam células bacterianas virulentas de S. iniae e também obtiveram, ao 28° dia pós-inoculação, a maior média do título de anticorpos em tilápias.
A farmacocinética da imunoglobulina anti-S. agalactiae foi monitorada por meio da meia-vida plasmática no soro dos peixes receptores. Os grupos inoculados com soro inativado e com soro ativo não apresentaram diferenças significativas (P<0,05) entre as médias de títulos de anticorpos, pela prova de aglutinação direta, nas coletas realizadas 48 horas e sete dias pós-inoculação. Entretanto, nas coletas após 14 e 21 dias, houve diferença significativa (P<0,05) quando comparadas aos tempos anteriores, tanto para o grupo inoculado com soro inativado quanto para o grupo inoculado com soro ativo. Por fim, ambos os grupos imunizados apresentaram títulos séricos de anticorpos específicos e consequentemente protetores de anticorpos.
Na literatura, não há dados sobre o acompanhamento de títulos de anticorpos produzidos e transferidos passivamente em peixes. Entretanto, Akhlaghi et al. (1996)AKHLAGHI, M.; MUNDAY, B.; WHITTINGTON, R. Comparasion of passive and active immunization of fish against streptococcosis (enterococcosis). J. Fish. Dis., v.19, p.251-258, 1996., após produzirem anticorpos anti-Streptococcus spp. em ovelhas e coelhos e inocularem em peixes, detectaram, pelo ELISA, aumento dos títulos séricos de anticorpos 24 horas após a inoculação e significativa diminuição após 30 dias, e títulos mais baixos foram detectados até 90 dias. É provável que a detecção de anticorpos por esse longo período tenha sido possível pelo alto limiar de detecção do ELISA, quando comparado com a aglutinação direta.
Na avaliação da taxa de sobrevivência, o grupo I (controle) apresentou taxa 0% de sobrevivência. Todos os peixes adoeceram e foram submetidos à eutanásia até o 10° dia após o desafio. Em contrapartida, o potencial de proteção dos anticorpos foi observado nos grupos II e III no 24° dia após infecção, com taxas de sobrevivência correspondendo a 80% em ambos os grupos. Durante os períodos posteriores da análise, entre o 25° e o 28° dia a taxa de proteção do grupo II reduziu-se para 60%, e para 40% no final do experimento, no 33° dia, enquanto o grupo III obteve redução de 70% na proteção no mesmo período de tempo.
A redução progressiva da taxa de proteção dos anticorpos tem relação com duas variáveis interdependentes. A primeira está relacionada ao fator dose-resposta observado na curva de meia-vida plasmática, sendo a redução progressiva dos títulos de anticorpos relacionada diretamente com a redução da taxa de sobrevivência e, consequentemente, com o potencial protetor. A segunda variável relaciona-se à regência da interação entre o sistema complemento em sua ação direta, por meio da molécula C3b, ou indireta, mediante a ativação da via clássica do complemento pela ligação entre a molécula C1q e a fração constante da IgM do peixe (Costa et al., 2006COSTA, F.; ELLIS, A.E.; VIVAS, J. et al. Complement consumption by Photobacterium damselae subsp. piscicida in seabream, red porgy and seabass normal and imune serum. Effect of the capsule on the bactericidal effect. Fish Shellfish Immunol., v.20, p.709-717, 2006.).
Neste trabalho, a análise dos resultados da titulação de anticorpos (Fig. 2) e a porcentagem relativa de sobrevivência (Fig. 3) demonstraram que, nos grupos soro inativado e soro ativo, há relação direta entre a diminuição dos títulos de anticorpos transferidos passivamente e a diminuição da taxa de sobrevivência, entretanto não houve diferença significativa na taxa de sobrevivência entre os grupos inoculados com soro inativado e com soro ativo. Esse fato sugere que anticorpos específicos contra S. agalactiae foram importantes para a proteção dos peixes imunizados passivamente e que o complemento presente no soro não inativado não implicou proteção extra.
Shelby et al. (2002) imunizaram passivamente tilápias via celomática com soro anti-S. iniae inativado e com soro anti-S. iniae ativo e o desafiaram via i.p. com S. iniae virulento após 48 horas. Esses autores observaram que não houve diferença significativa entre a taxa de mortalidade observada no grupo soro anti-S. iniae inativado (3,3%) e no grupo soro ativo (0,0%), concluindo que o complemento ou as citocinas presentes no soro não inativado não foram responsáveis pela proteção contra o S. iniae.
A imunização passiva apresenta proteção imediata, pois as imunoglobulinas são inoculadas diretamente no peixe, enquanto a vacina ativa exige um tempo mínimo de resposta de 21 a 28 dias após a inoculação do antígeno para a formação de anticorpos pelo sistema imune do teleósteo (Fernandes et al., 2015). Esses dados apontam a possibilidade da utilização profilática do soro hiperimune contra S. agalactiae na proteção imediata em casos de surto dessa enfermidade bacteriana em tilápia-do-nilo.
Além disso, o uso de antibiótico na água ou na ração representa não só riscos na geração de resistência microbiana, afetando organismos aquáticos, mamíferos, aves e humanos, como também prejuízos ao ambiente (Martins et al., 2006MARTINS, M. L.; MORAES, F. R.; FUJIMOTO, R. Y. et al. Carrageenin induced inflammation in Piaractus mesopotamicus (Osteichthues: Characidae) cultured in Brazil. Bol. Inst. Pesca, v.32, p.31-39, 2006.). A oxitetraciclina é um dos antibióticos usados para o tratamento de bacterioses em peixes, entretanto dois genes de resistência, tet (M) e tet (S), foram encontrados em 151 isolados bacterianos intestinais de peixes marinhos criados no Japão e na Coreia. Entre os isolados, encontraram-se Vibrio sp., S. agalactiae, Lactococcus garvieae, Photobacterium damselae subsp. piscicida e outras bactérias Gram-negativas não identificadas (Kim et al., 2004KIM, S.R.; NONAKA, L.; SUZUKI, S. Occurrence of tetracycline resistance genes tet(M) and tet (S) in bacteria from marine aquaculture sites. Fems Microbiol. Lett., v.237, p.147-156, 2004.).
Na Polônia, amostras isoladas do material biológico humano, positivas para S. agalactiae do grupo B, apresentaram a porcentagem de resistência à eritromicina (18,4%) e à tetraciclina (91,2%) dos sorotipos analisados (Domelier et al., 2008). No Brasil, foram isoladas colônias de S. agalactiae, por meio de swab, vacinal e perianal de pacientes grávidas. Os resultados demonstraram que 32 das amostras eram resistentes a penicilina, cefotaxima, ofloxacina, cloranfenicol, vancomicina e meropenem. A resistência à eritromicina e à clindamicina foi de 9,4 e 6,2%, respectivamente (Borges et al., 2009BORGES, C.H.F.; ALMEIDA, D.A.; FRAGIORGE, E.J. Atividade antibacteriana e antifúngica de diferentes concentrações de extrato hidroalcoólicos de própolis em linguiça frescal suína. FAZU Rev., v.6, p.52-86, 2009.).
Dessa forma, a transferência passiva de anticorpos representa uma alternativa promissora no tratamento de enfermidades bacterianas em organismos aquáticos, graças à sua especificidade e à ausência de efeito residual na água, no predador ou no consumidor humano. Isso substitui o uso de antibióticos na água, o que, consequentemente, reduz a resistência microbiana, proporciona proteção imediata em surtos isolados ou em grande escala e minimiza perdas econômicas no setor aquícola.
- ABUSELIANA, A.; HASSAN, D.; SALEHA, A.A. et al. Streptococcus agalactiae the etiological agent of mass mortality in farmed red tilapia (Oreochromis sp.). J. Anim. Vet. Adv., v.20, p.2640-2646, 2010.
- AKHLAGHI, M.; MUNDAY, B.; WHITTINGTON, R. Comparasion of passive and active immunization of fish against streptococcosis (enterococcosis). J. Fish. Dis., v.19, p.251-258, 1996.
- BORGES, C.H.F.; ALMEIDA, D.A.; FRAGIORGE, E.J. Atividade antibacteriana e antifúngica de diferentes concentrações de extrato hidroalcoólicos de própolis em linguiça frescal suína. FAZU Rev., v.6, p.52-86, 2009.
- BOYD, C.E. Water quality in ponds for aquaculture. Alabama: Auburn University, Alabama Agricultural Experiment Station, 1990.
- CASTAGNOLLI, N.; PINTO, M.L.G. Piscicultura. 3.ed. Jaboticabal: Funep Press, 1992.
- COSTA, F.; ELLIS, A.E.; VIVAS, J. et al. Complement consumption by Photobacterium damselae subsp. piscicida in seabream, red porgy and seabass normal and imune serum. Effect of the capsule on the bactericidal effect. Fish Shellfish Immunol., v.20, p.709-717, 2006.
- DELBON, M.C. Ação da benzocaína e do óleo de cravo sobre parâmetros fisiológicos de tilápia, Oreochromis niloticus. 2006. 91f. Dissertação (Mestrado em Aquicultura) - Curso de Pós-graduação em Aquicultura, Universidade Estadual Paulista Júlio de Mesquita Filho, Jaboticabal, SP.
- DOMELIER, A.S.; MEE-MARQUET, N.V.D.; ARNAULT, L. et al. Molecular characterizantion of erythromycin-resistant Streptococcus agalactiae strains. J. Antimicrob. Chemother., v.62, p.1227-1233, 2008.
- EVANS, J.J.; KLESIUS, P.H.; GILBERT, P.M. et al. Characterization of b-haemolytic group B Streptococcus agalactiae in cultured seabream, Sparus auratus L., and wild mullet, Liza klunzingeri in Kuwait. J. Fish Dis., v.25, p.505-513, 2002.
- EVANS, J.; KLESIUS, P.H.; SHOEMAKER, C.A. Efficacy of Streptococcus agalactiae vaccine in tilapia (Oreochromis niloticus) by intraperitoneal and bath immersion administration. Vaccine, v.22, p.3769-3773, 2004.
- FERNANDES, D.C.; ETO, S.F.; CLAUDIANO, G.S. et al. Humoral immune response of Oreochromis niloticus: modified direct agglutination test. Comp. Clin. Pathol., v.24, p.617-623, 2015.
- FURUYA, W.M.; PEZZATO, L.E.; PEZZATO A.C. et al. Coeficientes de Digestibilidade e Valores de Aminoácidos Digestíveis de Alguns Ingredientes para Tilápia-do-nilo (Oreochromis niloticus). Rev. Bras. Zootec., v.30, p.1143-1129, 2001.
- GONÇALVES, E.G.; CARNEIRO, D.J. Coeficientes de digestibilidade aparente da proteína e energia de alguns ingredientes utilizados em dietas para o Pintado (Pseudoplatystomacoruscans). Rev. Bras. Zootec., v.32, p.779-786, 2003.
- HÖLMSTROM, K.; GRÄSLUND, S.; WAHLSTRÖM, A. et al. Antibiotic use in shrimp farming and implications for environmental impacts and human health. Int. J. Food Sci. Technol., v.38, p.255-266, 2003.
- KIM, S.R.; NONAKA, L.; SUZUKI, S. Occurrence of tetracycline resistance genes tet(M) and tet (S) in bacteria from marine aquaculture sites. Fems Microbiol. Lett., v.237, p.147-156, 2004.
- LIM, C.; WEBSTER, C.D. Tilapia: biology, culture and nutrition. New York: Haworth Press, 2006. p.678.
- MARTINS, M. L.; MORAES, F. R.; FUJIMOTO, R. Y. et al. Carrageenin induced inflammation in Piaractus mesopotamicus (Osteichthues: Characidae) cultured in Brazil. Bol. Inst. Pesca, v.32, p.31-39, 2006.
- SALVADOR, R.; MULLER, E.E.; FREITAS, J.C. et al. Isolation and characterization of group B Streptococcus spp. from Nile tilapia (Oreochromis niloticus) breeding in hapas nets and in earth nurseries in the north region of Parana State, Brazil. Ciênc. Rural, v.35, p.1374-1378, 2005.
- SANTOS, Y.; GARCIA-MARQUEZ, S.; PERERIA, P.G. et al. Efficacy of futunculosis vaccines in turbot, Scophthalmus maximus. Evaluation of immersion, oral and injection delivery. J. Fish Dis., v.28, p.165-172, 2005.
- SARDER, R.M.I.; THOMPSONA, K.D.; PENMANA, D.J.; MCANDREWA, B.J. Immune responses of Nile tilapia (Oreochromis niloticus) clones: I. Non-specific response. Develop. Comp. Immunol., v.25, p.37-46, 2001.
- SHELBY, R.A.; KLESIUS, P.H.; SHOEMAKER, C.H.; EVANS, J.J. Passive immunization of tilapia, Oreochromis niloticus (L.), with anti-Streptococcus iniae whole sera. J. Fish Dis., v.25, p.1-6, 2002.
- SHOEMAKER, C.; KLESIUS, P. Streptococcal disease problems and control: a review. Tilapia Aquac., v.2, p.671-680, 1997.
- VANDAMME, P.; DEVRIESE, L.A.; POT, B. et al. Streptococcus difficileis a nonhemolytic Group B, tipe Ib Streptococcus. Int. J. Syst. Bacteriol., v.47, p.81-85, 1997.
- VAN-DENBERG, G.W. Oral vaccines for finfish: Academic theory or commercial reality? Anim. Health Res. Rev., v.52, p.301- 304, 2004.
- ZAMRI-SAAD, M.; AMAL, M.N.A.; SITI-ZAHRAH, A. Pathological changes in red tilapias (Oreochromis spp.) naturally infected by Streptococcus agalactiae. J. Comp. Pathol., v.143, p.227-229, 2010.
- ZEITLIN, L.; CONE, R.A.; MOENCH, T.R.; WHALEY, K.J. Preventing infectious disease with passive immunization. Microbes Infect., v.2, p.701-702, 2000.
Datas de Publicação
-
Publicação nesta coleção
Mar-Apr 2016
Histórico
-
Recebido
10 Fev 2015 -
Aceito
15 Nov 2015