Resumos
Anticorpos monoclonais (AcM) para rotavírus bovino foram caracterizados para sua aplicação como ferramenta de diagnóstico, utilizando-se as técnicas de isotipificação, dot-blot, western-blot, imunofluorescência indireta (IFI) e ELISA de captura. A caracterização imunoquímica demonstrou que os cinco AcM 1G5, 4F7, 1E12, 4F3 e 3C12 foram do isótipo IgG2a. Pela técnica de dot-blot, os AcM 1G5, 4F7, 1E12, 4F3 detectaram antígenos do rotavírus, em diferentes concentrações, e dois AcM (1E12 e 4F3) reconheceram proteínas virais pela técnica de western-blot. Todos os AcM reagiram positivamente na técnica de IFI em cultivo celular e foram capazes de detectar antígeno viral em amostras fecais bovinas e humanas, pela técnica de ELISA de captura. Identificaram-se dois grupos de AcM, um deles formado pelos AcM 4F7, 1E12 e 1G5, para seu possível uso na detecção de antígeno viral em fezes por meio do ELISA de captura ou dot-blot e outro pelos 4F3 e 3C12, que podem ser usados para detectar antígeno viral em culturas de células por meio de IFI.
bovino; anticorpos monoclonais; rotavírus; diagnóstico
This work was carried out to characterize and evaluate five bovine rotavirus, monoclonal antibodies (MAbs), as a diagnosis tool, by isotyping, dot-blot, western-blot, indirect immunofluorescence (IFI) and ELISA techniques. The immunochemistry characterization showed that all five MAbs (4F7, 4F3, 1G5, 1E12 and 3C12) were IgG2a isotype. The dot-blot immunoassay showed that 1G5, 4F7, 1E12 and 4F3 detected viral antigen in different concentrations and two MAbs (1E12 and 4F3) recognized viral proteins by western-blot. All MAbs detected viral antigen in bovine and human fecal samples by capture ELISA technique and viral antigen in infected MA-104 cell culture by IFI. In conclusion, two groups of Mabs were indetified: one with Mabs 4F7, 1E12 and 1G5 showed the best results to detect rotavirus antigen in fecal samples by capture ELISA or dot-blot techniques assay and other with 4F3 and 3C12 which may be used to detect rotavirus antigens in cell culture by IFI. The results showed the potential use of these MAbs as diagnosis tools in diarrheas by rotavirus in bovines.
bovine; monoclonal antibodies; rotavirus; diagnostic
MEDICINA VETERINÁRIA
Caracterização de anticorpos monoclonais contra rotavírus bovino e suas aplicações como ferramenta de diagnóstico
Characterization of monoclonal antibodies against bovine rotavirus and their diagnostic applications
P.A. Beck; C.F. Brandão; G.S. Campos; S.I. Sardi
Instituto de Ciência da Saúde - UFBA Av. Reitor Miguel Calmon s/n, Vale do Canela 40110-100 - Salvador, BA
RESUMO
Anticorpos monoclonais (AcM) para rotavírus bovino foram caracterizados para sua aplicação como ferramenta de diagnóstico, utilizando-se as técnicas de isotipificação, dot-blot, western-blot, imunofluorescência indireta (IFI) e ELISA de captura. A caracterização imunoquímica demonstrou que os cinco AcM 1G5, 4F7, 1E12, 4F3 e 3C12 foram do isótipo IgG2a. Pela técnica de dot-blot, os AcM 1G5, 4F7, 1E12, 4F3 detectaram antígenos do rotavírus, em diferentes concentrações, e dois AcM (1E12 e 4F3) reconheceram proteínas virais pela técnica de western-blot. Todos os AcM reagiram positivamente na técnica de IFI em cultivo celular e foram capazes de detectar antígeno viral em amostras fecais bovinas e humanas, pela técnica de ELISA de captura. Identificaram-se dois grupos de AcM, um deles formado pelos AcM 4F7, 1E12 e 1G5, para seu possível uso na detecção de antígeno viral em fezes por meio do ELISA de captura ou dot-blot e outro pelos 4F3 e 3C12, que podem ser usados para detectar antígeno viral em culturas de células por meio de IFI.
Palavras-chave: bovino, anticorpos monoclonais, rotavírus, diagnóstico
ABSTRACT
This work was carried out to characterize and evaluate five bovine rotavirus, monoclonal antibodies (MAbs), as a diagnosis tool, by isotyping, dot-blot, western-blot, indirect immunofluorescence (IFI) and ELISA techniques. The immunochemistry characterization showed that all five MAbs (4F7, 4F3, 1G5, 1E12 and 3C12) were IgG2a isotype. The dot-blot immunoassay showed that 1G5, 4F7, 1E12 and 4F3 detected viral antigen in different concentrations and two MAbs (1E12 and 4F3) recognized viral proteins by western-blot. All MAbs detected viral antigen in bovine and human fecal samples by capture ELISA technique and viral antigen in infected MA-104 cell culture by IFI. In conclusion, two groups of Mabs were indetified: one with Mabs 4F7, 1E12 and 1G5 showed the best results to detect rotavirus antigen in fecal samples by capture ELISA or dot-blot techniques assay and other with 4F3 and 3C12 which may be used to detect rotavirus antigens in cell culture by IFI. The results showed the potential use of these MAbs as diagnosis tools in diarrheas by rotavirus in bovines.
Keywords: bovine, monoclonal antibodies, rotavirus, diagnostic
INTRODUÇÃO
Anticorpos monoclonais (AcM) apresentam especificidade única, derivadas de um único clone de células B, e respondem a um único epitopo. Os AcM tornaram-se uma das ferramentas-chave da imunologia, desde seu desenvolvimento em 1975 (Kohler e Milstein, 1975), devido à sua especificidade, homogeneidade e produção em quantidades teoricamente ilimitadas (Nelson et al., 2000).
É notável que os AcM, apesar da sua excelente especificidade, podem ter reação cruzada com outros antígenos ou exibir dupla especificidade. Isto pode ser devido ao reconhecimento de sítios combinados por similaridade na forma ou composição química. Conseqüentemente, uma rigorosa avaliação de um dado AcM e seus epitopos-alvo faz-se necessária (Nelson et al., 2000).
O rotavírus (RTV), pertencente à família Reoviridae, tem sido apontado como importante agente etiológico causador de gastrenterite viral aguda em animais jovens de várias espécies, incluindo a bovina. (McCrae et al., 1982; Greenberg et al., 1983). Em bezerros, a diarréia causada pelo RTV provoca consideráveis prejuízos econômicos devido ao atraso no crescimento, tempo e peso inadequado ao abate e, em alguns casos, até a morte dos animais infectados (Lucchelli et al., 1992; Silva et al., 2001). No Brasil, vários estudos abordaram a infecção por rotavírus em bezerros de rebanho leiteiro e de corte (Brito 1994; Buzinaro et al., 2003). O diagnóstico da doença baseia-se na detecção do vírus ou antígeno viral em material fecal, uma vez que o isolamento do vírus em cultivo celular é demorado e laborioso (Kapikian e Chanock, 2001).
Anticorpos monoclonais (AcM) têm sido empregados para a identificação e diagnóstico do RTV, em ensaios imunoenzimáticos (EIA) para determinar os sorotipos do RTV humano em fezes, permitindo estudos epidemiológicos, ou como ferramentas de diagnóstico de AcM para a detecção de RTV bovino (Birch et al., 1988; Fujii et al., 1992; Al-Yousif et al., 2000). Eles podem, também, ser utilizados para a elucidação de pontos ainda obscuros na morfologia, ciclo de replicação, imunidade, diagnóstico e prevenção ao RTV (Estes, 2001).
O objetivo deste trabalho foi caracterizar os AcM produzidos para rotavírus bovino, utilizando diversas técnicas, para demonstrar o seu possível uso no diagnóstico do vírus.
MATERIAL E MÉTODOS
O vírus1 1 Cepa Nebraska do Rotavírus bovino, sorogrupo A, sorotipo G6, National Veterinary Services Laboratories NVSL/USA foi ativado com 20µg/ml de tripsina (Gibco ) durante 30min a 37°C, para posterior propagação em células MA-104 (células de rim de macaco) (MOI 0.3) em presença de meio essencial mínimo-eagle2 2 Gibco (MEM-E) com 2µg/ml de tripsina. Após a observação do efeito citopático total (48h), as culturas infectadas foram submetidas a um ciclo de congelamento e descongelamento, centrifugadas a 10000g, durante 30min a 4ºC. O sobrenadante foi coletado e armazenado a 20°C até seu uso.
A concentração do vírus foi realizada adicionando-se, ao sobrenadante de RTV, polietilenoglicol3 3 Sigma Chemical Co 8000 (PEG) a 8% e cloreto de sódio a 2,3%, sob agitação constante a 4ºC, durante toda a noite e sucessivas centrifugações como citado em Fontes et al. (2005).
A produção de anticorpos monoclonais, também descrita por Fontes et al. (2005), originou os cinco AcM selecionados para caracterização, que foram assim denominados: 1G5, 4F7, 1E12, 4F3 e 3C12 e utilizados sob as formas de sobrenadante e/ou líquido ascítico.
Durante a caracterização dos AcM empregaram-se as técnicas de isotipificação, dot-blot, western-blot, imunofluorêscencia indireta (IFI) e ELISA de captura.
As classes de imunoglobulina presentes nos sobrenadantes dos clones produtores de AcM e no líquido ascítico, foram determinadas utilizando-se um kit comercial4 4 BIO RAD , baseado no ELISA indireto. O ensaio foi realizado conforme o protocolo recomendado pelo fabricante.
Para realização do dot-blot, o vírus concentrado, em diferentes diluições, foi depositado sobre uma membrana de nitrocelulose5 5 Amersham, Pharmacia utilizando-se o multifiltro dot-blot. As fitas foram bloqueadas com solução de PBS com 5% de leite desnatado (PBS-L 5%). Em seguida, os sobrenadantes dos AcM 1:5 (v/v, PBS-L 0,5%) foram incubados por toda noite a 4°C. No dia seguinte, as fitas foram lavadas com PBS tween 20 (PBS-T 0,05%) e incubadas com anticorpo anti-IgG de camundongo marcado com peroxidase3 3 Sigma Chemical Co 1:500 (v/v, PBS-L 0,5%) por 1h a 37°C. A revelação da reação foi realizada com solução de 3,3- Diaminobenzidina3 3 Sigma Chemical Co (DAB) 10mg/ml na presença de 10µl de peróxido de hidrogênio (10V).
A reatividade dos AcM com proteínas virais foi determinada por meio de western-blot. O vírus concentrado foi diluído em tampão desnaturante de Laemmli (62,5mM Tris-HCL, pH 6,8; SDS 2%; b-mercaptoetanol 5%; glicerol 20%; azul de bromofenol 0,5%) ou em tampão não-desnaturante (62,5mM Tris-HCL, pH 6,8; glicerol 20%; azul de bromofenol 0,5%) e fracionado por SDS-PAGE a 7,5%. As proteínas foram eletrotransferidas a uma membrana de nitrocelulose3 3 Sigma Chemical Co , por 1h a 100mA. Após constatação da transferência pela técnica de coloração de vermelho de Ponceau 10%, as fitas foram incubadas, separadamente, com soro hiperimune de camundongo ou coelho 1:500 (v/v, PBS) (Fontes et al., 2005) ou líquido ascítico dos AcM 1:5 (v/v, PBS-L 0,5%), durante toda a noite. Depois as membranas foram lavadas com PBS-T, incubadas com anticorpo anti-IgG de camundongo ou coelho marcado com peroxidase3 3 Sigma Chemical Co 1:1000 (v/v, PBS) por 1h a 37°C e a visualização das bandas foi realizada com solução de DAB.
Para a IFI, células MA-104, cultivadas em lamínulas, foram infectadas com rotavírus bovino, como mencionado anteriormente. As lamínulas infectadas coletadas em tempos diversos (3h, 5h, 7h e 24h) pós-infecção, foram fixadas em acetona por 10min a 20°C. Em seguida, o sobrenadante dos clones produtores de AcM, sem diluição, ou soro hiperimune de camundongo 1:500 (v/v, PBS) foram incubados por 1h a 37°C. Após lavagem com PBS, o anticorpo anticamundongo marcado com isotiocianato de fluoresceína3 3 Sigma Chemical Co 1:30 (v/v, PBS), foi incubado por 1h a 37°C. Posteriormente, as lamínulas foram lavadas com PBS e, finalmente, com solução de azul de Evans (0,1%) durante 3min, montadas em lâminas com glicerina 50% (v/v, PBS), observadas em microscópio de fluorescência6 6 Zeiss Axiolab HBO 50 .
O ELISA de captura foi realizado em placas sensibilizadas com soro hiperimune de coelho (1:2000 diluído em tampão carbonato-bicarbonato: Na2CO3 1,7g/l, NaHCO3 2,86g/l; 0,05M; pH 9,6), incubadas durante toda a noite a 4°C, e no dia seguinte, bloqueadas com PBS-Leite a 5%. Para avaliar a reatividade cruzada dos AcM, fezes diarréicas bovinas e humanas, oriundas de fazendas do interior da Bahia e de crianças hospitalizadas no Centro Pediátrico Prof. Hosannah de Oliveira, Salvador, Bahia, respectivamente, foram diluídas a 20% (v/v,PBS) e centrifugadas a 3000g durante 15min a 4°C. Em cada poço da placa adicionaram-se 100µl das suspensões de fezes, incubando-se por 1h a 37°C. Em seguida, os sobrenadantes dos clones produtores de AcM foram adicionados a toda placa e incubados por toda a noite a 4ºC em câmara úmida. Ao final desse tempo, adicionou-se anticorpo anticamundongo marcado com peroxidase3 3 Sigma Chemical Co 1:5000 (v/v, PBS) e incubou-se por 1h a 37°C. Por último, a reação foi revelada com solução de 3,3,5,5-Tetrametilbenzidina3 3 Sigma Chemical Co (TMB) na presença de 0,015% (v/v) de peróxido de hidrogênio e lida em espectrofotômetro a 630nm.
Para extração do RNA viral, nas amostras de fezes, utilizou-se o método fenol-clorofórmio (Campos et al., 2002). O RNA extraído foi submetido à técnica de SDS-PAGE a 7,5% e, posteriormente, submetido a uma coloração com solução de nitrato de prata 7mM, para visualizar as bandas correspondentes aos segmentos de RNA viral (Herring et al.,1982).
RESULTADOS E DISCUSSÃO
Os cinco AcM caracterizados, produzidos para RTV bovino, apresentaram perfis imunoquímicos diferentes, possivelmente pelo reconhecimento de diferentes epitopos e/ou formas de apresentação das proteínas virais nos testes empregados.
A determinação do isotipo, em todos os AcM revelou a presença de um tipo específico de imunoglobulina: IgG2a com cadeia leve k (Tab. 1). A técnica de dot-blot mostrou a sensibilidade dos AcM para detectar proteínas virais por meio dessa metodologia (Fig. 1). A este respeito, demostrou-se que os AcM 4F7, 1E12 e 4F3 detectaram uma concentração de até 200ng de proteínas virais e o AcM 1G5 foi o mais sensível, detectando até 100ng. Considerando-se que, durante a infecção viral, é eliminada nas fezes grande quantidade de partículas virais (1010 partículas/ml) (Kapikian e Chanock, 2001), a concentração de antígeno viral, neste caso, supera amplamente o nível detectado pelo dot-blot (> 100ng). Portanto, pode ser uma alternativa utilizar esses AcM em uma técnica de triagem, baseado nessa metodologia.
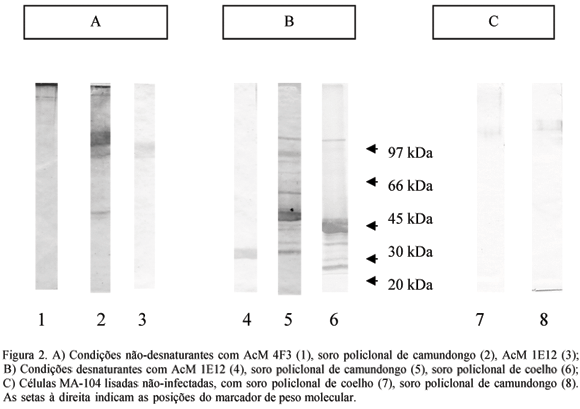
É conhecido que as proteínas podem sofrer alterações durante o processamento das técnicas, o que torna difíceis as interações com os anticorpos, principalmente, com epítopos conformacionais (Nelson et al., 2000). Provavelmente foi o que aconteceu durante a aplicação da técnica de dot-blot e western-blot. A corrida eletroforética das proteínas e posterior transferência à membrana de nitrocelulose, também podem causar problemas na detecção de epitopos conformacionais. Neste trabalho, os AcM 4F3 e 1E12 conseguiram reconhecer as proteínas virais pela metodologia de western-blot (Fig. 2). O AcM 4F3 reagiu somente em condições nativas, obedecendo provavelmente ao reconhecimento de um epitopo conformacional. Quando esse anticorpo foi usado para a detecção do vírus, em amostras de fezes infectadas naturalmente, os resultados obtidos não foram os esperados (Tab. 2), e esse fato sugere a possibilidade de este AcM estar reconhecendo um epitopo conformacional, que se altera durante o processamento da amostra. Entretanto, o 1E12, diferentemente do 4F3, reagiu com proteínas desnaturadas e não desnaturadas, mostrando que o epitopo reconhecido por ele, é possivelmente linear, isto é, uma seqüência de aminoácidos que não sofre as conseqüências da metodologia empregada. Esse AcM destaca-se em todos os testes realizados com RTV (dot-blot, IFI e ELISA de captura). Resultados semelhantes foram observados com o AcM 4F7, cuja performance também foi destacável nos testes utilizados, à exceção do western-blot. O AcM 1G5 também participa do grupo de AcM reativos, apesar de um sinal fraco na IFI.
Ainda na IFI, notou-se que os AcM 1E12, 4F3, 4F7 e 1G5 reconheceram proteínas virais desde as 3h pós-infecção, sugerindo proteínas iniciais da replicação viral, enquanto o 3C12 reconheceu proteínas a partir de 5h pós-infecção, possivelmente sintetizadas mais tardiamente durante o ciclo de replicação. Observou-se, também, que as células infectadas apresentavam inclusões citoplasmáticas ou viroplasmas (local onde ocorre a montagem final do vírus antes de sua liberação) bem delimitados, ao redor do núcleo. Após, 7h pós-infecção, essas inclusões apresentavam-se de forma mais difusa no citoplasma celular e em um número maior de células (Fig. 3). Finalmente, 24h pós-infecção, as inclusões aparecem difundidas nas células por todo o citoplasma, sugerindo proximidade de lise celular.
No teste de ELISA de captura, os AcM 1G5, 4F7, 1E12, 4F3 e 3C12 reconheceram antígenos de RTV bovino e humano nas amostras de fezes (Tab. 2). No total de amostras analisadas (n=20), 12 foram positivas para RTV com os AcM 1G5 e 4F7 e 8 foram negativas. Alternativamente, com o uso do AcM 1E12, detectaram-se 13 amostras positivas e sete negativas. Disso surge que, apesar do ELISA, ter sido utilizado para análises preliminares sobre os AcM, observou-se alta concordância entre os resultados encontrados, quando empregaram-se os AcM 1G5, 4F7 e 1E12 (kappa = 0,9; P<0,05) e aqueles obtidos no SDS-PAGE (técnica de referência). Os resultados divergentes apresentados no SDS-PAGE e na ELISA pode ser em conseqüência da degradação do RNA viral por ação enzimática, o que dificultou sua detecção. Notou-se baixa concordância entre esses resultados, quando utilizaram-se os AcM 4F3 e 3C12 (kappa= 0,5; P<0,05). A reatividade positiva dos AcM com fezes bovinas e humanas pode indicar que estes estão reconhecendo antígenos de grupo e têm reatividade cruzada (Nelson et al., 2000). Proteínas com determinantes que geram estas reações têm sido investigadas no gênero Rotavírus, e entre elas, a VP6 é considerada a principal responsável por este tipo de reação (Kapikian e Chanock, 2001), talvez por ser a proteína mais abundante. Além disso, a reatividade cruzada dos AcM dirigidos contra outras proteínas como VP4 e VP7 também tem sido relatada (Taniguchi et al., 1987; Chen et al., 1992).
Assim, pode-se perceber que os AcM 4F7, 1E12 e 1G5 tiveram resultados satisfatórios em vários testes empregados, enquanto o 4F3 e 3C12 tiveram resultados divergentes. A este respeito, o 3C12 apresentou resultados negativos nos testes realizados, à exceção de uma fluorescência citoplasmática fortemente positiva em cultura de células infectadas, podendo ser uma alternativa para seu uso como reagente para IFI.
CONCLUSÃO
A caracterização imunoquímica desses AcM produzidos para RTV bovino resultou na classificação de dois grupos de AcM: grupo A - formado pelos 4F7, 1E12 e 1G5, fortes candidatos ao uso em testes de diagnóstico para detecção de antígeno viral em fezes (ELISA de captura) e grupo B - formado pelos AcM 4F3 e 3C12 candidatos, de primeira escolha, para detectar antígeno viral em culturas de células (IFI).
Recebido em 27 de setembro de 2006
Aceito em 28 de maio de 2007
E-mail: pabeck@ig.com.br
- Al-YOUSIF, Y.; AL-MAJHDI F.; CHARD-BERSTROM, C. et al. Development, characterization, and diagnostic applications of monoclonal antibodies against bovine rotavirus. Clin. Diag. Lab. Immunol., v.7, p.288-292, 2000.
- BIRCH, C.J.; HEATH, R.L.; GUST, I.D. Use of serotype-specific monoclonal antibodies to study the epidemiology of rotavirus infection. J. Med. Virol, v.24, p.45-53, 1988.
- BRITO, W.M.E.D. Bovine rotavirus in the State of Goiás. Rev. Microbiol., v.24, p.229-234, 1994.
- BUZINARO, M.G.; MISTIERI, M.L.A.; CARVALHO, A.A.B. et al., Prevalência de rotavírus do grupo A em fezes diarréicas de bezerro de corte em sistema semi-intensivo de produção. Arq. Bras. Med. Vet. Zootec, v.55, p.266-270, 2003.
- CAMPOS, G.S.; SARDI, S.I.; SAMPAIO, A.S. et al. Detecção do rotavírus bovino em crianças hospitalizadas com quadros diarréicos em Salvador, Bahia, Brasil. Rev. Cienc. Med. Biol., v.1, p.7-11, 2002.
- CHEN, D.; ESTES, M.K.; RAMIG, R.F. Specific interations between rotavirus outer capsid proteins VP4 and VP7 determine expression of a cross-reative, neutralizing VP4-specific epitope. J. Virol., v.66, p.432-439, 1992.
- ESTES, M.K. Rotaviruses and their replication. In: FIELDS, B.N.; KNIPE, D. M.; HOWLEY, P.M. et al. (Eds.). Virology. 5.ed. Philadelphia: Lippincott Willians & Wilkins, 2001. p.1747-1785.
- FONTES, L.V.Q.; CAMPOS, G.S.; BECK, P.A. et al. Precipitation of bovine rotavirus by polyethylen glycol (PEG) and its application to produce polyclonal and monoclonal antibodies. J. Virol. Methods, v.123, p.147-153, 2005.
- FUJII, R.; KUZUYA, M.; HAMANO, M. et al. Detection of human group C rotaviroses by na enzyme-linked immunosorbent assay using monoclonal antibodies. J. Clin. Microbiol., v.30, p.1307-1311, 1992.
- GREENBERG, H.B.; VALDESUSO, J.; KATHLEEN, W. et al. Production and preliminary characterization of monoclonal antibodies directed at two surface proteins of rhesus rotavirus. J. Virol., v.47, p.267-275, 1983.
- HERRING, A.J.; INGLIS, N.F.; OJHEH, C.K. et al. Rapid diagnosis of rotavirus infection by direst detection of viral nucleic acid in silver-stain polyacrylamide gels. J. Clin. Microbiol., v.16, p.473-477, 1982.
- KAPIKIAN, A.Z.; HOSHINO, Y.; CHANOCK, R.M. Rotaviroses. In: FIELDS, B.N.; KNIPE, D. M.; HOWLEY, P.M. et al. (Eds.). Virology. 5.ed. Philadelphia: Lippincott Willians & Wilkins, 2001. cap. 55, p.1787-1833.
- KOHLER,G.; MILSTEIN, C. Continuos cultures of cells secreting antibody of defined specificity. Nature, v.256, p.495-497, 1975.
- LUCCHELLI, A.; LANCE, S.E.; BARTLETT, P.B. et al. Prevalence of bovine group A bovine rotavirus shedding among dairy calves in Ohio. Am. J. Vet. Res., v.53, p.169-179, 1992.
- McCRAE, M.A.; McCORQUODALE, J.G. The molecular biology of rotaviruses. Virology, v.117, p.435-443, 1982.
- NELSON, P.N.; REYNOLDS, G.M.; WALDRON, E.E. et al. Monoclonal antibodies. J. Clin. Pathol., v.53, p.111-117, 2000.
- SILVA, R.R.; BARROS D.M.; SOUZA, R.K.A. et al. Pesquisa de rotavírus em bezerros bovinos no município de Igarapé- açu (PA). Rev. Cienc. Agrar., n.36, p.121-129, 2001.
- TANIGUCHI, K.; MORITA, Y.; URASAWA, T. et al. Cross-reactive neutralization epitopes on VP3 of human rotavirus: analysis with monoclonal antibodies and antigenic variants. J. Virol., v.61, p.1726-1730, 1987.
Datas de Publicação
-
Publicação nesta coleção
19 Set 2007 -
Data do Fascículo
Jun 2007
Histórico
-
Recebido
27 Set 2006 -
Aceito
28 Maio 2007