Abstracts
The effect of cryopreservation in IFN-tau, from bovine embryos produced in vitro was evaluated. Two treated groups (G1= fresh bovine embryos, n=59 and G2= freezed embryos, n=84) were used to study the effect of cryopreservation on IFN-tau secretion. After reaching the blastocyst phase, the embryos were kept on individual culture for additional period of 7 days. On days 3 and 7 after the beginning of embryos cultivation, samples of the media culture were taken for IFN-tau secretion titration. Oocysts taken from follicles ranging from 3 to 5mm in diameter were obtained from ovaries of females at slaughterhouse. The embryos were frozen, after being dehydrated with ethylene glycol (1.8m), conditioned on 0.5ml palletes and frozen. Frozen embryos secreted lower IFN-tau than fresh embryos (P<0.05). At day 7 it was registered higher IFN-tau secretion from trophoblast than at day 3 (P<0.05). The increasing of IFN-tau secretion was observed when the blastocyst began to longed and it was directly related to the embryos development. The synthesis of IFN-tau is related to the capability of development of the blastocyst. Cryopreservation is a method that affects the maternal recognition of pregnancy and the post-freezing embryo development.
bovine; embryo; PIV; interferon-tau
Avaliou-se a interferência da criopreservação sobre a secreção de interferon-tau (IFN-tau) por embriões bovinos produzidos in vitro. Usaram-se dois grupos de tratamentos: I) constituído por embriões não criopreservados (fresco) e II) embriões criopreservados. Os embriões, após atingirem a fase de blastocisto (fresco ou imediatamente após o descongelamento dos criopreservados), continuaram a ser cultivados individualmente por mais sete dias. Do meio de cultivo em que se mantiveram os blastocistos retiraram-se alíquotas com três e sete dias do início do cultivo, para a avaliação da secreção de IFN-tau pelos embriões cultivados. Os embriões congelados secretaram menos IFN-tau do que aqueles não criopreservados (P<0,05), e com sete dias houve maior secreção do interferon do que com três dias (P<0,05). A criopreservação prejudicou a produção de IFN-tau pelo trofoblasto e pode comprometer o reconhecimento materno da gestação e o desenvolvimento do embrião pós-descongelamento.
bovino; embrião; PIV; interferon-tau
MEDICINA VETERINÁRIA
Secreção de interferon-tau em embriões bovinos produzidos in vitro frescos e congelados
Interferon tau secretion in cattle embryos in vitro fertilized before and after cryopreservation
M.C.C. AraújoI; V.R. Vale FilhoII; A.M. FerreiraIII; W.F. SáIII; J.B. Barreto FilhoIV; L.S.A. CamargoIII; R.V. SerapiãoV; M.V.G.B. SilvaIII
IUniversidade Presidente Antônio Carlos UNIPAC
IIEscola de Veterinária da UFMG Caixa Postal 567 30123-970 - Belo Horizonte, MG
IIIEmbrapa Gado de Leite Juiz de Fora, MG
IVDepartamento de Medicina Veterinária UFLA Lavras, MG
VMédico Veterinário
RESUMO
Avaliou-se a interferência da criopreservação sobre a secreção de interferon-tau (IFN-t) por embriões bovinos produzidos in vitro. Usaram-se dois grupos de tratamentos: I) constituído por embriões não criopreservados (fresco) e II) embriões criopreservados. Os embriões, após atingirem a fase de blastocisto (fresco ou imediatamente após o descongelamento dos criopreservados), continuaram a ser cultivados individualmente por mais sete dias. Do meio de cultivo em que se mantiveram os blastocistos retiraram-se alíquotas com três e sete dias do início do cultivo, para a avaliação da secreção de IFN-t pelos embriões cultivados. Os embriões congelados secretaram menos IFN-t do que aqueles não criopreservados (P<0,05), e com sete dias houve maior secreção do interferon do que com três dias (P<0,05). A criopreservação prejudicou a produção de IFN-t pelo trofoblasto e pode comprometer o reconhecimento materno da gestação e o desenvolvimento do embrião pós-descongelamento.
Palavras-chave: bovino, embrião, PIV, interferon-tau
ABSTRACT
The effect of cryopreservation in IFN-tau, from bovine embryos produced in vitro was evaluated. Two treated groups (G1= fresh bovine embryos, n=59 and G2= freezed embryos, n=84) were used to study the effect of cryopreservation on IFN-tau secretion. After reaching the blastocyst phase, the embryos were kept on individual culture for additional period of 7 days. On days 3 and 7 after the beginning of embryos cultivation, samples of the media culture were taken for IFN-tau secretion titration. Oocysts taken from follicles ranging from 3 to 5mm in diameter were obtained from ovaries of females at slaughterhouse. The embryos were frozen, after being dehydrated with ethylene glycol (1.8m), conditioned on 0.5ml palletes and frozen. Frozen embryos secreted lower IFN-tau than fresh embryos (P<0.05). At day 7 it was registered higher IFN-tau secretion from trophoblast than at day 3 (P<0.05). The increasing of IFN-tau secretion was observed when the blastocyst began to longed and it was directly related to the embryos development. The synthesis of IFN-tau is related to the capability of development of the blastocyst. Cryopreservation is a method that affects the maternal recognition of pregnancy and the post-freezing embryo development.
Keywords: bovine, embryo, PIV, interferon-tau
INTRODUÇÃO
A utilização de embriões congelados é uma forma de assegurar melhor aproveitamento da fertilização in vitro (Vajta et al., 1996a), permitindo maior utilização, principalmente quando não se dispõe de muitas fêmeas para serem usadas como receptoras. O fato de os embriões produzidos in vitro (PIVE) apresentarem particularidades quanto à sua morfologia e capacidade de desenvolvimento (Stojkovic et al., 1995) em relação aos embriões formados in vivo (Massip et al., 1995) pode propiciar traumatismos celulares no processo de resfriamento e congelamento, capazes de comprometer o desenvolvimento do concepto e a secreção de fatores fundamentais para o reconhecimento materno da gestação. Essa pode ser uma das principais causas de morte embrionária nas primeiras semanas de desenvolvimento do embrião, principalmente os de PIVE, juntamente com outras como estresse térmico etc. Entre os fatores que atuam no reconhecimento do embrião pelo organismo materno, destaca-se o interferon tau (INF-t). A ação do INF-t para a manutenção da gestação consiste em inibir os fatores relacionados com a luteólise (Thatcher et al., 2001), com seu efeito sendo tão importante que o atraso e/ou mesmo quantidades insuficientes de sua secreção podem ser responsáveis por prematura morte embrionária (Arnold et al., 2000), sobretudo de embriões fertilizados in vitro e criopreservados, cuja taxa de gestação tem sido inferior a 20%. Tal fato vem dificultando o maior uso da técnica de PIVE.
O objetivo do presente trabalho foi verificar variações na secreção de interferon-tau entre os embriões de PIVE congelados e os que foram cultivados frescos após o estádio de blastocisto.
MATERIAL E MÉTODOS
A titulação do IFN-t foi realizada em embriões produzidos in vitro. Conforme descrito por Araujo (2003), foram usados na produção dos embriões oócitos aspirados de folículos de 3 a 8 mm de diâmetro, obtidos de ovários de vacas coletados em matadouro. Os oócitos que apresentavam o citoplasma homogêneo e três ou mais camadas compactas de células do cumulus oophorus (Hawk e Wall, 1994) foram submetidos ao processo de maturação, sendo, em seguida, fertilizados in vitro com sêmen de um touro da raça Holandesa. No sétimo dia de desenvolvimento os blastocistos que apresentavam graus I e II, segundo Kennedy et al. (1983), foram divididos em dois tratamentos: tratamento 1- embriões frescos submetidos ao cultivo em meio Glasgow BHK21 (controle) e tratamento 2- embriões criopreservados, descongelados e cultivados em meio Glasgow BHK21.
No processo de congelamento, os embriões do tratamento 2 foram desidratados com etilenoglicol (1,8M), envasados em palhetas de 0,25ml e submetidos ao congelamento no aparelho freezer control1 1 Freezer Control - CryologicÒ - São Paulo CL-863 configurado para o programa zero. Terminada a curva de congelamento, as palhetas foram submersas em nitrogênio líquido, a -196°C, onde ficaram armazenadas até o descongelamento. No descongelamento, as palhetas foram retiradas do nitrogênio líquido e mantidas por 10 segundos no ar, e 20 segundos em banho-maria a 35°C. Os embriões descongelados foram colocados em placa escavada e lavados inicialmente em PBS + 0,4% BSA e depois em meio Glasgow BHK212 2 Glasgow BHK21 - GibcoÒ - São Paulo + 10% SFB.
O cultivo dos embriões para titulação de IFN-t foi realizado em monocamada de células da granulosa retiradas de folículos com diâmetro entre 10mm e 20mm. As células foram contadas em câmara de Neubawer, ajustadas para 0,5x106 células/ml em gotas de 100µl de meio Glasgow BHK21, e recobertas com óleo mineral. Antes do início do cultivo, as células foram cultivadas por 48 horas para a formação de monocamada. Nestas gotas os embriões frescos (n =59) e descongelados (n=84) foram co-cultivados por sete dias em estufa incubadora a 38,8 °C e 95% de umidade, com 5% de CO2. Com três e sete dias de cultivo, coletaram-se 60µl do meio de cultivo embrionário, que foi acondicionado em eppendorf e armazenado em freezer à temperatura de -20°C. O volume retirado do meio foi imediatamente reposto após a coleta.
A titulação do IFN-t foi realizada no setor de fisiopatologia da reprodução do Departamento de Medicina Veterinária da Universidade Federal de Lavras.
Para titulação do interferon, foram usadas células Madin Darby bovine kidney (MDBK -ATCC CRL 6071) e vírus da estomatite vesicular (VSV) com o título de 10-7,8, aferido pelo método de Reed e Muench (1938), citado por Lennett e Schmidt (1979), utilizando-se uma dose infectante de aproximadamente 100 tissue culture infective doses (TCID50).
O IFN-t presente em cada amostra foi avaliado por meio de titulação indireta (Ferreira et al., 1979), na qual o título representa a recíproca da diluição que reduziu o efeito citopático do vírus em 50%, quando comparado com o controle do vírus. Como controle interensaio utilizou-se um padrão interno de interferon a I, com atividade de 1,8-2,1x108 UI/mg em células MDBK com VSV.
Dos embriões cultivados a fresco foram tituladas 28 alíquotas de três dias e 19 alíquotas de sete dias, enquanto dos submetidos ao congelamento foram tituladas 25 alíquotas de três dias e 28 alíquotas de sete dias.
Com a finalidade de comprovar que a ação antiviral observada nas alíquotas tituladas ocorreu em função do IFN-t, um pool de alíquotas foi submetido ao processo de neutralização da atividade antiviral. Inicialmente foram retirados 10µl de quatro diferentes alíquotas do meio de cultivo de embriões e diluídas cada uma em 90µl de MEM3 3 Minimum Essential Médium Eagle - SIGMAÒ - São Paulo com 5% de soro fetal bovino (SFB). Em seguida, foram acrescentados a essas diluições 100µl de uma solução com anticorpo antiinterferon-tau (produzido em coelhos) na diluição de 1/200, com a mesma concentração de SFB. As soluções foram colocadas em incubação a 37°C com 5% de CO2 por 60 minutos, sendo homogeneizadas a cada 15 minutos durante esse tempo. O mesmo procedimento foi realizado com o interferon-tau padrão, com atividade conhecida, cujo título foi de 5,4×107 UI/mg em células MDBK com VSV.
Os resultados da titulação do interferon-tau (IFN-t) nas alíquotas retiradas com três e sete dias de cultivo dos blastocistos foram expressos na forma de títulos e foram analisados por meio do procedimento PROC GLM do pacote estatístico SAS (User's..., 1985).
RESULTADOS E DISCUSSÃO
No processo de neutralização da atividade antiviral, houve maior efeito citopático do vírus (VSV) nas alíquotas tratadas com o anticorpo antiinterferon-tau, confirmando que a inibição do efeito citopático do vírus nas alíquotas tituladas ocorreu em função do interferon-tau secretado pelos embriões bovinos.
A média dos quadrados mínimos dos títulos de IFN-t dos embriões que foram criopreservados antes do cultivo foi menor que a dos embriões não-criopreservados (P<0,05) (Fig. 1).
Os embriões produzidos in vitro, quando submetidos ao processo de criopreservação, secretaram menos IFN-t do que os embriões frescos.
Stojkovic et al. (1995) consideraram que os traumatismos provenientes da criopreservação de embriões comprometem a viabilidade das células trofoblásticas e sua capacidade de secretar IFN-t. Esse prejuízo na secreção de IFN-t ocasionado por lesões ou alterações bioquímicas no embrião também foi mencionado por Lonergan et al. (2003) segundo os quais a ocorrência de lesões no embrião durante o seu desenvolvimento pode comprometer a emissão dos sinais para o reconhecimento materno da gestação.
O desenvolvimento do embrião foi prejudicado em razão dos danos causados às células pela criopreservação (Pollard e Leibo, 1994; Wiemer et al., 1995; Kaidi et al., 1998). Essas lesões são decorrentes da formação de cristais de gelo dentro e fora das células (Vajta et al., 1997) e dos efeitos osmóticos dos criopretetores durante a desidratação e reidratação do embrião (Saha e Suzuki, 1997).
As lesões provenientes do processo de criopreservação que ocorrem no trofoderma e na massa celular interna são responsáveis pela diminuição do número de células trofobláticas no blastocisto congelado (Kaidi et al., 1999). Elas comprometem a integridade das membranas das organelas, do núcleo e da membrana celular, fato que prejudica a qualidade dos embriões e reflete na sua capacidade de secretar IFN-t (Kristina et al., 2001).
Stojkovic et al. (1995) afirmaram que os fatores que comprometem o desenvolvimento das células trofoblásticas diminuem a área do trofoderma, prejudicando a secreção de IFN-t. Outras pesquisas relacionam a ocorrência de alterações na ultra-estrutura, decorrentes do processo de criopreservação, à diminuição da qualidade dos embriões e menor secreção de IFN-t (Wiemer et al., 1995). Essas alterações ultra-estruturais são responsáveis por fragmentações da membrana nuclear e podem interferir no DNA (Saha e Suzuki, 1997). Em função disso, ocorre deficiência na expressão do gene que codifica a produção de IFN-t. (Lonergan et al., 2003). Esses autores observaram que os níveis de mRNA para a transcrição de IFN-t são maiores em embriões de melhor qualidade e que lesões na fase de blastocisto comprometem a transcrição do gene responsável pela produção dessa proteína.
Os embriões maturados e fertilizados in vitro são mais sensíveis aos traumatismos do processo de criopreservação (Vajta et al., 1996b; Kaidi et al., 1999). Por essa razão, considera-se que a susceptibilidade dos embriões de PIVE ao processo de criopreservação contribui para a menor secreção de IFN-t, conforme observado neste trabalho. Fatores como a menor justaposição das células do trofoblasto e das células do mesoderma, alterações nas microvilosidades das células trofoblásticas, diferença na composição da zona pelúcida e alta porcentagem de lipídios nas células conferem aos embriões de PIVE menor resistência ao processo de congelamento (Pollard e Leibo, 1994; Massip et al., 1995; Thompson, 1997), além de contribuírem para uma menor taxa de clivagem e um desenvolvimento deficiente do blastocisto, inclusive de seu trofoderma (Greve et al., 1993).
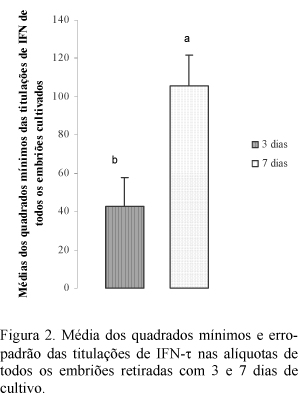
Pelas médias dos quadrados mínimos a secreção de IFN-t foi maior nas alíquotas retiradas com sete dias do que naquelas com três dias (P<0,05) (Fig. 2). Ainda, houve interação tratamento versus secreção do IFN-t (P<0,05), pois os títulos dessa proteína foram menores nas alíquotas de 168 horas dos embriões criopreservados que naqueles cultivados frescos (Fig. 2).
Mann et al. (1999) também relataram aumento na secreção de IFN-t em função do desenvolvimento do embrião. Segundo Thatcher et al. (1995), a secreção dessa proteína trofoblástica inicia-se por volta do oitavo dia de desenvolvimento do embrião e tem sua secreção aumentada entre o 14º e o 17º dia. Esses autores enfatizam que o período de aumento na secreção do IFN-tau é o mesmo em que se desenvolvem os mecanismos luteolíticos do organismo materno.
O aumento na secreção do IFN-t ocorre quando o blastocisto começa a se alongar e está diretamente relacionado com o desenvolvimento do embrião (Godkin et al., 1997). Stojkovic et al. (1999) afirmaram que, nessa fase do desenvolvimento embrionário, ocorrem aumentos no número e tamanho das células trofoblásticas, o que seria responsável pela maior secreção de IFN-t (Kubisch et al., 1998).
A síntese de IFN-t está relacionada com a capacidade de desenvolvimento dos blastocistos (Kristina et al., 2001), que à medida que se desenvolvem secretam mais IFN-t (Thatcher et al., 2001). O presente estudo mostra que os processos envolvidos no congelamento e descongelamento comprometeram o desenvolvimento do embrião criopreservado, principalmente o trofoderma, impossibilitando aumento na secreção do IFN-t no período de sete dias de cultivo. Também considera-se que a maior susceptibilidade ao processo de congelamento dos embriões produzidos in vitro pode ter contribuído para a menor titulação verificada nas alíquotas retiradas com sete dias de cultivo. Essa interferência da criopreservação sobre o desenvolvimento do embrião, prejudicando a secreção de IFN-t, também foi relatada por Massip et al. (1995).
A criopreservação prejudica o crescimento da massa celular interna e o desenvolvimento do trofoderma, principalmente no período em que as células trofoblásticas começam a se expandir e se multiplicar (Massip et al., 1995), havendo lesões tanto em organelas quanto no DNA, pois a cromatina do núcleo se abre durante as divisões celulares, ficando mais vulnerável ao processo de criopreservação (Wiemer et al., 1995).
Os danos causados pelos crioprotetores ao DNA do núcleo impedem a intensificação na formação do mRNA que determinam a síntese de IFN-t (Toshihiko et al., 1998), evitando o aumento na secreção dessa proteína trofoblástica pelos embriões de PIV criopreservados.
CONCLUSÕES
Os resultados permitem concluir que o processo de congelamento lento compromete a secreção de IFN-t por embriões bovinos produzidos in vitro, e que a secreção de IFN-t com sete dias de cultivo, após início do cultivo dos blastocistos, é menor nos embriões descongelados.
Recebido para publicação em 10 de fevereiro de 2004
Recebido para publicação, após modificações, em 30 de novembro de 2004
* Autor para correspondência (corresponding author)
E-mail: clinica@vet.ufmg.br
- ARAUJO, M.C.C. Interferon-tau em embriões bovinos produzidos in vitro a fresco e congelados 2003. 43f. Tese (Doutorado) - Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte.
- ARNOLD, D.R.; BINELLI, M.; VONK, J. et al. Intracellular regulation of endometrial PGF2 and PGE2 production in dairy cows during early pregnancy and following treatment with recombinant interferon-t. Dom. Anim. Endocrinol., v.18, p.199-216, 2000
- FERREIRA, P.C.; PEIXOTO, M.L.; SILVA, M.A. et al. Assay of human interferon in vero cells by several methods. J. Clin. Microbiol, v.4, p.471-475, 1979.
- GODKIN, J.D.; SMITH, S.E.; JOHNSON, R.D. et al. The role o trophoblast interferons in the maintenance of early pregnancy in ruminants. Am. J. Reprod. Immunol, v.37, p.137-143, 1997.
- GREVE, T.; AVERY, B.; CELLESEN, H. Viability of in vivo and in vitro produced bovine embryos. Reprod. Dom. Anim, v.28, p.164-169, 1993.
- HAWK, H.W.; WALL, R.J. Improved yields of bovine blastocysts from in vitro-produced oocytes. I. Selection of oocytes and zygotes. Theriogenology, v.32, p.735-743, 1994.
- KAIDI, S.; DONNAY, I.; LANGENDOCKT, A.V. et al. Comparison of two co-culture systems to assess the survival of in vitro produced bovine blastocysts after vitrification. Anim. Reprod. Sci., v.52, p.39-50, 1998.
- KAIDI, S.; VAN LANGENDLONCKT, A.; MASSIP, A. et al. Cellular alteration after dilution of cryoprotective solutions used for the vitrification of in vitro-produced bovine embryos. Theriogenology, v.52, p.515-525, 1999.
- KENNEDY, C.G.; BOLAND, M.P.; GORDON, I. The effects of embryo quality of freezing on subsequent development of thawed low embryo. Theriogenology, v.19, p.823-832, 1983.
- KRISTINA, J.D.; KAMILA, D.; ANTHONY, F. Trophoblast interferon and pregnancy. Reproduction, v.121, p.41-49, 2001.
- KUBISCH, H.M.; LARSON, M.A.; BOBERTS, R.M. Relationship between age of blastocyst formation and interferon-t secretion by in vitro-derived bovine embryos. Mol. Reprod. Dev., v.49, p.254-260, 1998
- LONERGAN, P.; RIZOS, D.; GUTIÉRREZ-ADÁN, A. et al. Temporal divergence in the pattern of messenger RNA expression on bovine embryos cultured from the zygote to blastocyst stage in vitro or in vivo. Biol. Reprod., v.69, p.1424-1431, 2003
- MANN, G.E.; LAMMING, G.E.; ROBINSON, R.S.; et al. The regulation of interferon-t production and uterine hormone receptors during early pregnancy. J. Reprod. Fertil., Suppl., v.54, p.317-328, 1999.
- MASSIP, A.; MERMILLOD, P.; DINNYES, A. Morphology and biochemistry of in vitro-produced bovine embryos: implications for their cryopreservation. Hum. Reprod, v.10, p.3004-3011, 1995.
- POLLARD, J.W.; LEIBO, S.P. Chiling sensitivity of mammalian embryos. Theriogenology, v.41, p.101-106, 1994.
- REED, L.J.E.; MUENCH, H.A. A simple method of estimating fifty per cent end points. Am. J. Hyg., v. 27, p. 493, 1938.
- SAHA, S.; SUZUKI, T. Vitrification of in vitro produced bovine embryos at different ages using one and three-step addition of cryoprotective additives. Reprod. Fertil Dev, v.9, p.741-746, 1997.
- STOJKOVIC, M.; BUTTNER, M.; ZAKHARTCHENKO, V. et al. Secretion of interferon-tau by bovine embryos in long-term culture: comparison of in vivo derived, in vitro produced, nuclear transfer and demi-embryos. Anim. Reprod. Sci, v.55, p.151-162, 1999.
- STOJKOVIC, M.; WOLF, E.; BUTTNER, M. et al. Secretion of biologically active interferon tau by in vitro-derived bovine trophoblastic tissue. Biol. Reprod., v.53, p.1500-1507, 1995.
- THATCHER, W.W.; GUZELOGLU, A.; MATTOS, R. et al. Uterine-conceptus interactions and reproductive failure in cattle. Theriogenology, v.56, p.1435-1450, 2001.
- THATCHER, W.W.; MEYER, M.D.; DANET-DESNOYERS, G. Maternal recognition of pregnancy. J. Reprod. Fertil., v.49, suppl., p.15-28, 1995.
- THOMPSON, J.G. Comparison between in vivo-derived and in vitro-produced pre-elongation embryos from domestic ruminants. Reprod. Fertil. Dev., v.9, p.341-354, 1997.
- TOSHIHIKO, E.; ALAN, D.E.; MICHAEL, C.O. et al. Control of interferon-tau gene expression by Ets-2. Proc. Natl. Acad. Sci. USA, v.14, p.7882-7887, 1998.
- USER'S guide: statistics. Cary: SAS Institute, 1985.
- VAJTA, G.; HOLM, P.; GREVE, T. et al. Factors affecting survival rates of in vitro produced bovine embryo after vitrification and direct in-straw rehydration. Anim. Reprod. Sci., v.45, p.191-200, 1996a.
- VAJTA, G.; HOLM, P.; GREVE, T. et al. Overall efficiency of in vitro embryo production and vitrification in cattle. Theriogenology, v.45, p.683-689, 1996b.
- VAJTA, G.; HYTTLEL, P.; CALLESEN, H. Morphological changes of in vitro-produced bovine blastocysts after virification, in-straw direct rehydration and culture. Mol. Reprod. Dev., v.48, p.9-17, 1997.
- WIEMER, K.E.; DALE, B.; HU, Y. et al. Blastocyst development in co-culture: development and morphological aspects. Hum. Reprod, v.10, p.3226-3232, 1995.
Publication Dates
-
Publication in this collection
18 Apr 2006 -
Date of issue
Dec 2005
History
-
Accepted
30 Nov 2004 -
Received
10 Feb 2004