Resumos
Este estudo teve como objetivo a padronização do ensaio de imunoperoxidase em monocamada de células (IPM) para o diagnóstico etiológico da diarréia bovina a vírus (DBV). O teste foi padronizado em monocamada de cultivo primário de pulmão fetal bovino (PFB) inoculada com as amostras clássicas, citopatogênica (CP) e não citopatogênica (NCP), do vírus da DBV e testado em amostras biológicas suspeitas processadas no teste clássico de isolamento viral (IV). O método de IPM identificou o vírus da DBV, apresentando melhores resultados com a utilização do calor como agente fixador, a soroalbumina bovina a 4% em PBS como bloqueador e a revelação com o cromógeno 3-amino-9-etil-carbazol (AEC). Como anticorpos primários, tanto o anticorpo policlonal como o monoclonal forneceram bons resultados.
Diarréia bovina a vírus; diagnóstico; imunoperoxidase; isolamento
The aim of this study was to standardize the immunoperoxidase in cell monolayer assay (IPMA) for the etiological diagnosis of bovine viral diarrhea (BVD). The method was standardized in monolayer of primary bovine fetal lung culture inoculated with cytophatic and non-cytophatic classical strains of BVD virus and tested using samples that were considered suspected in the classical technique of viral isolation. The IPMA successfully identified BVD virus and presented better results when heat was used for fixation, BSA 4% solution in PBS was used for blocking and AEC chromogen was used for revelation. Both monoclonal and polycloral antibodies gave good results when used as primary antibodies.
Bovine viral diarrhea; diagnosis; immunoperoxidase; viral isolation
Padronização da técnica de imunoperoxidase para detecção do vírus da diarréia bovina a vírus em cultura de células
[Standardization of immunoperoxidase test to detection bovine viral diarrhea virus in cell culture]
G.I. AndradeI; Z.I.P. LobatoI,* * Autor para correspondência ; R.C. LeiteI, E.F. Barbosa-StancioliII
IEscola de Veterinária da UFMG
IIDepartamento de Microbiologia do ICB/UFMG
Endereço para correspondência Endereço para correspondência G.I. Andrade Caixa Postal 567 30123-970 Belo Horizonte, MG E-mail: ziplobat@vet.ufmg.br
RESUMO
Este estudo teve como objetivo a padronização do ensaio de imunoperoxidase em monocamada de células (IPM) para o diagnóstico etiológico da diarréia bovina a vírus (DBV). O teste foi padronizado em monocamada de cultivo primário de pulmão fetal bovino (PFB) inoculada com as amostras clássicas, citopatogênica (CP) e não citopatogênica (NCP), do vírus da DBV e testado em amostras biológicas suspeitas processadas no teste clássico de isolamento viral (IV). O método de IPM identificou o vírus da DBV, apresentando melhores resultados com a utilização do calor como agente fixador, a soroalbumina bovina a 4% em PBS como bloqueador e a revelação com o cromógeno 3-amino-9-etil-carbazol (AEC). Como anticorpos primários, tanto o anticorpo policlonal como o monoclonal forneceram bons resultados.
Palavras-chave: Diarréia bovina a vírus, diagnóstico, imunoperoxidase, isolamento
ABSTRACT
The aim of this study was to standardize the immunoperoxidase in cell monolayer assay (IPMA) for the etiological diagnosis of bovine viral diarrhea (BVD). The method was standardized in monolayer of primary bovine fetal lung culture inoculated with cytophatic and non-cytophatic classical strains of BVD virus and tested using samples that were considered suspected in the classical technique of viral isolation. The IPMA successfully identified BVD virus and presented better results when heat was used for fixation, BSA 4% solution in PBS was used for blocking and AEC chromogen was used for revelation. Both monoclonal and polycloral antibodies gave good results when used as primary antibodies.
Keywords: Bovine viral diarrhea, diagnosis, immunoperoxidase, viral isolation
INTRODUÇÃO
A diarréia bovina a vírus (DBV) é uma enfermidade complexa, com uma variedade de sinais clínicos associados à infecção causada pelo vírus da diarréia bovina à vírus (VDBV), o qual está amplamente disseminado na maioria dos países com criação intensiva de bovinos, onde tem gerado impacto econômico significativo devido às perdas reprodutivas e de produção (Tremblay, 1996). No Brasil, a partir da década de 60, vários estudos têm comprovado a presença desse agente nos principais rebanhos do país (Lemos, 1998).
O VDBV é um vírus-RNA de fita simples pertencente à família Flaviviridae e ao gênero Pestivirus. Dois biótipos, citopático (CP) e não citopático (NCP), e dois genótipos, tipos I e II, são descritos, além da grande variação antigênica entre as amostras isoladas. Infecção placentária com o biótipo não citopatogênico durante o primeiro trimestre de gestação pode gerar animais persistentemente infectados (PI) e imunotolerantes ao NCP-VDBV. Os animais PI são a principal fonte de disseminação do vírus e podem desenvolver, após uma infecção pela amostra citopatogênica homóloga ou mutação da própria amostra NCP em CP, a doença das mucosas (MD), que apresenta alta taxa de mortalidade. Infecções pelo VDBV podem resultar, ainda, em imussupressão, tornando o animal mais susceptível aos patógenos oportunistas, além de gerar falhas na concepção, abortos, mumificação e defeitos congênitos (Tremblay, 1996).
Entre as principais medidas de controle da DBV estão a identificação e eliminação de animais PI e vacinação. Outro grande desafio para os pesquisadores é detectar a presença desse agente no soro fetal bovino e, conseqüentemente, nos cultivos celulares e nas vacinas virais bovinas, que podem estar infectadas com a amostra NCP do VDBV (Sandvik, 1999).
Como a patogenia das infecções pelo VDBV é complexa e resulta em amplo espectro de condições clínicas, variando em gravidade de assintomática a letal (Sandvik, 1999), o exame de laboratório das amostras clínicas é necessário para a obtenção de diagnóstico definitivo. Testes clássicos como a soroneutralização e o isolamento do vírus em culturas de tecidos, juntamente com a identificação do antígeno pela imunofluorescência e imunoperoxidase, métodos imunohistológicos, vários ensaios imunoenzimáticos ELISA e a reação em cadeia pela polimerase pela transcrição reversa (RT-PCR) fornecem uma gama de possibilidades para o controle e prevenção dessa enfermidade. O isolamento viral é um método sensível e, quando realizado em microplacas, grande número de amostras pode ser testado simultaneamente, sendo a identificação do vírus feita pelo ensaio de imunoperoxidase ou imunofluorescência (Dubovi, 1996). Este estudo teve como objetivo a padronização do ensaio de imunoperoxidase em monocamadas de células (IPM) conjugada ao método de isolamento do vírus (IV).
MATERIAL E MÉTODOS
Para a padronização da técnica foi utilizado o cultivo primário de pulmão fetal bovino (PFB) previamente testado para a presença do VDBV. O cultivo de células foi realizado em garrafas de 36cm2, semeando-se 50.000 células/cm2 de PFB em meio essencial mínimo (MEM) (SIGMA, Cat. nº M 0643 ), suplementado com 5% de soro fetal bovino (SFB) (GIBCO BRL, Cat nº 10270-106), também testado para a presença do vírus, e antibióticos (2U/ml de penicilina, 2mg/ml de estreptomicina, 10m g/ml de fungizona). O inóculo viral foi realizado com as amostras de referência citopatogênica (CP), NADL 1422 (ATCC American Type Culture Collection) de terceira passagem em PFB (105,2 dose infectante em cultivo de células - DICC/50ml) e não citopatogênica (NCP), NY-1 5243 de segunda passagem em PFB (106 DICC/50ml ). Amostras provenientes de infecção experimental com as amostras de referência e de um feto abortado (denominado feto 1) com suspeita clínica para a DBV, foram testadas com o método já padronizado.
Para a obtenção de controle positivo, inocularam-se em um bezerro recém-nascido, sem ingestão de colostro e soronegativo para a DBV (testado pelo ensaio de soroneutralização), 2ml da amostra citopatogênica CP/NADL 1422 e 2ml da amostra não citopatogênica NCP/NY-1 524 pela via intranasal, e 4ml de cada amostra por via oral. Após sete dias, fez-se a necropsia do animal sacrificado. Amostras de fígado, pulmões, baço, esôfago, linfonodos axilar e mesentérico, intestinos e traquéia foram coletadas e mantidas a 80ºC até o processamento. Do feto 1 coletaram-se amostras de pulmões, coração, rins e fígado, mantendo-as a 80ºC até o processamento.
As amostras provenientes da infecção experimental foram maceradas separadamente em graal, com auxílio de pistilo e adição de areia estéril. Para o feto 1 vários fragmentos de órgãos foram agrupados em duplicata e em seguida macerados. Adicionou-se ao macerado PBS tratado com antibióticos (penicilina 200UI/ml; estreptomicina 200mg/ml) até a obtenção de suspensão de 20%. A mistura foi transferida para tubos estéreis e mantida a 4ºC por 12 horas. Em seguida centrifugou-se (Centrífuga CR 4 22 Jouan; Rotor C/G4.22) a mistura a 3076 x g, por cinco minutos a 4ºC. O sobrenadante foi vertido em tubo estéril e mantido a 80ºC.
O vírus padrão e as amostras processadas foram inoculados em cultivo celular de PFB semeado em microplacas de 96 cavidades na concentração de 50.000 células/cm2 em MEM com 5% de SFB. Para o vírus padrão, as placas foram incubadas a 37ºC em estufa de CO2 até efeito citopático de 40-50% (amostra CP/NADL) ou incubadas por quatro dias (amostra NCP/NY-1), quando, então, foram fixadas e bloqueadas pelos diferentes reagentes testados. As amostras processadas foram diluídas 10 vezes em MEM sem SFB e inoculadas em quatro repetições de 20m l por cavidade por amostra. As placas foram incubadas a 37ºC em estufa de CO2 e monitoradas por quatro dias. Duas placas foram congeladas a 80ºC para utilização em passagens posteriores e duas foram fixadas para a identificação viral por meio da técnica de IPM. O isolamento viral prosseguiu na terceira e quarta passagens, descongelando-se e congelando-se por três vezes as placas mantidas a 80ºC e inoculando-se cada uma das repetições em nova monocamada de células, como descrito anteriormente.
Como fixadores utilizaram-se calor a 80ºC e acetona a 20% em PBS. Na fixação pelo calor, retirou-se o MEM das placas que, então, foram imersas em solução salina 0,15M/Tween 80 0,05% por três vezes. As placas permaneceram a 80oC por 1h em estufa, sendo posteriormente embaladas em papel alumínio e mantidas a 4oC. Na fixação pela acetona utilizou-se metodologia previamente descrita (Oliveira et al.,1996). O bloqueio de ligações inespecíficas foi realizado com leite em pó desnatado comercial a 5% em PBS, gelatina (REAGEN, Cat. nº 10393) a 1% em PBS e soro albumina bovina (SIGMA, Cat nº b 4287) a 4% em PBS, além de monocamadas não bloqueadas que serviram como controle negativo. As placas foram incubadas por 30 minutos em estufa a 37ºC.
A reação de IPM foi padronizada segundo Afshar et al. (1991) e Elahi et al. (1997), com modificações. Como reagentes primários, utilizou-se o anticorpo monoclonal Panpestivírus anti-DBV DE9 (Mab PP) (Centro de Biotecnologia da Universidade Federal do Rio Grande do Sul (UFRGS)) e anticorpo policlonal anti-DBV de origem caprina (Pab) (VMRD, Cat. nº 210-70-BVD) previamente titulados. Destes foram adicionados 30ml por cavidade, em duplicata, às placas de 96 cavidades, já bloqueadas. O tempo de incubação após a adição dos anticorpos primários foi de 1h em estufa de CO2 a 37oC. As placas foram, então, lavadas com salina 0,15M/Tween 80 a 0,05% por três vezes. Após essa etapa adicionaram-se 30ml por cavidade de cada respectivo conjugado, anti- IgG camundongo-peroxidase (SIGMA; Cat. Nº A-9044) e anti- IgG caprino peroxidase (SIGMA, Cat. Nº A-5420), com nova incubação de 45 minutos em estufa de CO2 a 37oC. Repetiu-se o procedimento de lavagem. A reação foi revelada pela adição de 30ml por cavidade do substrato 3-amino-9-etil-carbazol (AEC) ou 3,3 diaminobenzidina tetrahidrocloreto (DAB) (Kit Substrate DAB Peroxidase - VECTOR) por um período de 2 a 10 minutos, à temperatura ambiente.
RESULTADOS
Os dois fixadores utilizados forneceram bons resultados, preservando a estrutura celular. Observou-se que o calor provocou apenas leve encolhimento das células, enquanto que na fixação pela acetona a única alteração visível foi arredondamento das células. Entretanto, o calor foi considerado o melhor método devido ao tempo menor de execução do procedimento.
Entre os métodos de bloqueio testados e combinados aos dois fixadores utilizados, diferença visível ocorreu somente na fixação pelo calor, utilizando-se a soro albumina bovina (SAB) a 4% em PBS como bloqueador (Tab.1). Essa combinação manteve a estrutura celular bem preservada e resultou em menor reação inespecífica.
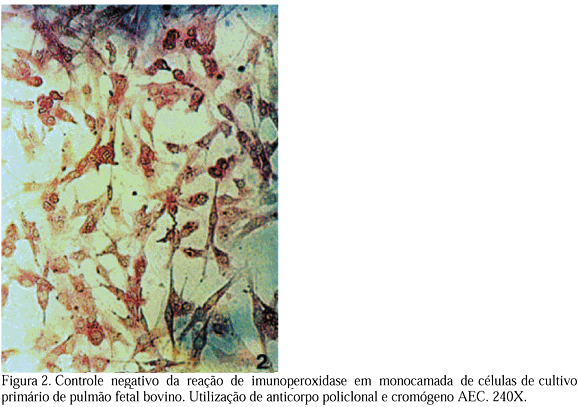
O resultado da reação de imunoperoxidase com o uso do anticorpo policlonal é mostrada na Fig. 1, onde o citoplasma de células positivas aparece fortemente corado de Na vermelho (cromógeno AEC), com aspecto granular e o núcleo permanece claro. Na Fig. 2 observa-se o controle negativo dessa reação, onde, por toda a monocamada, as células não inoculadas aparecem com coloração fraca e homogênea.
Com a utilização do cromógeno DAB o citoplasma das células infectadas tornou-se corado de marrom tendendo para o amarelo, enquanto o núcleo permaneceu claro e o controle negativo de células não infectadas apresentou-se com coloração amarelada homogênea. No processo de revelação da reação de IPM o melhor resultado foi obtido pelo cromógeno AEC.
A Tab. 2 apresenta os resultados do isolamento viral de segunda e quarta passagens para os fragmentos de órgãos do animal infectado experimentalmente e feto 1, utilizando-se a IPM padronizada para a identificação viral. Foram recuperadas somente amostras NCP a partir das amostras analisadas. Os resultados de terceira passagem foram inconclusivos devido à ocorrência de precipitado por toda a monocamada de células, impossibilitando a leitura das placas. A causa desse precipitado não foi identificada, porém esse fenômeno foi observado apenas nessa passagem.
DISCUSSÃO
O teste de imunoperoxidase forneceu um meio simples, rápido, eficiente e sensível para a detecção e identificação do VDBV. Quando comparada à imunofluorescência, a imunoperoxidase apresenta como vantagem a utilização de microscópio de luz visível, tornando-se por isso um método mais barato, com grande facilidade de leitura e interpretação, além da preservação permanente do material corado (Haines & Clark, 1991). Outra vantagem é que quando realizada em conjunto com o isolamento viral em monocamada de células semeadas em microplacas de 96 cavidades, a imunoperoxidase pode ser utilizada para testar grande número de amostras. Essa técnica tem sido empregada com sucesso para a identificação de animais PI em rebanhos sob o regime de programas de controle da DBV (Dubovi, 1996; Deregt & Prins, 1998). A imunoperoxidase também pode ser utilizada como excelente ferramenta para a detecção do VDBV como contaminante do SFB, de cultivos celulares e sêmen (Afshar et al., 1991; Oliveira et al., 1996).
O calor apresentou-se como o método de fixação mais rápido e eficiente e, visando utilizá-lo em procedimentos de rotina, pode ser considerado como o mais vantajoso. Segundo Lillie (1947) e Thompson (1966), o calor é um fixador que preserva a morfologia dos componentes do tecido, além de ser um método rápido de fixação. Embora também tenha se apresentado como um bom fixador, a acetona aumentou o tempo da técnica em 3 horas.
Neste estudo, das soluções de bloqueio utilizadas na monocamada de PFB fixada pelo calor, a SAB a 4% em PBS reduziu visivelmente (~ 20%) a reação inespecífica gerada pela ocorrência de ligação inespecífica quando se utilizou o Pab anti-VDBV de origem caprina e conjugado anti-IgG caprino peroxidase. A ocorrência de marcação inespecífica em imunoensaios utilizando anticorpo policlonal é bastante comum devido às condições inerentes à produção desses anticorpos. Essas marcações podem ser o resultado de uma série de reações, tais como reatividade cruzada do anticorpo secundário à IgG endógena, ligação não imunológica da peroxidase ao colágeno, atividade de peroxidase endógena, interações iônicas da avidina aos ânions do tecido, ligação da avidina à biotina endógena e ligação inespecífica da Ig total aos receptores Fc (Elias, 1990).
Nas condições avaliadas, tanto o anticorpo monoclonal quanto o policlonal identificaram o VDBV em cultivo celular, produzindo boa marcação citoplasmática específica. Embora o policlonal tenha gerado marcação inespecífica mais intensa do que o monoclonal, a qualidade e especificidade do teste não foram afetadas. Assim, para testes de rotina de diagnóstico, o anticorpo policlonal pode ser a opção adequada na prova de IPM, com diminuição de custos, redução no tempo de produção e maior facilidade metodológica de preparação.
O DAB é o cromógeno mais comumente utilizado para a detecção enzimática e é um dos mais sensíveis para a peroxidase (Harlow & Lane, 1988). Segundo Elias (1990), o uso de cromógenos alternativos tem sido menos atraente do que o do DAB. O produto formado pela reação com o AEC, por exemplo, é solúvel em água, pode desbotar com o tempo e há suspeita de ser carcinogênico. Entretanto, neste experimento, o melhor resultado foi obtido pela reação com o AEC devido ao maior contraste da cor vermelha do citoplasma com o núcleo claro, superior ao apresentado pela reação com o DAB.
O isolamento viral, revelado pela IPM padronizada neste trabalho, detectou com eficiência o VDBV nas amostras de órgãos do animal infectado experimentalmente. Como mostra a literatura, por meio de infecção experimental em bovinos pode-se isolar o VDBV de vários órgãos do animal em poucos dias pós-inoculação. Marshall et al. (1996) inocularam experimentalmente bovinos com a amostra NCP/VDBV e isolaram o agente 10 dias pós-inoculação em vários órgãos, como por exemplo, timo, baço, íleo, fígado, pulmões, rins e linfonodo mesentérico, entre outros. Os títulos virais mais altos foram encontrados no timo, linfonodo mesentérico, medula óssea, íleo e pulmões. Spagnuolo-Weaver et al. (1997), em estudo de infecção experimental aguda, recuperaram ambos os biótipos de VDBV de uma gama de tecidos tão cedo quanto 12 horas até oito dias pós-inoculação, e maior número de amostras continha o biótipo NCP. Segundo Bruschke et al. (1998), animais livres de VDBV inoculados experimentalmente com amostra NCP apresentaram no sétimo dia pós-inoculação altos títulos virais, principalmente, no íleo, incluindo placas de Peyer, outras partes dos intestinos, no baço, pulmões, timo e fígado.
Em relação ao feto infectado naturalmente (feto 1), o teste desenvolvido identificou de maneira eficaz o VDBV a partir do agrupamento de órgãos. Smith et al. (1988) isolaram o VDBV em 10 de 44 casos de aborto fetal bovino. Destes, sete eram NCP. Para Baszler et al. (1995), o VDBV foi isolado de cinco em cinco casos de aborto bovino a partir de múltiplos órgãos fetais. Muñoz et al. (1996), na Argentina, isolaram o VDBV de amostras de baço, rins, pulmões e fígado de fetos aparentemente sadios, coletados em abatedouro com rigoroso controle sanitário e encontraram alta prevalência de infecção fetal pelo VDBV. Thür et al. (1997) também utilizaram agrupamento de órgãos para o isolamento viral do VDBV, com todos os isolados identificados como amostras NCP, que é um achado comum para isolados de VDBV a partir de fetos (Muñoz et al., 1996).
Neste estudo, os resultados do IV do feto 1 identificados por DAB mostraram exemplo em que o agente infeccioso não foi detectado na segunda passagem e sim na quarta, o que pode ter ocorrido devido a longo período entre a morte fetal e a coleta do material ou às condições inadequadas de acondicionamento e transporte da amostra. Para os resultados referentes ao bezerro infectado experimentalmente, o IV foi eficaz nas duas passagens testadas, provavelmente devido ao período de sete dias transcorrido entre a inoculação e o sacrifício, e à conservação adequada das amostras. Segundo a literatura, após sete dias de infecção já é possível detectar, na maioria dos órgãos, alto título viral. Estes resultados mostram a importância de se conhecer o histórico da amostra e da doença no rebanho, além dos cuidados necessários à coleta e envio de material para o laboratório.
AGRADECIMENTOS
Ao Dr. Cláudio Wageck Canal do Centro de Biotecnologia da Universidade Federal do Rio Grande do Sul UFRGS, pela doação do anticorpo monoclonal Panpestivírus Mab PP DE9. Ao André Almeida Fernandes, funcionário do Departamento de Medicina Veterinária Preventiva da Escola de Veterinária UFMG, pelo trabalho fotográfico. À Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) pelo apoio financeiro. À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa concedida.
Recebido para publicação em 18 de outubro de 2001
Recebido para publicação, após modificações, em 7 de maio de 2002
- AFSHAR, A.; DULLAC, G.C.; DUBUC, C. et al. Comparative evaluation of the fluorescent antibody test and microtiter immunoperoxidase assay for detection of bovine viral diarrhea virus from bull semen. Can. J. Vet. Res., v.55, p.91-93, 1991.
- BASZLER, T.V.; EVERMANN, J.F.; KAYLOR, P.S. et al. Diagnosis of naturally occurring bovine viral diarrhea virus infections in ruminants using monoclonal antibody-based immunohistochemistry. Vet. Pathol., v.32, p.609-618, 1995.
- BRUSCHKE, C.J.M.; WEERDMEESTER, K.; VAN OIRSCHOT, J.T. et al. Distribution of bovine virus diarrhoea virus in tissues and white blood cells of cattle during acute infection. Vet. Microbiol., v.64, p.23-32, 1998.
- DEREGT, D.; PRINS, S. A monoclonal antibody-based immunoperoxidase monolayer (micro-isolation) assay for detection of type I and type II bovine viral diarrhea viruses. Can. J. Vet. Res., v.62, p.152 155, 1998.
- DUBOVI, E.J. Laboratory diagnosis of bovine viral diarrhea virus infections. Vet. Med., v.91, p.867872, 1996.
- ELAHI, S.M.; HARPIN, S.; CORNAGLIA, E. et al. Antigenic variation among bovine viral diarrhea virus (VDBV) strains an the role of different cell fixation methods in immunoassays. Can. J. Vet. Res., v.61, p.3438, 1997.
- ELIAS, J.M. Immunohistopathology: a practical aprroach to diagnosis. Chicago: ASCP, 1990. 526p.
- HAINES, D.M.; CLARK, E.G. Enzime immunohistochemical staining of formalin-fixed tissues for diagnosis in veterinary pathology. Can. Vet. J., v.32, p.295-302, 1991.
- HARLOW, E.; LANE, D. Antibodies: a laboratory manual. New York: Cold Spring Harbor, 1988. 726p.
- LEMOS, R.A.A.Diarréia viral bovina. In: PRINCIPAIS enfermidades de bovinos de corte do Mato Grosso do Sul: reconhecimento e diagnóstico. Campo Grande: Universidade Federal do Mato Grosso do Sul, 1998. p.226-258
- LILLIE, R.D. Histopathologic technique and practical histochemistry. New York: Country Life, Blakiston Company, 1947. Cap. 3: p.29-37, 47-48.
- MARSHALL, D.J.; MOXLEY, R.A.; KELLING, C.L. Distribution of virus and viral antigen in specific pathogen-free calves fllowing inoculation with noncytopathic bovine viral diarrhea virus. Vet. Pathol., v.33, p.311-318, 1996.
- MUŃOZ, D.P.; LAGER, I.A.; MERSICH, S. et al. Foetal infections with bovine viral diarrhoea virus in Argentina. Br. Vet. J., v.152, p.175-183, 1996.
- OLIVEIRA, L.G.; ROCHE, P.M.; OLIVEIRA, E.A.S. et al. Presença de pestivírus e anticorpos contra pestivírus em soros e cultivos celulares. Arq. Bras. Med. Vet. Zootec, v.48, p.513-523, 1996.
- SANDVIK, T. Laboratory diagnostic investigations for bovine viral diarrhhoea virus infections in cattle. Vet. Microbiol., v.64, p.123-134, 1999.
- SMITH, G.H.; COLLINS, J.K.; CARMAN, J. et al. Detection of cytopathic and noncytopathic bovine viral diarrhea virus in cell culture with na immunoperoxidase test. J. Virol. Meth., v.19, p.319-324, 1988.
- SPAGNUOLO-WEAVER, M.; ALLAN, G.M.; KENNEDY, S. et al. Distribution of cytopathic and noncytopathic bovine viral diarrhea virus antigens in tissues of calves following acute experimental infection. J. Vet. Diagn. Invest., v.9, p.287-297, 1997.
- THOMPSON, S.W. Selected histochemical and histopathological methods. Illinois: Thomas Publisher, 1966. p.3, 9-12.
- THÜR, B.; HILBE, M.; STRASSER, M. et al. Immunohistochemical diagnosis of pestivirus infection associated with bovine and ovine abortion and perinatal death. Am. J. Vet. Res., v.58, p.1371-1375, 1997.
- TREMBLAY, R. Transmission of bovine viral diarrhea virus. In: Symposium on bovine viral diarrhea virus. Vet. Med., v.91, p.858-866, 1996.
Datas de Publicação
-
Publicação nesta coleção
25 Mar 2003 -
Data do Fascículo
Dez 2002
Histórico
-
Revisado
07 Maio 2002 -
Recebido
18 Out 2001