Resumo
Methane, the main constituent of natural gas (> 85%), is employed in large scale as an energy source (thermoelectric power plants, automobiles, etc). However, significant quantities of this gas contribute to the greenhouse effect. The catalytic combustion of methane can minimize these emissions. Palladium is one of the metals that shows the highest activity, depending on the different active forms of the metal. In this article, we focus on the influence of particle size and pretreatment on the catalytic performance of palladium in the methane combustion reaction.
palladium catalyst; methane combustion; particle size
palladium catalyst; methane combustion; particle size
ARTIGO
Catalisador Pd/g-Al2O3: efeito do tamanho de partícula na atividade catalítica para combustão do CH4
Pd/g-Al2O3 catalyst: particle size effect in the catalytic ativity for CH4 combustion
Rogério Marcos DallagoI; Ione Maluf BaibichII; Carlos GigolaIII
IDepartamento de Química, Universidade Regional Integrada do Alto Uruguai e Missões, Av. Sete de Setembro, 1621, 99700-000 Erechim - RS
IIInstituto de Química, Universidade Federal do Rio Grande do Sul, Av. Bento Gonçalves, 9500, 91501-970 Porto Alegre - RS
IIIPlanta Piloto de Ingeniería Química, CC 717, 8000 Bahia Blanca, Argentina
ABSTRACT
Methane, the main constituent of natural gas (> 85%), is employed in large scale as an energy source (thermoelectric power plants, automobiles, etc). However, significant quantities of this gas contribute to the greenhouse effect. The catalytic combustion of methane can minimize these emissions. Palladium is one of the metals that shows the highest activity, depending on the different active forms of the metal. In this article, we focus on the influence of particle size and pretreatment on the catalytic performance of palladium in the methane combustion reaction.
Keywords: palladium catalyst; methane combustion; particle size.
INTRODUÇÃO
Entre os combustíveis fósseis empregados em larga escala, o metano, principal constituinte do gás natural (> 85%), é o que apresenta o menor índice de produção de poluentes atmosféricos (CO2, NOx, CH4 residual, etc) durante sua combustão. Propriedade esta vinculada a sua elevada relação H/C, maior entre os hidrocarbonetos, a qual lhe proporciona uma produção mínima de CO2, e aos baixos níveis de compostos sulfurosos e nitrogenados, contidos como impurezas. No entanto, devido ao seu elevado potencial de aquecimento global (24,5 vezes maior que o CO2), o metano é, depois do dióxido de carbono, o poluente atmosférico que mais contribui para o efeito estufa1-3.
A utilização do Gás Natural (GN) no Brasil começou modestamente na década de 40, com as descobertas de óleo e gás na Bahia. A descoberta e exploração da Bacia de Campos, no estado do Rio de Janeiro na década de 80, impulsionaram o uso do GN, elevando em 2,7% sua participação na matriz energética nacional. O Governo Federal tem como meta elevar a participação do GN dos atuais 3 para 12% até 20104. As principais aplicações são em plantas de geração de energia (centrais termoelétricas, caldeiras, etc ) e no transporte urbano; processos que proporcionam, como conseqüência de uma combustão incompleta, uma emissão de outros poluentes, como CO e CH4, além de CO2 e NOx. Uma minimização significativa nas emissões destes poluentes poderia ser obtida mediante o emprego da combustão catalítica do CH4, processo no qual todo o metano é consumido e apenas água e dióxido de carbono são gerados como produtos da reação5.
O emprego de turbinas a gás via combustão catalítica do metano já se encontra em fase de testes, com resultados animadores, principalmente em nível ambiental6,7. Além disso, os conversores catalíticos pós-ignição, utilizados principalmente em correntes de exaustão de origem automotiva, já fazem parte do nosso cotidiano.
No tocante a combustão catalítica do metano, o paládio é um dos metais que demonstraram os melhores resultados de atividade. Sua elevada aplicação, tanto em escala industrial quanto em escala laboratorial, deve-se principalmente às baixas temperaturas de combustão utilizadas; à baixa volatilidade das espécies de Pd, que podem estar presentes em condições de reação (metálica, óxidos, hidróxidos, etc ) e à sua elevada disponibilidade ambiental, com relativo baixo custo em relação a outros metais de similar atividade, como por ex. a Pt.
Diferentes formas ativas de paládio têm sido propostas para a combustão de CH4, tais como partículas de óxido de paládio altamente dispersas, cristais de Pd encobertos por uma camada de óxido, oxigênio quimissorvido em Pd e reconstrução do óxido de Pd em condições de reação8-13, considerando sempre a transformação reversível PdO«Pdº como a etapa fundamental na performance do paládio na combustão catalítica de metano.
Os catalisadores preparados neste trabalho, após serem exaustivamente caracterizados, foram avaliados cataliticamente para a reação de combustão de CH4 + O2, em condições estequiométricas, empregando diferentes pré-tratamentos e temperaturas reacionais. Os objetivos principais foram estudar a influência do tamanho médio das partículas de paládio e dos pré-tratamentos.
PARTE EXPERIMENTAL
Preparação
Os catalisadores monometálicos de paládio (Pd/gAl2O3) foram preparados por impregnação em solução, a partir de uma solução de acetilacetonato de paládio em tolueno. O suporte (gAl2O3-Rhone Poulenc, 96 m2/g) e a solução (1% Pd em relação ao suporte) foram deixados em contato à temperatura ambiente e sob agitação mecânica por um período de 24 h. Após este período, o líquido foi removido por filtração e o sólido seco em fluxo de N2. Posteriormente, o sólido foi calcinado em ar sintético a 350 ºC por 2 h, e reduzido em fluxo de H2 na mesma temperatura. O catalisador resultante deste processo foi denominado Pd.
Parte do sólido foi submetida a um processo de sinterização (redução em fluxo de H2 a 500 ºC por 10 h). O catalisador resultante deste processo foi denominado PdSint.
Caracterização
Análise química
O teor metálico foi obtido por espectroscopia de absorção atômica. A abertura das amostras (triplicata) foi conduzida por digestão ácida (HNO3 concentrado) em sistema aberto. As amostras foram digeridas em erlenmeyers aquecidos elétricamente, com 10 mL de HNO3 concentrado por 2 h. Ao resíduo úmido adicionaram-se 10 mL de água. A solução aquecida foi filtrada em papel quantitativo (previamente descontaminado) e transferida para um balão volumétrico de 25 mL.
Quimissorção de hidrogênio
As medidas de quimissorção de H2 foram conduzidas, à temperatura ambiente, em um equipamento volumétrico, empregando pulsos com diferentes pressões de H2 (60 270 torr). As amostras foram previamente tratadas em fluxo de H2 a 300 ºC por 1 h, e sob vácuo na mesma temperatura durante 18 h, seguido de resfriamento, em vácuo, a 25 ºC. Mediram-se duas isotermas e adsorção, seguindo o método descrito por Benson e Boudart14. A segunda isoterma foi obtida após 30 min sob vácuo a 25 ºC. A fração de paládio exposta (dispersão - PdS/PdT) foi calculada a partir da diferença entre as duas isotermas extrapoladas à pressão nula, assumindo uma razão Hirrev./Metal de 1:1.
Microscopia Eletrônica de Transmissão (MET)
O diâmetro médio das partículas de Pd e a distribuição de tamanho das mesmas foram determinados empregando-se um microscópio eletrônico de transmissão JEOL 100 CX, com resolução de 3 nm, operando a uma voltagem de aceleração de 100 kV e com amplificação útil do sinal de aproximadamente 73000x (CRIBABB). O diâmetro médio foi calculado em relação área-volume (Equação 1) permitindo, desta forma, sua comparação com os resultados obtidos por quimissorção de H2.
Espectroscopia no infravermelho de CO adsorvido
Os ensaios foram conduzidos em espectrofotômetro de absorção no infravermelho com transformada de Fourier (Nicolet 20 DXB), com resolução de 4 cm-1, equipado com uma câmara de aço inoxidável com janelas de CaF2, que permite a realização de tratamentos in situ. Os catalisadores (25 mg), depois de moídos e prensados (5 tons/cm2) em pastilhas de 10 mm de diâmetro, foram individualmente acoplados a um suporte especial e introduzidos na câmara do espectrômetro, onde foram submetidas a distintos tratamentos: redução em fluxo de H2 a 300 ºC por 30 min, resfriamento em fluxo de He até a temperatura ambiente e vácuo por 30 min. Previamente à introdução de CO registrou-se um espectro de absorção no infravermelho da superfície reduzida, para ser empregado como referência. As amostras foram postas em contato com CO, à temperatura ambiente e pressão de 0,7 torr, que garante o recobrimento total da superfície metálica15. Os espectros de absorção no infravermelho foram registrados depois de 5 min de contato e vácuo por 2 min. As bandas correspondentes ao CO adsorvido foram obtidas subtraindo-se o espectro de referência dos espectros das amostras obtidos após 2 min de vácuo.
Redução a Temperatura Programada (RTP)
Os ensaios de RTP foram conduzidos em reator de vidro pirex (1/4") localizado no interior de um forno vertical operável até 550 ºC, conectado a um programador eletrônico de temperatura [-50 a 550 ºC (b =1 a 20 ºC/min)]. A saída do reator encontrava-se conectada em série a um detector de condutividade térmica, que mede o conteúdo de hidrogênio na corrente redutora antes e depois da reação. A diferença na concentração de H2 é registrada em função da temperatura, obtendo-se um perfil de redução. Como gás redutor foi empregada uma mistura composta por 5% H2 em Ar, purificada através de um filtro de MnO para eliminação de traços de O2.
Previamente às reduções, as amostras (75 mg) foram oxidadas em ar sintético a 350 ºC por 1 h.
Ensaios catalíticos
Os ensaios catalíticos foram conduzidos em fluxo, em reator tubular (d.i. 0,6 mm) de vidro pirex, acondicionado no interior de forno elétrico com controle eletrônico da temperatura. A reação de combustão de CH4 foi estudada entre 200 e 450 ºC, à pressão atmosférica, empregando-se uma mistura composta por 1% CH4 e 2% de O2 em argônio (condições estequiométricas - CH4/O2 = 0,5). A influência do pré-tratamento sobre as propriedades catalíticas foi analisada a 335 ºC. Previamente aos ensaios, os catalisadores foram tratados em atmosfera de ar sintético ou de H2, na mesma temperatura reacional (335 ºC), por um período de 30 min. Após uma purga em He, os catalisadores foram submetidos à reação até obter um nível de conversão considerado estacionário. Os produtos da reação foram analisados por cromatografia gasosa com detecção condutimétrica (110 ºC/80 mA). Uma coluna tipo peneira molecular 5 Å (80/100 mesh), operando isotermicamente a 60 ºC, foi usada para separação. A atividade catalítica foi calculada em função da diminuição da área do sinal de CH4.
RESULTADOS E DISCUSSÃO
Caracterização
A Tabela 1 apresenta os valores referentes ao teor metálico, dispersão (fração de paládio exposto) e diâmetros médios de partículas de Pd (dp), determinados a partir dos resultados de quimissorção de H2 e por MET.
O catalisador de partida Pd apresenta uma dispersão de 0,66, ou seja, 66% do total dos átomos de paládio encontram-se expostos na superfície de suas partículas (dp = 1,7 nm).
O catalisador PdSint apresenta uma significativa redução da dispersão (@ 40%) em relação ao catalisador Pd, a partir do qual foi preparado mediante um tratamento em H2 a 550 ºC por um período de 10 h (sinterização). As elevadas temperaturas, associadas à atmosfera redutora, favorecem a migração das partículas de paládio na superfície do catalisador, as quais tendem a se aglomerar, reduzindo a superfície metálica disponível. A sinterização é um processo físico vinculado a distintas propriedades do catalisador, tais como o tamanho dos cristais de paládio, a temperatura de redução e, principalmente, as irregularidades da superfície do suporte, uma vez que estas afetam diretamente as interações entre este e o metal. Em alguns casos é a localização da partícula, e não o seu tamanho, o que afeta a mobilidade da mesma. Levando em conta que a dispersão varia inversamente ao tamanho das partículas, a diminuição no valor de dispersão observada para o catalisador PdSint (0,40) traduz-se como um aumento no tamanho médio das partículas de paládio (dp = 2,8 nm).
Esta mesma diferença de tamanho médio de partícula (» 40%) também foi observada para os valores obtidos por microscopia eletrônica de transmissão. A diferença entre os tamanhos médios de partícula, obtidos por MET, e os calculados a partir dos valores de quimissorção de H2 também foi observada, em mesma magnitude (» 75%), por Pisanu16 e Volpe17. Estes autores atribuíram esta diferença à presença de pequenas partículas de paládio, cujo tamanho encontra-se abaixo do limite de resolução do microscópio (< 3 nm), não detectáveis por MET, porém ativas nas medidas de quimissorção.
A Figura 1 representa o espectro de absorção no infravermelho de CO adsorvido. A exibição de mais de uma banda de adsorção a distintas freqüências de vibração indica que o catalisador se apresenta distribuído heterogeneamente18. As duas bandas observadas na Figura 1 são características do CO adsorvido sobre Pd: uma banda estreita a 2078 cm-1, vinculada ao CO linearmente adsorvido sobre 1 átomo de Pd, e uma ampla banda a freqüências menores, entre 1996 e 1750 cm-1, atribuída ao CO multiplamente coordenado, vinculado a dois ou mais átomos de Pd19-23. As bandas observadas abaixo de 1750 cm-1 foram vinculadas a espécies tipo carbonato (CO2), adsorvidas sobre o suporte (Al2O3)24.
O catalisador PdSint apresenta, em relação ao seu precursor (Pd), significativas variações nas intensidades de ambas bandas, a 2078 e entre 1996-1750 cm-1 (Figura 1). Considerando que maiores partículas favorecem a adsorção do CO em ponte, em relação à do CO linear, ambas variações diminuição da banda referente ao CO linearmente adsorvido e aumento da banda referente ao multiplamente coordenado (Tabela 2) estão coerentes com o aumento do tamanho das partículas de paládio observados por MET e quimissorção de H2 (Tabela 1) para o catalisador PdSint.
Os perfis de redução à temperatura programada obtidos para os catalisadores Pd e PdSint (Figura 2) são característicos de paládio: um pico de consumo de H2 entre 25 e 50 ºC, correspondente a redução do óxido de paládio e formação da fase b-hidreto (reações que ocorrem em conjunto nesta faixa de temperatura), seguido por sinais de dessorção de H2, entre 50 e 100 ºC, vinculados à decomposição da fase b-hidreto25.
O catalisador PdSint apresenta, para sinal de consumo de H2, em relação ao seu precursor (Pd), uma tendência de deslocamento a temperaturas maiores de seu máximo de redução (8 ® 15 ºC) e um alargamento do sinal, característicos de alterações na morfologia das partículas de paládio, mais precisamente no seu tamanho26. O aumento no tamanho de partícula para o catalisador PdSint, em relação ao Pd, evidenciado pelas outras técnicas (quimissorção de H2, microscopia eletrônica de transmissão e espectroscopia no infravermelho de CO adsorvido), é melhor visualizado na região do perfil de redução atribuída à dessorção da fase b-hidreto (região pintada na Figura 2). Sendo que a quantidade de H2 quimissorvido para formação da fase b-hidreto, onde o H2 está ocupando posições intersticiais da rede estrutural da partícula de Pd, é proporcional ao tamanho das partículas de Pd27, a maior depressão, ou seja, o maior sinal de dessorção de H2 observado para o catalisador PdSint está vinculado a um aumento do tamanho médio de suas partículas de paládio.
Ensaios catalíticos
Influência do pré-tratamento
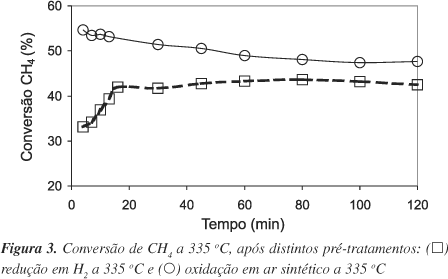
A Figura 3 apresenta a evolução dos valores de combustão de CH4 em função do tempo reacional para o catalisador PdSint após ser submetido a diferentes pré-tratamentos, realizados in situ.
Após tratamento em atmosfera redutora de H2, a conversão de CH4, inicialmente baixa, aumenta com o tempo até alcançar um estado de conversão estacionária (» 40%), em aproximadamente 50 min. O comportamento da amostra oxidada em ar sintético foi diferente. Neste caso, o catalisador apresenta uma atividade inicial levemente superior à obtida para o estado estacionário.
De acordo com Solymosi e colaboradores28, o mecanismo reacional pode ocorrer em concordância com a teoria de Cabrera-Mott29, onde a etapa crítica do mecanismo é a adsorção dissociativa do metano em sítios com disponibilidade eletrônica, ou seja, em átomos de Pd reduzido. Os fragmentos {H e CHx (x = 13)} produzidos neste processo atuariam como redutores de outros sítios PdO superficiais próximos.
No entanto, os resultados obtidos para as amostras reduzidas sugerem que a combustão do CH4 ocorre via mecanismo Redox30, onde o O2 atua como agente oxidante do paládio superficial, produzindo uma superfície ativa de sítios PdO que é, posteriormente, reduzida pelo CH4.
Para a amostra previamente reduzida constatou-se para a etapa inicial do ensaio (anterior à fase estacionária), através do balanço de massa, um consumo de O2 superior a estequiométrica em relação à quantidade de metano oxidada. Este excesso de oxigênio consumido sugere a reoxidação dos átomos de paládio, reconstruindo sua superfície ativa (PdO). Nesta etapa do ensaio observa-se um significativo aumento da atividade com o tempo (Figura 3). A reconstrução das partículas de Pd em condições reacionais tem sido proposta por Garbowski e colaboradores26 para explicar o aumento da atividade para combustão de metano sobre o paládio oxidado.
Efeito da temperatura de reação
A atividade dos catalisadores para a reação de combustão CH4+O2 (1:2) foi avaliada entre 250 e 420 ºC, região com conversão compreendida entre 5 e 100% (Figura 4). Previamente à reação, os catalisadores foram submetidos in situ a tratamento em atmosfera reacional a 470 ºC por um período de 1 h.
Observa-se uma significativa diferença de atividade entre os dois catalisadores ensaiados. O catalisador PdSint apresentou melhores resultados de atividade em todos os intervalos de temperatura avaliados. Uma visualização mais precisa desta diferença pode ser obtida em termos de velocidade de reação.
As velocidades de reação de combustão do CH4 a 300 ºC, para os diferentes catalisadores estudados, encontram-se representadas na Tabela 3.
A Tabela 3 apresenta dois valores distintos para a velocidade de reação: um que considera apenas os átomos de paládio superficiais (TOF), obtidos por quimissorção de H2 e outro, que considera os átomos de Pd total (RATE) como ativos para a reação de combustão do CH4. Em ambos os casos observa-se uma aumento significativo de atividade para o catalisador PdSint, em relação ao seu precursor Pd.
Destes, os valores de TOF não serão considerados, uma vez que a fração de paládio exposta (dispersão) é obtida com o catalisador no estado reduzido (Pdº), condição oposta ao estado oxidado (PdO) e em constante reconstrução das partículas de paládio, observados em condições reacionais.
Esta mesma situação, usar uma propriedade obtida com o catalisador reduzido, sabendo-se que em condições reacionais o Pd se encontra na forma oxidada, foi considerada por Urbano e colaboradores31 ao concluírem que não há conexão entre velocidade de reação e a dispersão de um catalisador.
Considerando-se a velocidade global (RATE), a diferença observada entre os dois catalisadores (PdSint >Pd.), que apresentam distintos tamanhos de partículas de paládio (PdSint / Pd » 2), está condizente com a literatura. Müller e colaboradores11, estudando a reação de combustão catalítica de CH4 com Pd, observaram que ao dobrar o tamanho de suas partículas, o catalisador apresentava um aumento significativo em sua velocidade de reação (3 a 7 vezes maior, conforme a temperatura de reação empregada). O aumento do tamanho das partículas, devido à sobreposição das camadas de átomos de paládio, proporciona uma minimização na influência do suporte sobre os átomos de Pd mais externos, alterando a força da ligação Pd-O. Esta mudança na intensidade da ligação Pd-O favorece a transformação reversível PdO«Pdº, considerada a etapa fundamental na performance do paládio na combustão catalítica de metano8-13.
CONCLUSÕES
Os resultados de combustão de metano apresentados são consistentes com um modelo no qual os átomos superficiais e internos das amostras reduzidas se transformam em ativos para a combustão de CH4 em condições de reação, sugerindo que todo o paládio presente no catalisador participa da reação.
As maiores conversões observadas para o catalisador PdSint, em relação ao seu precursor (Pd), demostram que o tamanho das partículas de paládio influencia de maneira significativa na performance catalítica do paládio para a reação de combustão do metano.
Os resultados obtidos empregando diferentes pré-tratamentos, principalmente para amostras reduzidas, sugerem que a combustão do CH4 ocorre via o mecanismo Redox, onde o O2 atua como agente oxidante do paládio superficial, produzindo uma superfície ativa de sítios Pd-O, que é posteriormente reduzida pelo CH4.
AGRADECIMENTOS
À FAPERGS, CAPES, COPESUL, CONICET (Ar) e PLAPIQUI (Ar).
2. Lercher, J. A.; Bitter, J. H.; Steghuis, A. G.; van Ommen, J. G.; Seshan, K. Em ref. 1, cap. 6.
Recebido em 4/5/04; aceito em 28/3/05; publicado na web em 24/8/05
- 1. Lunsford, J. H. Em Environmental Catalysis; Janssen, F. J. J. G.; van Santen, R. A., eds.; Catalytic Science Series - Netherlands Institute for Catalysis Research, 1999, vol. 1, cap. 5.
- 3. Oh, S. H.; Mitchell, P. J.; Siewert, R. M. Em Catalytic Control of Air Pollution Mobile and Stationary Sources; Silver, R. G.; Sawyer, J. E.; Summers, J. C., eds.; ACS Symp. Series 495, Am. Chem. Soc., 1992, cap. 2.
- 4. http://www.gasenergia.com.br/portal/gasnatural, acessada em Agosto 2002.
- 5. Trimm, D. L.; Appl. Catal. 1983, 7, 249.
- 6. Forzatti, P.; Groppi, G.; Catal. Today 1999, 54, 165.
- 7. Flin, D.; Modern Power Systems 1999, April, 27.
- 8. Carstens, J. N.; Su, S. C.; Bell, A. T.; J. Catal. 1998, 176, 136.
- 9. Briot, P.; Auroux, A.; Primet M.; Appl. Catal. 1990, 59, 141.
- 10. Groppi, G.; Cristiani, C.; Lietti, L.; Forzatti, P.; Stud. Surf. Sc. Catal. 2000, 130, 3801.
- 11. Müller, C. A.; Maciejewski, M.; Koeppel R. A.; Baikar A.; Catal. Today 1999, 47, 245.
- 12. Farrauto, R. J.; Hobson, M. C.; Kennelly, T.; Waterman, E.; Appl. Catal. 1992, 227, 81.
- 13. Farrauto, R. J.; Lampert, J.; Hobson, M.C.; Waterman, E.; Appl. Catal., B 1995, 6, 263.
- 14. Benson, J.; Boudart, M.; J. Catal. 1965, 4, 704.
- 15. Sica, A.; Bodnariuk, P.; VI Jornadas Argentinas de Catálisis, Córdoba, Argentina, 1987.
- 16. Pisanu, A.; Tesis Doctoral en Ingeniería Química, Universidad Nacional del Sur, Argentina, 1997.
- 17. Volpe, M.; Tesis Doctoral en Ingeniería Química, Universidad Nacional del Sur, Argentina, 1991.
- 18. Hsiao, E. C.; Falconer, J. L.; J. Catal 1991, 132, 145.
- 19. Gaspar, A. B.; Dieguez, L. C.; Anais Assoc. Bras. Quím. 1997, 46, 54.
- 20. Bonzon-Verduraz, F.; Tessier, D.; Rakai, A.; J. Catal. 1991, 127, 457.
- 21. Hoffmann, F.; Surf. Scienc. Reports 1983, 3, 107.
- 22. Hoffmann, F.; Ortega, A.; Bradsshaw, A.; Surf. Sci. 1982, 119, 79.
- 23. Pitchon, V.; Primet, M.; Praliand, H.; Appl. Catal. 1990, 62, 317.
- 24. Morterra, C; Magnacca, G.; Catal. Today 1996, 27, 497.
- 25. Hurst, N. W.; Gentry, S. J.; Jones, A.; McNicol, B. D.; Catal. Rev. Sci. Eng. 1982, 24, 233.
- 26. Garbowsky, E.; Feumi-Jantou, C.; Mouaddib, N.; Primet, M.; Appl. Catal., A 1994, 109, 277.
- 27. Benson, J.; Hwang, H.; Boudart, M.; J. Catal. 1973, 39, 146.
- 28. Solymosi, F, Erdöhelyi, A.; Cserényi, F.; J. Catal. 1994, 147, 272.
- 29. Fromhold, A. T.; Theory of Metal Oxidation Fundamentals, North-Holland, Amsterdam, 1976, vol. 1, p. 7.
- 30. Mars, P.; van Krevelen, D. W.; Chem. Eng. Sci. Suppl. 1954, 3, 41.
- 31. Urbano, F.; Burch, R.; Appl. Catal., A 1995, 124, 121.
Datas de Publicação
-
Publicação nesta coleção
12 Dez 2005 -
Data do Fascículo
Dez 2005
Histórico
-
Recebido
04 Maio 2004 -
Aceito
28 Mar 2005