Resumos
Este trabalho teve como objetivo a obtenção de híbridos somáticos entre o limão 'Cravo' (Citrus limonia Osbeck) e a tangerina 'Cleópatra' (Citrus reshni Hort.), para serem usados como porta-enxertos de citros. O limão 'Cravo' é atualmente o principal porta-enxerto comercial utilizado no Brasil, em virtude de suas boas qualidades agronômicas. Entretanto, é suscetível ao "declínio" dos citros, doença responsável pela eliminação anual de milhões de plantas cítricas no Brasil. A tangerina 'Cleópatra' é uma espécie bastante utilizada como porta-enxerto em outros países e tem sido descrita na literatura como tolerante ao "declínio". Protoplastos de suspensões celulares embriogênicas e protoplastos derivados de tecidos foliares foram utilizados para fusão com solução de PEG (50%) e posterior cultivo em agarose. A porcentagem de obtenção de células híbridas interespecíficas logo após a fusão, variou entre 5,1% e 6,8%. Foram obtidas mais de 500 plantas a partir de produtos de fusão cultivados em gotas de agarose. No total de 180 plantas avaliadas, 11 híbridos somáticos foram discriminados e confirmados, utilizando-se marcadores moleculares RAPD e isoenzimáticos (sistemas PO, IDH e PGI). Seis plantas foram aclimatizadas, plantadas no solo e estão sendo multiplicadas por estaquia para avaliação futura como porta-enxertos de citros.
protoplastos; marcador genético; polimorfismo genético; porta-enxerto; citros
The aim of this work was to obtain somatic hybrids between 'Rangpur' lime (Citrus limonia Osbeck) and 'Cleópatra' mandarin (Citrus reshni Hort.), to be used as a citrus rootstock. 'Rangpur' lime is the most important Brazilian citrus rootstock due to its higher horticultural performance. Nevertheless, this species is susceptible to blight disease, which is responsible for the death of millions of productive trees per year in Brazil. 'Cleópatra' mandarin has become an increasingly important rootstock in other countries and has been reported as being tolerant to citrus blight disease. Leaf protoplasts and protoplasts from embryogenic cell suspension cultures were fused using PEG solution (50%) and further cultivation in agarose. The frequency of heterokaryon formation was 5.1% to 6.8%. More than 500 plants were regenerated from these fusion experiments and 180 were tested. Among them, 11 plants were confirmed to be a somatic hybrid by means of molecular markers (RAPD) and isoenzymes markers (PO, IDH and PGI systems). Six plants were acclimatized, planted in the soil and have been multiplied by cuttings in order to evaluate their potential as citrus rootstocks.
protoplasts; genetic markers; genetic polymorphism; rootstocks; citrus
Obtenção de híbridos somáticos de limão 'Cravo' e tangerina 'Cleópatra'1 1 Aceito para publicação em 8 de agosto de 2002. 2 Universidade de São Paulo (USP), Centro de Energia Nuclear na Agricultura (Cena), Caixa Postal 96, CEP 13400-970 Piracicaba, SP. Bolsista da Fapesp. E-mail: rrlatado@cena.usp.br 3 USP-Cena. E-mail: mtvcderb@cena.usp.br, tsai@cena.usp.br, tulmannneto@cena.usp.br
Somatic hybridization between 'Rangpur' lime and 'Cleópatra' mandarin
Rodrigo Rocha LatadoI, 2 1 Aceito para publicação em 8 de agosto de 2002. 2 Universidade de São Paulo (USP), Centro de Energia Nuclear na Agricultura (Cena), Caixa Postal 96, CEP 13400-970 Piracicaba, SP. Bolsista da Fapesp. E-mail: rrlatado@cena.usp.br 3 USP-Cena. E-mail: mtvcderb@cena.usp.br, tsai@cena.usp.br, tulmannneto@cena.usp.br ; Maria Teresa Vitral de Carvalho DerbyshireII, 3 1 Aceito para publicação em 8 de agosto de 2002. 2 Universidade de São Paulo (USP), Centro de Energia Nuclear na Agricultura (Cena), Caixa Postal 96, CEP 13400-970 Piracicaba, SP. Bolsista da Fapesp. E-mail: rrlatado@cena.usp.br 3 USP-Cena. E-mail: mtvcderb@cena.usp.br, tsai@cena.usp.br, tulmannneto@cena.usp.br ; Siu Mui TsaiII, 3 1 Aceito para publicação em 8 de agosto de 2002. 2 Universidade de São Paulo (USP), Centro de Energia Nuclear na Agricultura (Cena), Caixa Postal 96, CEP 13400-970 Piracicaba, SP. Bolsista da Fapesp. E-mail: rrlatado@cena.usp.br 3 USP-Cena. E-mail: mtvcderb@cena.usp.br, tsai@cena.usp.br, tulmannneto@cena.usp.br ; Augusto Tulmann NetoII, 3 1 Aceito para publicação em 8 de agosto de 2002. 2 Universidade de São Paulo (USP), Centro de Energia Nuclear na Agricultura (Cena), Caixa Postal 96, CEP 13400-970 Piracicaba, SP. Bolsista da Fapesp. E-mail: rrlatado@cena.usp.br 3 USP-Cena. E-mail: mtvcderb@cena.usp.br, tsai@cena.usp.br, tulmannneto@cena.usp.br
IUniversidade de São Paulo (USP), Centro de Energia Nuclear na Agricultura (Cena), Caixa Postal 96, CEP 13400-970 Piracicaba, SP. Bolsista da Fapesp
IIUSP-Cena
Endereço para correspondência Endereço para correspondência Rodrigo Rocha Latado E-mail: rrlatado@cena.usp.br
RESUMO
Este trabalho teve como objetivo a obtenção de híbridos somáticos entre o limão 'Cravo' (Citrus limonia Osbeck) e a tangerina 'Cleópatra' (Citrus reshni Hort.), para serem usados como porta-enxertos de citros. O limão 'Cravo' é atualmente o principal porta-enxerto comercial utilizado no Brasil, em virtude de suas boas qualidades agronômicas. Entretanto, é suscetível ao "declínio" dos citros, doença responsável pela eliminação anual de milhões de plantas cítricas no Brasil. A tangerina 'Cleópatra' é uma espécie bastante utilizada como porta-enxerto em outros países e tem sido descrita na literatura como tolerante ao "declínio". Protoplastos de suspensões celulares embriogênicas e protoplastos derivados de tecidos foliares foram utilizados para fusão com solução de PEG (50%) e posterior cultivo em agarose. A porcentagem de obtenção de células híbridas interespecíficas logo após a fusão, variou entre 5,1% e 6,8%. Foram obtidas mais de 500 plantas a partir de produtos de fusão cultivados em gotas de agarose. No total de 180 plantas avaliadas, 11 híbridos somáticos foram discriminados e confirmados, utilizando-se marcadores moleculares RAPD e isoenzimáticos (sistemas PO, IDH e PGI). Seis plantas foram aclimatizadas, plantadas no solo e estão sendo multiplicadas por estaquia para avaliação futura como porta-enxertos de citros.
Termos de indexação: protoplastos, marcador genético, polimorfismo genético, porta-enxerto, citros.
ABSTRACT
The aim of this work was to obtain somatic hybrids between 'Rangpur' lime (Citrus limonia Osbeck) and 'Cleópatra' mandarin (Citrus reshni Hort.), to be used as a citrus rootstock. 'Rangpur' lime is the most important Brazilian citrus rootstock due to its higher horticultural performance. Nevertheless, this species is susceptible to blight disease, which is responsible for the death of millions of productive trees per year in Brazil. 'Cleópatra' mandarin has become an increasingly important rootstock in other countries and has been reported as being tolerant to citrus blight disease. Leaf protoplasts and protoplasts from embryogenic cell suspension cultures were fused using PEG solution (50%) and further cultivation in agarose. The frequency of heterokaryon formation was 5.1% to 6.8%. More than 500 plants were regenerated from these fusion experiments and 180 were tested. Among them, 11 plants were confirmed to be a somatic hybrid by means of molecular markers (RAPD) and isoenzymes markers (PO, IDH and PGI systems). Six plants were acclimatized, planted in the soil and have been multiplied by cuttings in order to evaluate their potential as citrus rootstocks.
Index terms: protoplasts, genetic markers, genetic polymorphism, rootstocks, citrus.
Introdução
Apesar de ser extremamente competitiva, a citricultura brasileira apresenta limitações. Atualmente, mais de 80% das plantas cítricas estão enxertadas sobre um único porta-enxerto, o limão 'Cravo' (Citrus limonia Osbeck) (Pompeu Junior, 2001). Esse porta-enxerto tem sido largamente utilizado por suas características agronômicas superiores, tais como: precocidade na formação das mudas, compatibilidade com todas as variedades de copa, alta produção, resistência à seca e tolerância à tristeza. No entanto, apresenta alta suscetibilidade ao "declínio" dos citros, doença que tem causado a eliminação de milhões de plantas cítricas por ano, no Brasil (Pompeu Junior, 2001).
Outras espécies do gênero Citrus e de gêneros afins têm sido testadas como porta-enxertos (Pompeu Junior, 1991). A tangerina 'Cleópatra' (Citrus reshni Hort.), descrita na literatura como tolerante ao "declínio" (Grosser et al., 1990; Guirado et al., 1991), tem sido bastante utilizada como porta-enxerto em outros países e, mais recentemente, no Brasil. Entretanto, apresenta algumas características indesejáveis quando usada como porta-enxerto, como a alta suscetibilidade a nematóides, a Phytophthora e baixa produção em plantas jovens (Grosser et al., 1990).
Híbridos interespecíficos de citros podem ser obtidos via cruzamentos controlados, mas com limitações, por causa de problemas da biologia reprodutiva do gênero e da longa fase juvenil (Grosser & Gmitter Junior, 1990). A obtenção de híbridos somáticos interespecíficos e intergenéricos em Citrus, via fusão de protoplastos, pode resultar na produção de porta-enxertos mais promissores, pela possibilidade de combinar características desejáveis de duas espécies. Utilizando essa estratégia, Grosser et al. (1992, 1994, 1998a) e Louzada et al. (1992) relataram a obtenção de 29 novos híbridos somáticos entre espécies de porta-enxertos de citros, já em fase experimental no campo na Flórida (EUA), para a avaliação do potencial como novos porta-enxertos.
Em geral, os protoplastos de citros têm sido cultivados na forma de meio líquido (Grosser et al., 1992, 1994; Louzada et al., 1992; Mourão Filho et al., 1996), mas o cultivo em meio semi-sólido com agarose também já foi descrito por Kobayashi et al. (1988) e Ohgawara et al. (1991).
Plantas regeneradas a partir de suspensões de protoplastos embriogênicos, de origem nucelar, de limão 'Cravo' e tangerina 'Cleópatra' e posteriormente aclimatizadas, foram obtidas por Latado et al. (1999).
O objetivo deste trabalho foi obter híbridos somáticos entre o limão 'Cravo' e a tangerina 'Cleópatra' para serem usados como porta-enxertos de citros.
Material e Métodos
O método usado na obtenção de protoplastos foi o mesmo utilizado por Latado et al. (1999), com modificações para adequação às fontes de material vegetal utilizado.
Os experimentos de fusão de protoplastos de limão 'Cravo' e tangerina 'Cleópatra' foram realizados utilizando-se protoplastos de duas fontes, de mesofilo foliar (cor verde) e de suspensões celulares embriogênicas (cor branca).
Os protoplastos de mesofilo foliar foram isolados a partir de plantas cultivadas in vitro em meio semi-sólido MT (Murashige & Tucker, 1969), obtidas a partir de semeadura in vitro. Folhas jovens foram destacadas, cortadas em tiras e colocadas em 4 mL de solução enzimática por 14 a 16 horas, sob agitação de 50 rpm, no escuro e a 27oC. A solução enzimática usada na obtenção de protoplastos foi a mesma utilizada por Latado et al. (1999). A esterilização foi feita por ultrafiltração (0,22 mm).
Suspensões celulares embriogênicas, originadas a partir de calos nucelares, foram cultivadas em meio MT líquido, acrescido de 50 g L-1 de sacarose e 0,5 g L-1 de extrato de malte. Essas suspensões foram utilizadas como fonte de protoplastos embriogênicos. Na obtenção de protoplastos, foi utilizado 0,5 g de material em suspensão celular filtrada, adicionada a 4 mL de solução enzimática. Os protoplastos de suspensão celular foram isolados durante oito horas, em condições semelhantes às dos protoplastos de mesofilo foliar, de acordo com Latado et al. (1999).
Protoplastos de ambas as espécies foram purificados separadamente por meio de filtração (filtro de náilon, poro de 58 mm), seguido da adição de solução CPW (cell protoplast wash) (0,7 M de manitol), centrifugação a 700 rpm por cinco minutos e eliminação do sobrenadante. Em seguida, foram ressuspensos em 8 mL de solução CPW e quantificados de forma semelhante ao citado por Latado et al. (1999).
Na fusão, aproximadamente 16x105 protoplastos de cada uma das duas espécies foram adicionados em tubos de vidro, centrifugados a 700 rpm, por quatro minutos. O sobrenadante foi eliminado e adicionados 4 mL de solução de PEG (50% de polietileno glicol (peso molecular 1.540 g mol-1); 5 mM de KH2PO4; 100 mM CaCl2; pH 5,7). Os experimentos de fusão foram monitorados, com uso de microscópio ótico invertido, momentos após a fusão, para avaliação da freqüência de formação de células híbridas. Após 15 minutos, a solução de PEG foi removida por meio de três lavagens com solução CPW.
Os produtos da fusão foram cultivados na forma de gotas de agarose (volume de 0,2 mL), utilizando-se na solução agarose tipo VII (0,6%) e meio KM8P (Gilmour et al., 1989), em placas de Petri de 6 cm de diâmetro. A densidade final de cultivo foi de 4x105 protoplastos por mL de meio de cultivo. Após a solidificação das gotas de agarose/meio de cultivo, adicionou-se na placa de Petri o meio de banho BH3 (Grosser & Gmitter Junior, 1990). As placas de Petri foram mantidas no escuro e a 27oC.
A redução da osmolaridade do meio de banho foi realizada a cada 15 dias, utilizando-se a mistura dos meios BH3 e MT líquido, nas seguintes proporções: 3:1; 2:1; 1:1; 0:1. Após 60 dias de cultivo, as microcolônias com tamanho aproximado de 1 mm de diâmetro foram transferidas para meio MT semi-sólido sem reguladores de crescimento, sob condições de baixa intensidade luminosa (16 W m-2), fotoperíodo de 16 horas de luz e a 27oC.
Algumas microcolônias se desenvolveram e resultaram em calos. Esses calos foram mantidos nas mesmas condições de cultivo durante mais dois meses até o desenvolvimento dos embriões somáticos. A germinação dos embriões e o desenvolvimento das plantas realizaram-se de acordo com Latado et al. (1999).
As plantas obtidas foram transferidas e mantidas em meio MT semi-sólido sem reguladores de crescimento, até a realização dos experimentos de identificação dos híbridos somáticos, com o uso de marcadores moleculares RAPD (Random Amplified Polymorphic DNA).
Plantas com número mínimo de seis folhas foram utilizadas nesses experimentos. O DNA genômico de plantas cultivadas in vitro foi extraído conforme Edwards et al. (1991). As amplificações realizaram-se segundo o programa correspondente a 45 ciclos de 1 minuto a 94oC; 1 minuto a 37oC, e 2 minutos a 72oC, e extensão final de 5 minutos a 72oC. A eletroforese foi realizada em gel de agarose a 1,4%, seguido de coloração durante 20 minutos, por imersão em solução aquosa contendo 1 mg mL-1 de brometo de etídio.
Após seleção inicial em 66 primers (OP-AP1 até OP-AP20; OP-G1 até OP-G20; OP-W1 até OP-W20; OP-B1; OP-A5; OP-A10; OP-A20; OP-AN6, OP-O19), utilizando o DNA genômico das duas espécies, optou-se pela utilização de OP-AP20, OP-AN6, OP-AP14 e OP-G20, na discriminação dos híbridos.
As análises com marcadores isoenzimáticos foram realizadas em gel de penetrose a 13% (amido de milho), a partir dos sistemas isoenzimáticos peroxidase - E.C.1.11.1.7 (PO); isocitrato desidrogenase - E.C.1.1.1.41 (IDH); e fosfoglucose isomerase - E.C.5.3.1.9 (PGI).
Em cada planta, a folha mais alta foi destacada e segmentos desta foram pesados, macerados em placas de porcelana, sob resfriamento, com a adição de tampão extrator protéico Namkoong (Alfenas et al., 1991). Utilizou-se uma relação aproximada de 100 mg de tecido foliar para cada 500 µL de tampão extrator e 10 mg de polivinil polipirrolidona (PVPP), durante a maceração. Os extratos protéicos foram absorvidos em pedaços de papel de filtro Whatman no 3, com dimensões de 0,5x1,4 cm, armazenados em tubos eppendorfs e depois utilizados nas corridas eletroforéticas.
Os tampões de cuba e de gel usados foram o Tris-Citrato-Borato pH 8,3 (TCB), no sistema PGI, e o tampão Citrato-Morfolina pH 6,1 (CM), nos sistemas IDH e PO (Alfenas et al., 1991).
As eletroforeses foram realizadas com voltagem constante (150 V, por uma hora, e 300 V por mais sete horas), no sistema PGI, e com corrente constante (20 mA), durante 14 horas, nos sistemas IDH e PO. As colorações de géis foram realizadas de acordo com Alfenas et al. (1991).
Resultados e Discussão
A porcentagem de obtenção de células heterocariontes (híbridas), logo após a adição da solução de PEG, situou-se entre 5,1% e 6,8%. Grosser & Gmitter Junior (1990) relataram que, em vários trabalhos com fusão de protoplastos em citros, esta freqüência foi entre 1% e 10%. Já Ling & Iwamasa (1994) obtiveram 7% de células híbridas, após eletrofusão entre tangerina 'Ponkan' e Citropsis gabunensis.
No presente estudo, a eficiência média de cultivo dos protoplastos obtidos em experimentos de fusão foi de 4,5±2,1%, calculada pelo número de microcolônias celulares formadas após 28 dias de cultivo, em relação à densidade inicial de protoplastos.
Em geral, as primeiras divisões celulares foram observadas sete dias após o cultivo. Vardi & Galun (1988) e Grosser & Gmitter Junior (1990) relataram que normalmente as primeiras divisões celulares são observadas 10 a 14 dias após o isolamento e cultivo. Segundo Vardi & Galun (1988), a razão do longo tempo para a primeira divisão foi em decorrência da fase lag relativamente extensa dos protoplastos de citros. Sim et al. (1988), entretanto, com o cultivo de protoplastos de Citrus mitis, observaram as primeiras divisões após três dias.
A utilização dos meios de cultivo KM8P (Gilmour et al., 1989), empregado nas gotas de agarose, e o BH3 (Grosser & Gmitter Junior, 1990), usado como meio líquido, possibilitou rápida obtenção de calos e embriões somáticos. Segundo Grosser (1994), o meio de cultivo KM8P tem sido usado com sucesso no cultivo de protoplastos de diversas espécies, provavelmente por causa da adição de concentrações apropriadas de multivitaminas, ácidos orgânicos e açúcares/álcoois complexos, que atuariam como redutores de estresses ambientais, pelo fornecimento de metabólitos intermediários.
No presente estudo, alguns embriões somáticos originaram-se espontaneamente a partir de 45 dias de cultivo, na própria gota de agarose, enquanto outros passaram primeiramente pela fase de calos, com cultivo em meio semi-sólido. Quando atingiram o estádio cotiledonar, os embriões foram transferidos para o meio de desenvolvimento contendo ácido giberélico (1 mg L-1) e água de coco (20 mL de L-1), o qual foi altamente eficiente na indução e desenvolvimento dos embriões. Aproximadamente 80% dos embriões transferidos se desenvolveram e resultaram em plantas.
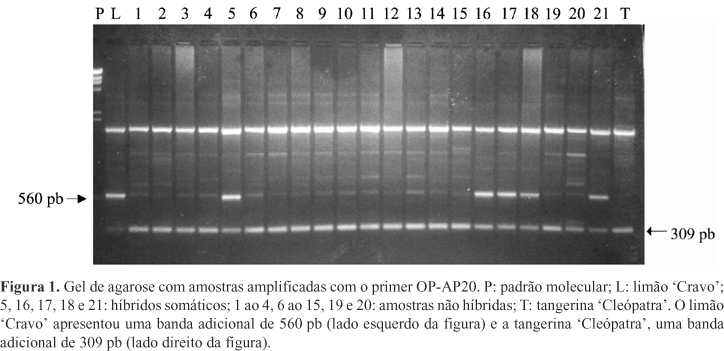
Nos vários experimentos de fusão realizados, foram obtidas mais de 500 plantas in vitro. Destas, 180 foram avaliadas usando-se o método de marcadores moleculares RAPD e 11 híbridos somáticos foram confirmados, todos pertencentes ao tratamento em que a tangerina 'Cleópatra' foi utilizada como parental de suspensão celular (protoplastos embriogênicos), e limão 'Cravo' como parental de folha. Como seria esperado, nenhuma planta regenerada apresentou padrão molecular e características morfológicas semelhantes às do limão 'Cravo', parental não embriogênico.
Em geral, os híbridos somáticos revelaram padrão molecular aditivo ao das espécies parentais, como pôde ser observado no caso do primer OP-AP20 (Figura 1). Nas amplificações realizadas com este primer, o limão 'Cravo' apresentou uma banda adicional com aproximadamente 560 pb; a tangerina 'Cleópatra', uma banda adicional com 309 pb, e os 11 híbridos somáticos, as duas.
Em outros primers utilizados, observou-se o padrão molecular aditivo, mas com a ausência de uma ou mais bandas intensas, como foi o caso do OP-AN6 (Figura 2). Com a utilização deste, todos os híbridos não apresentaram uma banda intensa, de 850 pb, pertencente à tangerina 'Cleópatra'.
Nas análises de híbridos somáticos com marcadores moleculares RAPD, a ausência de algumas bandas, presentes numa das espécies parentais, e a observação de bandas novas, inexistentes nos dois parentais, já haviam sido observadas em outros trabalhos (Grosser et al., 1996, 1998b). Uma das possíveis razões seria a existência de diferentes graus de homologia entre os genomas e o primer utilizado, ocasionando uma competição de DNA por sítios de amplificação RAPD (Ferreira & Grattapaglia, 1995). Nesses casos, as reações de RAPD favorecem a amplificação de segmentos que apresentam maior complementaridade entre o primer e o sítio de iniciação no DNA molde.
Nas análises com as isoenzimas PO, PGI e IDH, em folhas, observou-se que os híbridos apresentaram complementação alélica ao padrão das espécies parentais. Na enzima monomérica (PO), o limão 'Cravo' e a tangerina 'Cleópatra' apresentaram os genótipos SS e FF, respectivamente, e os híbridos somáticos, o padrão aditivo (FFSS) (Figura 3). Em relação às enzimas diméricas (IDH e PGI), o limão 'Cravo' apresentou-se como heterozigoto MS; a tangerina 'Cleópatra', homozigoto MM; os híbridos, genótipo MMMS (Figura 4).
A existência de complementação alélica nos híbridos somáticos, quando analisados com marcadores isoenzimáticos, já foi constatada em outros trabalhos (Grosser et al., 1992, 1994), e evidencia a presença dos dois genomas parentais na mesma planta.
Conclusões
1. Híbridos somáticos de limão 'Cravo' e tangerina 'Cleópatra' são obtidos pela fusão de protoplastos com solução de PEG (50%) e posterior cultivo em gotas de agarose.
2. Híbridos somáticos de limão 'Cravo' e tangerina 'Cleópatra', na fase de plantas jovens, são identificados e comprovados com o uso de marcadores moleculares RAPD e padrão isoenzimático da peroxidase e isocitrato desidrogenase.
3. Cerca de 6,11% das plantas obtidas e avaliadas são híbridos somáticos de limão 'Cravo' e tangerina 'Cleópatra'.
Maria Teresa Vitral de Carvalho Derbyshire
E-mail: mtvcderb@cena.usp.br
Siu Mui Tsai
E-mail: tsai@cena.usp.br
Augusto Tulmann Neto
E-mail: tulmannneto@cena.usp.br
Aceito para publicação em 8 de agosto de 2002.
- ALFENAS, A. C.; PETERS, I.; BRUNE, W.; PASSADOR, G. C. Eletroforese de proteínas e isoenzimas de fungos e essências florestais Viçosa, MG: UFV, 1991. 242 p.
- EDWARDS, K.; JOHNSTONE, C.; THOMPSON, C. A simple and rapid method for preparation of plant genomic DNA for PCR analysis. Nucleic Acids Research, Oxford, v. 19, p. 1349, 1991.
- FERREIRA, M. E.; GRATTAPAGLIA, D. Introdução ao uso de marcadores moleculares em análise genética 2. ed. Brasília: Embrapa-Cenargen, 1995. 220 p.
- GILMOUR, D. M.; DAVEY, M. R.; COCKING, E. C. Production of somatic hybrid tissues following chemical and electrical fusion of protoplasts from albino cell suspensions of Medicago sativa and M. borealis Plant Cell Reports, Berlin, v. 8, p. 29-32, 1989.
- GROSSER, J. W. Observations and suggestions for improving somatic hybridization by plant protoplast isolation, fusion and culture. HortScience, Alexandria, v. 29, n. 11, p. 1241-1243, 1994.
- GROSSER, J. W.; GMITTER JUNIOR, F. G. Protoplast fusion and citrus improvement. Plant Breeding Reviews, New York, v. 8, p. 339-374, 1990.
- GROSSER, J. W.; GMITTER JUNIOR, F. G.; SESTO, F.; DENG, X. X.; CHANDLER, J. L. Six new somatic citrus hybrids and their potential for cultivar improvement. Journal of the American Society for Horticultural Science, Alexandria, v. 117, n. 1, p. 169-173, 1992.
- GROSSER, J. W.; GMITTER JUNIOR, F. G.; TUSA, N.; CHANDLER, J. L. Somatic hybrid plants from sexually incompatible woody species: Citrus reticulata and Citropsis gilletiana Plant Cell Reports, Berlin, v. 8, p. 656-659, 1990.
- GROSSER, J. W.; JIANG, J.; LOUZADA, E. S.; CHANDLER, J. L.; GMITTER JUNIOR, F. G. Somatic hybridization, an integral component of citrus cultivar improvement II: rootstock improvement. HortScience, Alexandria, v. 33, n. 6, p. 1060-1061, 1998a.
- GROSSER, J. W.; JIANG, J.; MOURÃO FILHO, F. A. A.; LOUZADA, E. S.; BAERGEN, K.; CHANDLER, J. L.; GMITTER JUNIOR, F. G. Somatic hybridization, an integral component of citrus cultivar improvement I: scion improvement. HortScience, Alexandria, v. 33, n. 6, p. 1057-1059, 1998b.
- GROSSER, J. W.; LOUZADA, E. S.; GMITTER JUNIOR, F. G.; CHANDLER, J. L. Somatic hybridization of complementary citrus rootstocks: five new hybrids. HortScience, Alexandria, v. 29, n. 7, p. 812-813, 1994.
- GROSSER, J. W.; MOURÃO FILHO, F. A. A.; GMITTER JUNIOR, F. G.; LOUZADA, E. S.; JISNG, J.; BAERGEN, K.; QUIROS, A.; CABASSON, C.; SCHELL, J. L.; CHANDLER, J. L. Allotetraploid hybrids between citrus and seven related genera produced by somatic hybridization. Theoretical and Applied Genetics, Berlin, v. 92, p. 577-582, 1996.
- GUIRADO, N.; MULLER, G. W.; PRATES, H. S. Declínio dos citros. In: RODRIGUEZ, O.; VIÉGAS, F.; POMPEU JUNIOR, J.; AMARAL, A. A. (Ed.). Citricultura brasileira São Paulo: Fundação Cargill, 1991. v. 2, p. 722-734.
- KOBAYASHI, S.; OHGAWARA, T.; OHGAWARA, E.; OIYAMA, I.; ISHII, S. A somatic hybrid plant obtained by protoplast fusion between navel orange (Citrus sinensis) and Satsuma mandarin (C. unshiu). Plant Cell, Tissue and Organ Culture, Dordrecht, v. 14, p. 63-69, 1988.
- LATADO, R. R.; VAZ, F. B. D.; TULMANN NETO, A. Obtenção de plantas de limão Cravo (Citrus limonia Osbeck) e tangerina Cleópatra (Citrus reshni Hort.) a partir do cultivo de protoplastos de suspensão celular. Scientia Agricola, Piracicaba, v. 56, n. 2, p. 421-428, 1999.
- LING, J. T.; IWAMASA, M. Somatic hybridization between Citrus reticulata and Citropsis gabunensis through electrofusion. Plant Cell Reports, Berlin, v. 13, p. 493-497, 1994.
- LOUZADA, E. S.; GROSSER, J. W.; GMITTER JUNIOR, F. G.; NIELSEN, B.; CHANDLER, J. L.; DENG, X. X.; TUSA, N. Eight new somatic hybrids citrus rootstocks with potential for improvement disease resistance. HortScience, Alexandria, v. 27, n. 9, p. 1033-1036, 1992.
- MOURÃO FILHO, F. A. A.; GMITTER, F. G.; GROSSER, J. W. New tetraploid breeding parents for triploid seedless citrus cultivar development. Fruit Varieties Journal, University Park, v. 50, n. 2, p. 76-80, 1996.
- MURASHIGE, T.; TUCKER, D. P. H. Growth factor requirement of citrus tissue culture. In: INTERNATIONAL CITRUS SYMPOSIUM, 1., 1969, Riverside. Proceedings Riverside: International Society of Citriculture, 1969. v. 3, p. 1155-1161.
- OHGAWARA, T.; KOBAYASHI, S.; ISHII, S.; YOSHINAGA, K.; OIYAMA, I. Fertile fruit trees obtained by somatic hybridization: navel orange (Citrus sinensis) and Troyer citrange (C. sinensis x Poncirus trifoliata). Theoretical and Applied Genetics, Berlin, v. 81, p. 141-143, 1991.
- POMPEU JUNIOR, J. Porta-enxertos. In: RODRIGUEZ, O.; VIÉGAS, F.; POMPEU JUNIOR, J.; AMARO, A. A . (Ed.). Citricultura brasileira São Paulo: Fundação Cargill, 1991. v. 1. p. 265-280.
- POMPEU JUNIOR, J. Rootstocks and scions in the citriculture of the São Paulo State. In: CONGRESS OF THE INTERNATIONAL SOCIETY OF CITRUS NURSERYMEN, 6., 2001, Ribeirão Preto. Proceedings Bebedouro: Estação Experimental de Citricultura, 2001. p. 75-82.
- SIM, G. E.; LOH, C. S.; GOH, C. J. Direct somatic embryogenesis from protoplasts of Citrus mitis Blanco. Plant Cell Reports, Berlin, v. 7, p. 418-420, 1988.
- VARDI, A.; GALUN, E. Recent advances in protoplast culture of horticultural crops: citrus. Scientia Horticulturae, Amsterdam, v. 37, p. 217-230, 1988.
Datas de Publicação
-
Publicação nesta coleção
08 Abr 2003 -
Data do Fascículo
Dez 2002
Histórico
-
Aceito
08 Ago 2002