RESUMO
Formicidae inclui cerca de 16.000 nomes de espécies válidas em todo o mundo, com estimativas que excedem mais de 20.000 espécies. Atualmente 16 subfamílias foram descritas, sendo que na Região Neotropical são conhecidas 14 delas, representadas por mais de 4.000 espécies. Apresentamos a listagem de Formicidae para o estado de Mato Grosso do Sul, contemplada em inventários recentes realizados na Serra da Bodoquena, Pantanal, Chaco Brasileiro, Complexo Aporé-Sucuriú, Serra do Amolar e em uma Floresta Estacional Semidecidual Atlântica de Dourados, MS. Os dados aqui apresentados são referentes às coletas realizadas entre os anos de 2004 a 2012. O conjunto das amostras não foi padronizado para as respectivas áreas devido aos objetivos de cada estudo realizado. Até o momento foram identificadas para o estado 306 espécies em 71 gêneros de 11 subfamílias. Foram registradas pela primeira vez no estado as seguintes espécies consideradas raras para as fitofisionomias amostradas: Acanthostichus longinodis, Atta saltensis, Cryptomyrmex boltoni, Cylindromyrmex brasiliensis, Prionopelta punctulata, Probolomyrmex boliviensis, Probolomyrmex petiolatus, Procryptocerus montanus, Stegomyrmex olindae, Strumigenys xenochelyna e Tranopelta gilva. Três novas espécies foram registradas no estado: Asphinctanilloides sp. nov., Stigmatomma sp. nov. e Probolomyrmex sp. nov., em processo de descrição. Nossos estudos indicam a Serra da Bodoquena como a região mais diversa no estado para a fauna de Formicidae. Este trabalho tenta preencher a grande lacuna de conhecimento sobre a fauna de formigas neste mosaico de ecossistemas na região.
PALAVRAS-CHAVE
Coleção mirmecológica; formigas neotropicais; diversidade e conservação; Programa Biota-MS
ABSTRACT
Formicidae includes circa of 16.000 valid species names worldwide, with estimates exceed 20,000 species. Currently 16 subfamilies are described, and in the Neotropical region 14 of these are known, represented by over 4,000 species. We are presenting the checklist of Formicidae sampled in Mato Grosso do Sul State, Brazil, contemplated in recent surveys conducted in the Serra da Bodoquena, Pantanal, Brazilian Chaco, Aporé-Sucuriú complex, Serra do Amolar, and in a Semidecidual Forest of Dourados municipality. The data presented here refers at samples conducted between 2004 to 2012. The set of samples was not standardized for the respective areas due to the objectives of each study. Were indentified 306 species in 71 genera of 11 subfamilies. Were recorded for the first time in the state the following species considered rare for the vegetation types sampled: Acanthostichus longinodis, Atta saltensis, Cryptomyrmex boltoni, Cylindromyrmex brasiliensis, Prionopelta punctulata, Probolomyrmex boliviensis, Probolomyrmex petiolatus, Procryptocerus montanus, Stegomyrmex olindae, Strumigenys xenochelyna and Tranopelta gilva. Three new species were found in the Mato Grosso do Sul state: Asphinctanilloides sp. nov, Stigmatomma sp. nov and Probolomyrmex sp. nov. in description process. Our studies indicate Serra da Bodoquena as the most diverse region in the State for Formicidae. This work attempts to fill the large gap of knowledge on ant fauna in this mosaic of ecosystems on region.
KEYWORDS
Myrmecological collection; Neotropical ants; Diversity and conservation; Biota-MS Program
Nos ecossistemas tropicais, as formigas são importantes componentes na estrutura das comunidades devido sua diversidade expressiva e grande biomassa. Fazem parte dos grupos chamados hiperdiversos e são consideradas como bioindicadoras funcionais por serem sensíveis ao estado de conservação dos ambientes terrestres ( Silvestre et al., 2003Silvestre, R.; Brandão, C. R. F. & Silva, R. R. 2003. Grupos funcionales de hormigas: el caso de los gremios del Cerrado, Brasil. In: Fernández, F. ed. Introducción a las hormigas de la región Neotropical. Bogotá, Instituto Humboldt, p.113-143. ; Silva & Brandão, 2010Silva, R. R. & Brandão, C. R. F. 2010. Morphological patterns and community organization in leaf-litter ant assemblages. Ecological Monographs 80(1):107-124.).
No Centro-Oeste brasileiro a expansão agropecuária, favorecida pela topografia regional, levou a uma drástica perda de florestas. A constância de queimadas, a escassez de nutrientes do solo caracterizam os ecossistemas da região como ambientes savânicos, porém, as formações florestais são expressivas, mesmo cobrindo uma menor extensão. No entanto, estas formações florestais foram fortemente afetadas por atividades antrópicas, tais como a expansão da agropecuária, mineração de calcário e exploração por madeireiras ( Felfili, 2003Felfili, J. M. 2003. Fragmentos florestais estacionais do Brasil Central: diagnóstico e proposta de corredores ecológicos. In: Costa, R. B. ed. Fragmentação florestal e alternativas para o desenvolvimento rural na região Centro-Oeste. Campo Grande, UCDB, p. 139-160. ; Miles et al., 2006Miles, L.; Newton, A. C.; Defries, R. S.; Ravilious, C.; May, I.; Blyth, S.; Kapos, V. & Gordon, J. E. 2006. A global overview of the conservation status of tropical dry forests. Journal of Biogeography 33:491-505. ).
Particularmente o Estado de Mato Grosso do Sul engloba áreas que abrangem fitofisionomias típicas do Pantanal, Cerrado, Mata Atlântica e Chaco, além de brejos e veredas ( Prado & Gibbs, 1993Prado, D. E. & Gibbs, P. E. 1993. Patterns of species distribution in the dry seasonal forest of South America. Annals of the Missouri Botanical Garden 80:902-927. ; Felfili, 2003Felfili, J. M. 2003. Fragmentos florestais estacionais do Brasil Central: diagnóstico e proposta de corredores ecológicos. In: Costa, R. B. ed. Fragmentação florestal e alternativas para o desenvolvimento rural na região Centro-Oeste. Campo Grande, UCDB, p. 139-160. ; Spichiger et al., 2004Spichiger, R.; Calenge, C. & Bispe, B. 2004.Geographical zonation in the Neotropics of tree species characteristic of the Paraguay-Parana Basin. Journal of Biogeography31:1489-1501. ; Morrone, 2006Morrone, J. J. 2006. Biogeographic areas and transition zones of Latin America and the Caribbean islands based on panbiogeographic and cladistic analyses of the entomofauna. Annual Review of Entomology 51:467-494. ); forma um mosaico de ecossistemas, muitas vezes integrados, distribuídos ao longo de um vasto território e, outras vezes, isolados em formações particulares dentro das fitofisionomias, como por exemplo as salinas. Isto proporciona um imenso campo para estudos biogeográficos e ecológicos em ambientes pristinos ( Uetanabaro et al., 2007Uetanabaro, M.; Souza, F. L.; Filho, P. L.; Beda, A. F. & Brandão, R. A. 2007. Anfíbios e répteis do Parque Nacional da Serra da Bodoquena, Mato Grosso do Sul, Brasil. Biota Neotropica 7(3):279-289. ).
O estado situa-se na porção central da grande área diagonal de formações abertas da América do Sul, que se estende desde a Caatinga no nordeste do Brasil até o Chaco na Argentina, onde ocorrem áreas de contato entre o Pantanal, o Chaco e o Cerrado. A diagonal de áreas abertas abriga uma grande diversidade de ecossistemas, incluindo elevado número de espécies de flora e fauna endêmicas ( Bucher, 1980Bucher, H. 1980. Ecología de la fauna Chaqueña. Una revisón. Ecosur 7(4):111-159.; Vanzolini, 1988Vanzolini, P. E. 1988. Distributional patterns of South American Lizards. In: Vanzolini, P. E. & Heyer, W. R. eds. Proceedings of a Workshop on Neotropical Distribution Patterns. Rio de Janeiro, Academia Brasileira de Ciências, p. 317-342. ; Zanella, 2011Zanella, F. C. V. 2011. Evolução da Biota da Diagonal de Formações Abertas Secas da América do Sul. In: Carvalho, C. J. B. & Almeida, E. A. B. eds. Biogeografia da América do Sul. Padrões e processos. São Paulo, Editora Roca, p.198-220.). Apesar de sua importância biogeográfica, essa diagonal tem sido pouco contemplada com estudos de invertebrados em abrangência regional. Dentre os componentes fisionômicos que compõem essa diagonal e cuja representatividade se faz presente em Mato Grosso do Sul, as matas estacionais (deciduais e semideciduais) exercem um papel-chave na distribuição de diversos elementos da fauna e da flora ( Prado & Gibbs, 1993Prado, D. E. & Gibbs, P. E. 1993. Patterns of species distribution in the dry seasonal forest of South America. Annals of the Missouri Botanical Garden 80:902-927. ; Spichiger et al., 2004Spichiger, R.; Calenge, C. & Bispe, B. 2004.Geographical zonation in the Neotropics of tree species characteristic of the Paraguay-Parana Basin. Journal of Biogeography31:1489-1501. ; Morrone et al., 2004Morrone, J. J.; Mazzucconi, S. A. & Bachmann, A. O. 2004. Distributional patterns of Chacoan water bugs (Heteroptera: Belostomatidae, Corixidae, Micronectidae and Gerridae). Hydrobiologia 523:159-173. ; Morrone, 2006Morrone, J. J. 2006. Biogeographic areas and transition zones of Latin America and the Caribbean islands based on panbiogeographic and cladistic analyses of the entomofauna. Annual Review of Entomology 51:467-494. ; Silvestre et al., 2012Silvestre, R.; Demétrio, M. F. & Delabie, J. H. C. 2012. Community structure of leaf-litter ants in a Neotropical dry forest: A biogeographic approach to explain betadiversity. Psyche 2012:1-15.).
As formigas são incluídas em estudos de monitoramento ambiental por causa de sua alta diversidade e resposta rápida às alterações do ambiente ( Yanoviak & Kaspari, 2000Yanoviak, S. P. & Kaspari, M. 2000. Community structure and the habitat templet: ants in the tropical forest canopy and litter. Oikos 89:259-266. ; Barrow et al., 2006Barrow, L.; Parr, C. L. & Kohen, J. L. 2006. Biogeography anddiversity of ants in Purnululu (Bungle Bungle) National Park and Conservation Reserve, Western Australia. Australian Journal of Zoology 54:123-136. ). Elas são em sua maioria coletoras e predadoras, e exercem grande impacto na formação do solo, na predação de sementes e na dispersão e controle da comunidade de invertebrados ( Delsinne et al., 2008Delsinne, T.; Leponce, M. Theunis, L.; Braet, Y. & Roisin, Y. 2008. Rainfall Influences Ant Sampling in Dry Forests. Biotropica 40(5):590-596. ). Portanto, são particularmente boas candidatas para monitoramento mudanças na comunidade que possam ocorrer devido à mudança climática ou a fragmentação do habitat ( Del Toro et al., 2015Del Toro, I.; Silva R. R & Ellison A. M. 2015. Predicted impacts of climatic change on ant functional diversity and distributions in eastern North American forests. Diversity and Distributions 21(7):781-791.).
Desta forma, há uma crescente necessidade de aprimorar os inventários sistematizados, em particular, com a fauna de invertebrados, com a intenção de suprir a lacuna de conhecimento sobre a biodiversidade desse segmento de fauna nesse mosaico de ecossistemas particulares inseridos na região. Este estudo teve como objetivo inventariar a fauna de formigas no Estado de Mato Grosso do Sul, contemplando diferentes estudos realizados em ambientes amostrados recentemente, inseridos na pluralidade de ecossistemas que a região apresenta.
MATERIAL E MÉTODOS
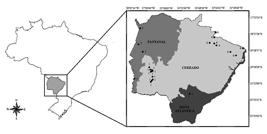
O inventário contemplou uma série de coletas realizadas em ecossistemas representativos do Estado de Mato Grosso do Sul ( Fig. 1, Tab. I) entre o período de 2004 a 2012 nas seguintes localidades:
-
Serra da Bodoquena: Esta formação bordeada pela planície do Pantanal forma duas porções que totalizam cerca de 300 km de comprimento e 20 a 50 km de largura, sustentadas por rochas calcárias do grupo Corumbá - Neoproterozóico III ( Boggiani et al., 1993Boggiani, P. C.; Fairchild, T. R. & Coimbra, A. M. 1993. O grupo Corumbá (Neoproterozóico-Cambriano) na região central da Serra da Bodoquena (Faixa Paraguai) Mato Grosso do Sul. Revista Brasileira de Geociências 23:301-305. ). Apresenta vegetação nativa de Floresta Estacional Decidual e Semidecidual, Cerrado, Cerradão e áreas de encrave vegetacional ( Pott & Pott, 2003Pott, A. & Pott, V. J. 2003.Espécies de fragmentos florestais em Mato Grosso do Sul. In: Costa, R. B. org. Fragmentação florestal e alternativas de desenvolvimento rural na região centro-oeste. Campo Grande, UCDB p. 26-52. ). Nos topos dos morros há afloramentos rochosos ferrugíneos magmáticos, em elevações acima de 600 m, com a formação de Campo Rupestre, onde ocorrem cactáceas. Foram realizadas 10 expedições de coleta entre os anos de 2005 a 2011, com 9 localidades amostradas.
-
Serra do Amolar: As coletas foram realizadas em três trilhas mapeadas ao redor da Lagoa Mandioré, divisa com a Bolívia entre 2010 e 2011, contemplando os períodos de seca e de cheia no Pantanal, em áreas de Floresta Estacional Decidual (mata seca).
-
Base de Estudos do Pantanal (BEP): Localizada no município de Corumbá, na beira do rio Miranda. Há formações florestais como capões, cordilheiras, paratudal e mata ciliar. As amostragens foram realizadas em expedições anuais, com 15 dias de permanência no campo, entre 2004 a 2007.
-
Chaco/Porto Murtinho: Nesta região as transições florísticas formam ecótonos de diferentes regiões fitoecológicas, sendo reconhecidas as seguintes fitofisionomias: Savana Estépica Gramíneo-Lenhosa, Savana Estépica Arbórea, Parque de Carandazais, formações de encrave Chaco/Floresta Decidual e Chaco/Cerrado, brejos, banhados e salitres ( Abdon & Silva, 2006Abdon, M. M. & Silva, J. S. V. 2006. Identificação de padrões em imagens Landsat-ETM+ para interpretação da vegetação arbórea do cerrado na sub-região de Cáceres, no Pantanal do estado do Mato Grosso. In: IX Semana de Geografia da Unemat. (SEMAGEO), Cáceres/MT. Anais… Cáceres, Unemat, p. 1-13. ; Noguchi et al., 2009Noguchi, D. K.; Nunes, G. P. & Sartori, A. L. B. 2009. Florística e síndromes de dispersão de espécies arbóreas em remanescentes de Chaco de Porto Murtinho, Mato Grosso do Sul, Brasil. Rodriguésia 60(2):353-365. ). As coletas foram realizadas entre 2010 e 2012, em intervalos de três meses, com sete dias de permanência em cada.
-
Mata do Azulão: Fragmento de Floresta Estacional Semidecidual Atlântica, de aproximadamente 10 ha, localizado no município de Dourados, MS, com intensa atividade agrícola e pecuária na região de entorno (matriz). As coletas foram conduzidas em novembro de 2008 e em dezembro de 2011.
-
Complexo Aporé-Sucuriú: Coletas realizadas em 2006 ( Pagotto & Souza, 2006Pagotto, C. S. & Souza, P. R. org. 2006. Biodiversidade do Complexo Aporé-Sucuriú. Subsídios à conservação e ao manejo do cerrado: área prioritária 316-Jauru. Campo Grande, Editora UFMS. 308p. ) em áreas que predominam formações florestais como matas de galeria, cerradão, cerrado sentido restrito, campo limpo, veredas e covais (formação de poáceas recobrindo solo úmido). As seguintes localidades foram amostradas: nascente do rio Aporé, Fazenda Pedra Branca, Fazenda Ponte Nova, nascente do rio Sucuriú, alto rio Sucuriú, Fazenda Mimoso, médio e baixo rio Quitéria e baixo rio Aporé, próximo à divisa de MS e Goiás.
-
Maciço do Urucum: Constitui uma das poucas serras inseridas na borda oeste da planície do Pantanal, com forte contraste da vegetação, que varia de floresta semidecidual a campo rupestre ( Bordignon & França, 2004Bordignon, M. O. & França, A. O. 2004. Análise preliminar sobre a diversidade de morcegos no Maciço do Urucum, Mato Grosso do Sul, Brasil. Simpósio Sobre Recursos Naturais e Socioeconômicos do Pantanal, IV SINPAN. Corumbá, Embrapa Pantanal, p. 1-4. ). As coletas foram realizadas em quatro fisionomias vegetais, incluindo savana gramíneo-lenhosa, floresta estacional semidecidual submontana, mata de galeria e cerradão, entre 15 e 26 de dezembro de 2007 e entre 18 e 30 de maio de 2008.
Mapa das localidades amostradas no Estado de Mato Grosso do Sul, Brasil. (1- Serra da Bodoquena, 2- Serra do Amolar, 3- Base de estudos do Pantanal, 4- Chaco/Porto Murtinho, 5- Mata do Azulão, 6- Complexo Aporé-Sucuriú, 7- Maciço do Urucum).
Lista das localidades onde foram realizadas coletas de formigas no Estado de Mato Grosso do Sul, Brasil, fitofisionomia predominante nas áreas e metodologia amostral.
Os protocolos não seguem uma padronização nas localidades amostradas em função das coletas terem diferentes objetivos para cada estudo proposto, bem como terem sido realizadas por diferentes pesquisadores. Foram empregadas as seguintes técnicas de coleta:
Extratores de mini-Winkler. As amostragens de serapilheira foram realizadas seguindo uma adaptação ao protocolo A. L. L . (Ants of the Leaf Litter) descrito em Agosti & Alonso (2000Agosti, D. & Alonso, L. E. 2000. The A. L. L. Protocol: a standard protocol for the collection of ground-dwelling ants. In: Agosti, D.; Majer, J. D.; Alonso, L. E. & Schultz, T. R. eds. Ants. Standard Methods for Measuring and Monitoring Biodiversity. Washington, Smithsonian Institution Press, p. 204-206. ). Para cada ponto amostral, foram extraídas 25 amostras de 1 m2 de serapilheira.
Armadilhas do tipo pitfall. Recipientes plásticos de 12 cm de diâmetro e 9 cm de altura, com aproximadamente 200 ml de água e detergente, enterrados até o nível do solo. Para cada ponto amostral foram distribuídas 100 armadilhas expostas por um período de 48 horas.
Bandejas amarelas. Contendo água, álcool e detergente, utilizadas na captura de vespas, mais que também amostram formigas aladas e forrageadoras grandes de solo. 25 bandejas foram utilizadas por localidade onde esta técnica foi empregada.
Iscas atrativas. Foram distribuídas no solo e na vegetação 50 iscas de sardinha para cada ponto amostral contemplado com iscas, as quais foram expostas por 60 minutos. O material recolhido foi triado em bandejas brancas no campo e acondicionados em frascos Eppendorff, com álcool 96°, devidamente etiquetados.
Guarda-chuva entomológico. Estrutura de pano branco de 1 m² para amostrar a fauna em estrato de vegetação arbustivo-arbóreo; formigas são coletadas através de batidas realizadas na vegetação ao longo de trilhas de forma aleatória, cobrindo uma área de 1ha.
Busca ativa (qualitativa). Coletas realizadas com auxílio de pinça, no solo e vegetação, diretamente em ninhos, sob pedras ou através de abertura de galhos caídos no solo da mata.
Os exemplares coletados foram montados em alfinete entomológico n° 2, utilizando triângulos plásticos transparentes. A identificação foi realizada no Laboratório de Ecologia de Hymenoptera da Universidade Federal da Grande Dourados (HECOLAB-UFGD). O material testemunho está depositado na coleção de Hymenoptera do Museu de Biodiversidade da Faculdade de Ciências Biológicas e Ambientais (MuBio/UFGD).
Para a estimativa de espécies, foi utilizada a planilha de presença/ausência no software EstimateS ( Colwell, 2006Colwell, R. K. 2006. EstimateS. Statistic estimation of species richness and shared species from samples. Version 8.2. Disponível em < Disponível em http://viceroy.eeb.uconn.edu/estimates
>. Acessado em 21/10/2013.
http://viceroy.eeb.uconn.edu/estimates...
), aplicando o índice de Jack-Knife 2ª ordem.
RESULTADOS E DISCUSSÃO
Foram registradas 306 espécies ( Apêndice 1 Apêndice I. Lista das espécies de Formicidae e localidades amostradas no estado de Mato Grosso do Sul, Brasil. (1) Bodoquena; (2) Serra do Amolar; (3) Base de estudos do Pantanal; (4) Chaco; (5) Mata do Azulão; (6) Aporé-Sucuriú; (7) Maciço do Urucum. Formicidae 1 2 3 4 5 6 7 Amblyoponinae Stigmatomma armigerum (Mayr, 1887) X X X X Stigmatomma elongatum Santschi, 1912 X Stigmatomma lurilabes (Lattke, 1991) X Stigmatomma sp. nov. X Stigmatomma sp. 1 X X Stigmatomma sp. 2 X Prionopelta punctulata Mayr, 1866 X Dolichoderinae Azteca alfari Emery, 1893 X X X X X X Azteca sp.1 X X X X X Azteca sp.2 X X X Dolichoderus bispinosus (Olivier, 1792) X X X X X X Dolichoderus germaini Emery, 1894 X Dolichoderus lamellosus (Mayr, 1870) X Dolichoderuslutosus (F. Smith, 1858) X X X Dolichoderus sp. 1 X X X X Dolichoderus sp. 2 X X X Dorymyrmex thoracicus Gallardo, 1916 X X X X X X Dorymyrmex sp. 1 X X Forelius sp. 1 X X X X Forelius sp. 2 X Gracilidris pombero Wild & Cuezzo, 2006 X Linepithema humile (Mayr, 1868) X X X X X X Linepithema sp. 1 X X X X X X X Linepithema sp. 2 X X X Tapinoma atriceps Emery, 1888 X X Tapinoma melanochepalum (Fabricius, 1793) X X X X X Dorylinae Acanthostichus brevicornis Emery, 1894 X X Acanthostichus longinodis Mackay, 2004 X Asphinctanilloides sp. nov. X Cerapachys splendens Borgmeier, 1957 X X Cerapachys sp. X Cylyndromyrmex brasiliensis Emery, 1901 X Eciton burchelli (Westwood, 1842) X X Eciton burchelli parwispinum Forel, 1899 X X Eciton hamatum (Fabricius, 1782) X Eciton vagans (Olivier, 1792) X Labidus coecus (Latreille, 1802) X X Labidus praedator (Fr. Smith, 1858) X X X X X X Neivamyrmex hetschkoi (Mary, 1886) X Neivamyrmex jerrmanni Forel, 1901 X Neivamyrmex sp. 1 X X X X Dorylinae Neivamyrmex sp. 2 X Nomamyrmex esenbeckie wilsoni (Sanshi, 1920) X X Nomamyrmex hartigii (Westwood, 1842) X Ectatomminae Ectatommabrunneum Smith, 1858 X X X X X X Ectatommaedentatum Roger, 1863 X X X X X Ectatomma opaciventri Roger, 1861 X Ectatomma permagnum Forel, 1908 X X X X X X X Ectatomma planidens Borgmeier, 1939 X Ectatomma tuberculatum Olivier, 1792 X X X X X X X Ectatomma vizottoi Almeida, 1987 X Gnamptogenys striatula Mayr, 1884 X X X X X X X Gnamptogenys (gr. striatula) sp. 1 X X Gnamptogenys sulcata (Smith, 1858) X Gnamptogenys sp. X X Typhlomyrmex rogenhoferi Mayr, 1862 X Typhlomyrmex sp. 1 X Heteroponerinae Heteroponera microps Borgmeier, 1957 X Brachymyrmex sp. 1 X X X X X X X Brachymyrmex sp. 2 X X X X X X X Brachymyrmex sp. 3 X X X X X X X Brachymyrmex sp. 4 X X X X X Camponotus atriceps (Smith F., 1858) X X Camponotus blandus (Smith, F. 1858) X X X X X Camponotus castaneus (Latreille, 1802) X Camponotus crassus Mayr 1862 X X X X X X X Camponotus crispulus Santschi, 1922 X X X X X Camponotus mus Roger, 1863 X X X X X Camponotus renggeri Emery, 1894 X X X X X Camponotus rufipes (Fabricius, 1775) X X X X X X X Camponotus sericeiventris Guérin-Méneville, 1838 X X Camponotus termitarius Emery, 1902 X X X X X Camponotus sp. 1 X X X X X Camponotus sp. 2 X X X X X Camponotus sp. 3 X X X Camponotus sp. 4 X Camponotus sp. 5 X X X X X X X Camponotus sp. 6 X X X X X Camponotus sp. 7 X X X X X X Nylanderia fulva (Mayr, 1862) X X X X X X Nylanderia sp. 1 X X X X X X X Nylanderia sp. 2 X X X X X X X Nylanderia sp. 3 X X X Nylanderia sp. 4 X X X Nylanderia sp. 5 X X X Paratrechina longicornis (Latreille, 1802) X X X X X X X Myrmicinae Acromyrmexbalzani (Emery, 1890) X X X Acromyrmex sp. 1 X X X X Acromyrmex sp. 2 X Acromyrmexsubterraneus (Forel, 1893) X X X X Acromyrmex coronatus (Fabricius, 1804) X X X X X Apterostigma auriculatum Wheeler, 1925 X Apterostigma manni Weber, 1938 X Apterostigma pilosum Mayr, 1865 X X X X X Apterostigma wasmanni Forel, 1892 X Atta laevigatta (Smith F., 1858) X X Atta rubropilosa Forel, 1908 X Atta saltensis Forel, 1913 X Atta sexdens Linnaeus, 1758 X X X Basiceros disciger (Mayr, 1887) X Blepharidatta conops Kempf, 1967 X X Carebara coeca Fernández, 2004 X X X X X X Myrmicinae Carebara sp. 2 X X X X X Carebara sp. 3 X X Cephalotes atratus (Linnaeus, 1758) X X X X X X X Cephalotes borgmeieri (Kempf, 1951) X X X X Cephalotes clypeatus (Fabricius, 1804) X X X X Cephalotes depressus (Klug, 1824) X X Cephalotes eduarduli (Forel, 1921) X X X Cephalotes maculatus (Smith, 1876) X Cephalotes minutus (Fabricius, 1804) X X X Cephalotes pallens (Klug, 1824) X X Cephalotes pellans (De Andrade, 1999) X X X X Cephalotes pusillus (Klug, 1824) X X X X Cephalotes sp. 1 X X X X Cephalotes sp. 2 X X X Cephalotes sp. 3 X X X Crematogaster acuta (Fabricius, 1804) X X Crematogaster arata Emery, 1906 X X X X Crematogaster brasiliensis Mayr, 1878 X X X X X Crematogaster curvispinosa Mayr, 1862 X X X X X X X Crematogaster limata Smith F., 1858 X X X Crematogaster victima Smith F., 1858 X Crematogaster sp. 1 X X X X X X Crematogaster sp. 2 X X X X X X Crematogaster sp. 3 X X X X Crematogaster sp. 4 X Cryptomyrmex boltoni Fernández 2003 X Cyphomyrmex (gr. rimosus) sp. 1 X X X X X Cyphomyrmex (gr. rimosus) sp. 2 X X X X Cyphomyrmex (gr. rimosus) sp. 3 X X Cyphomyrmex (gr. rimosus) sp. 4 X Cyphomyrmex (gr. rimosus) sp. 5 X Cyphomyrmex (gr. rimosus) sp. 6 X Cyphomyrmex (gr. rimosus) sp. 7 X Cyphomyrmex (gr. rimosus) sp. 8 X Cyphomyrmex (gr. strigatus) sp. 1 X Cyphomyrmex (gr. strigatus) sp. 2 X X X X Cyphomyrmex lectus (Forel, 1911) X Cyphomyrmex minutus Mayr, 1862 X Cyphomyrmex olitor Forel, 1893 X X Cyphomyrmex sp. 1 X X X Cyphomyrmex sp. 2 X X X X X Hylomyrma balzani (Emery, 1894) X X Hylomyrma reiterri (Mayr, 1887) X X Kalathomyrmex emeryi (Forel, 1907) X Leptothorax sp. X Megalomyrmex silvestrii Wheeler, 1909 X X Megalomyrmex wallacei Mann, 1916 X X X X X Monomoriumfloricola Jerdon, 1851 X X X X X Mycetarotes parallelus (Emery, 1906) X Mycetosoritis explicata Kempf, 1968 X X Mycocepurus goeldii (Forel, 1893) X X X X X X Mycocepurus smithii (Forel, 1893) X X Mycocepurus sp. 1 X X Mycocepurus sp. 2 X Myrmicocrypta sp. 1 X X X Myrmicocrypta sp. 2 X Ochetomyrmex semipolitus Mayr, 1878 X Octostruma balzani (Emery, 1894) X X X X Octostruma iheringi (Emery, 1888) X X X Octostruma rugifera (Mayr, 1887) X Octostruma stenognatha (Brown & Kempf, 1960) X Octostruma sp. 1 X X X X Octostruma sp. 2 X X Octostruma sp. 3 X Octostruma sp. 4 X Myrmicinae Oxyepoecusrastratus Mayr, 1887 X Oxyepoecus sp. 1 X X X X X Pheidole dinophila Wilson, 2003 X Pheidole (gr. flavens) sp . 1 X X X Pheidole gertrudae Forel, 1886 X X X X X X Pheidole oxyops Forel, 1908 X X X X X X Pheidole sp. 1 X X X X X X X Pheidole sp. 2 X X X X X X X Pheidole sp. 3 X X X X X X Pheidole sp. 4 X X X X X Pheidole sp. 5 X X X Pheidole sp. 6 X X X X Pheidole sp. 7 X X X X Pheidole sp. 8 X X X X Pheidole sp. 9 X X X Pheidole sp. 10 X X X X X Pheidole sp. 11 X X Pheidole sp. 12 X Pheidole sp. 13 X Pheidole sp. 14 X X Pheidole sp. 15 X Pheidole sp. 16 X Pogonomyrmex abdominalis Santschi, 1929 X Pogonomyrmex naegelli Emery, 1878 X Procryptocerusattenuatus Smith, 1876 X X X Procryptocerus montanus Kempf, 1957 X X Rogeria alzatei Kugler, 1994 X X X X X X X Rogeria lirata Kugler, 1994 X X X X X X X Rogeria sp. 1 X X Rogeria sp. 2 X Sericomyrmex (gr. amabilis) sp. 1 X X Sericomyrmex (gr. amabilis) sp. 2 X Sericomyrmex sp. 1 X Solenopsis ( Diphorhoptrum) sp. 1 X Solenopsis daguarrei (Santschi, 1930) X Solenopsis geminata (Fabricius, 1804) X X X X X X Solenopsis invicta Burren, 1972 X X X X X Solenopsis (gr . invicta) sp. 1 X X X X X X Solenopsis (gr . invicta) sp. 2 X X Solenopsis pusillignis Trager, 1991 X X X X X Solenopsis richterri Forel, 1909 X X X Solenopsis sp. 1 X X X X X X Solenopsis sp. 2 X X X X X Solenopsis sp. 3 X X X X Solenopsis sp. 4 X X Solenopsis sp. 5 X X Solenopsis sp. 6 X X X Solenopsis sp. 7 X Solenopsis sp. 8 X X Stegomyrmex olindae Feitosa, Brandão & Diniz, 2008 X Strumigenys elongata Roger, 1863 X Strumigenys eggersi Emery, 1890 X X X Strumigenys xenochelyna (Bolton, 2000) X Strumigenys sp. 1 X X X X X X Strumigenys sp. 2 X X X X X X Strumigenys sp. 3 X X X X Strumigenys sp. 4 X Strumigenys sp. 5 X X Strumigenys sp. 6 X X X Strumigenys sp. 7 X Strumigenys sp. 8 X Strumigenys sp. 9 X X Strumigenys sp. 10 X Trachymyrmex dichrous Kempf, 1967 X Trachymyrmex fuscus Emery,1834 X X X X Myrmicinae Trachymyrmex sp . 1 X X X X X Trachymyrmex sp . 2 X X X Tranopelta gilva Mayr, 1866 X Wasmannia auropunctata (Roger, 1863) X X X X X X X Wasmannia lutzi Forel, 1908 X X X Wasmannia sp. 1 X X X X X X X Wasmannia sp. 2 X X X X X Wasmannia sp. 3 X X Ponerinae Anochetus diegensis Forel, 1912 X X X X X X X Anochetus altisquamis Mayr, 1887 X X Anochetus neglectus Emery, 1894 X X X X X Dinoponera australis Emery, 1901 X X X X X Hypoponera sp. 1 X X X X X Hypoponera sp. 2 X X X X X Hypoponera sp. 3 X X X X Hypoponera sp. 4 X X X Hypoponera sp. 5 X X Hypoponera sp. 6 X Hypoponera sp. 7 X X X Hypoponera sp. 8 X X Hypoponera sp. 9 X X Hypoponera sp. 10 X Hypoponera sp. 11 X Hypoponera sp. 12 X Hypoponera sp. 13 X Hypoponera sp. 14 X Hypoponera sp. 15 X Hypoponera sp. 16 X Hypoponera sp. 17 X Hypoponera sp. 18 X Hypoponera sp. 19 X Hypoponera sp. 20 X Hypoponera sp. 21 X X Leptogenys punctaticeps Emery, 1890 X Leptogenys sp. 1 X X Mayaponera constricta (Mayr, 1884) X X X Neoponera luteola (Roger, 1861) X Neoponera inversa (Smith F., 1858) X X X Neoponera marginata (Roger, 1861) X X X X Neoponera obscuricornis (Emery, 1890) X Neoponera verenae (Forel, 1922) X X Neoponera villosa (Fabricius, 1804) X X X Odontomachus bauri Emery, 1892 X X X Odontomachus brunneus (Patton, 1894) X X X Odontomachus chelifer (Latreille, 1802) X X X X Odontomachus meinerti Forel, 1905 X X X X Odontomachus sp. X X Pachycondyla crassinoda (Latreille, 1802) X Pachycondyla harpax (Fabricius, 1804) X X X X X Pachycondyla impressa (Roger, 1861) X Pachycondyla striata (Smith F., 1858) X X X X Pachycondyla sp. X X Rasopone arhuaca (Forel, 1901) X X X X Rasopone ferruginea (Smith F., 1858) X Rasopone lunaris (Emery, 1896) X Thaumatomyrmex contumax Kempf, 1975 X Thaumatomyrmex mutilatus Mayr, 1887 X X Paraponerinae Paraponera clavata (Fabricius, 1775) X X X X Proceratiinae Probolomyrmex sp. nov. X Probolomyrmex boliviensis Mann, 1923 X Probolomyrmex petiolatus Weber, 1940 X Proceratium sp. X Pseudomyrmecinae Pseudomyrmex acanthobius (Emery, 1896) X X Pseudomyrmex cubaensis (Forel, 1901) X X Pseudomyrmex gracilis (Fabricius, 1804) X X X X Pseudomyrmexferrugineus (Smith F., 1877) X X X X Pseudomyrmex holmgreni (Wheeler 1925) Pseudomyrmex termitarius (Smith F., 1855) X X X X X Pseudomyrmex (gr. oculatus) sp. 1 X X X X X Pseudomyrmex urbanus (Smith F., 1877) X X X Pseudomyrmex sp. 1 X X X X X X Pseudomyrmex sp. 2 X X X X X Pseudomyrmex sp. 3 X X X Pseudomyrmex sp. 4 X X X ) distribuídas em de 71 gêneros dentro de 11 subfamílias, das 14 reconhecidas para a Região Neotropical. Vinte e quatro espécies foram amplamente distribuídas, independente do método empregado e 104 foram amostradas em uma única localidade. Das coletas quantitativas realizadas na Serra da Bodoquena, no Chaco de Porto Murtinho e na Serra do Amolar, o total de espécies registradas uma única vez ( singletons) foi representativo, refletindo cerca de 34% de todas as espécies coletadas nestes ambientes. Os gêneros mais ricos foram Hypoponera (21), Pheidole (20), Camponotus (17), Solenopsis (16), Pseudomyrmex (12), Cyphomyrmex (15), Strumigenys (13) e Octostruma (8).
Obteve-se o primeiro registro no Estado das espécies consideradas raras nas fitofisionomias amostradas: Acanthostichus longinodis, Atta saltensis, Cryptomyrmex boltoni, Cylindromyrmex brasiliensis, Heteroponera microps, Prionopelta punctulata, Probolomyrmex boliviensis, Probolomyrmex petiolatus, Procryptocerus montanus, Stegomyrmex olindae, e Tranopelta gilva. Três novas espécies foram registradas na Serra da Bodoquena em Floresta Estacional Decidual: Asphinctanilloides sp. nov., Stigmatomma sp. nov. e Probolomyrmex sp. nov. As espécies em processo de descrição foram depositadas na coleção do Dr. Carlos Roberto Ferreira Brandão (MZUSP-SP) e na coleção do Dr. Jacques H. C. Delabie (CEPLAC/UESC-BA).
A maior riqueza de espécies foi observada na Serra da Bodoquena com registro de 278 espécies, seguida por Chaco/Porto Murtinho com 134 espécies, pela Serra do Amolar com 120 espécies, Mata do Azulão com 111 espécies, BEP Pantanal com 107 espécies, Complexo Aporé-Sucuriú com 96 espécies e Maciço do Urucum com 95 espécies. O estimador de riqueza Jack-Knife 2ª ordem demonstrou uma riqueza estimada para a fauna de formigas de 438±-29 espécies para o Mato Grosso do Sul.
Os dados, por hora, apresentados foram obtidos a partir de estudos com propósitos diferenciados, que empregaram metodologias específicas, sendo consideradas complementares, uma vez que cada técnica contempla um determinado segmento de fauna. Geralmente, para formigas, os grupos são diretamente relacionados ao substrato (solo, vegetação ou serapilheira) ( Wall & Moore, 1999Wall, D. H. & Moore, J. C. 1999. Interactions underground. BioScience 49(2):109-117. ; Silva & Silvestre, 2004Silva, R. R. & Silvestre, R. 2004. Riqueza da fauna de formigas (Hymenoptera: Formicidae) que habita as camadas superficiais do solo em Seara, Santa Catarina. Papéis Avulsos de Zoologia 44:1-11. ).
Para a realização de um inventário consistente é necessário um período de tempo longo, o que dificulta a amplitude das amostragens nas diversas regiões. Inventários rápidos da diversidade devem considerar a complementaridade das técnicas, como também considerar que a experiência do coletor possa ser fundamental na percepção e previsibilidade dos micros-nichos de muitas espécies consideradas raras, muitas vezes porque as determinadas espécies não são contempladas por determinadas técnicas; outras, por vezes, são realmente raras e só são amostradas a partir de um grande esforço amostral. Quanto maior o número de amostras, maior a probabilidade desta fração rara ser encontrada. Mesmo os inventários rápidos também devem considerar a questão da fauna ser sazonal, função esta associada à competição por recursos.
Do conjunto de espécies consideradas raras amostradas neste estudo algumas foram descritas recentemente: Stegomyrmex olindae Feitosa et al., 2008, Gracilidris pombero Wild & Cuezzo, 2006, Acanthostichus longinodis MacKay, 2004 e Cryptomyrmex boltoni, Fernández, 2003. De outras espécies consideradas raras foram obtidas novas informações de ocorrência e o comportamento de forrageamento foi fotografado em campo como: Atta saltensis que tinha sua distribuição conhecida apenas para a Região Sul, principalmente no pampa do Brasil e do Uruguai e nos chacos da Argentina, Paraguai e Bolívia ( AntWeb, 2012AntWeb. 2015. Disponível em: < Disponível em: http://www.antweb.org
>. Acessado em 21/10/2013.
http://www.antweb.org...
) ( Fig. 2). Para as espécies especialistas predadoras de milípedes ( Brandão et al., 1991Brandão, C. R. F.; Diniz, L. M. & Tomotake, E. M. 1991. Thaumatomyrmex strips millipedes for prey, a novel predatory behaviour in ants and the first case of sympatry in the genus. Insectes Sociaux 38:335-344. ) Thaumatomyrmex contumax e Thaumatomyrmex mutilatus não existiam informações a respeito da sua ocorrência no MS, contudo Benoit Jahyni (comun. pess.) já havia coletado T. mutilatus em Bonito, MS, em concha de gastrópode. Mayaponera constricta ( Fig. 3) foi fotografada montada em triangulo plástico em alfinete entomológico com sua presa entre as mandíbulas, um aracnídeo. Cylyndromyrmex brasiliensis foi fotografada predando cupins em Mata de Galeria, nidificando em tronco podre na Serra da Bodoquena ( Fig. 4); Pseudomyrmex acanthobius foi registrada nidificando em aromita Vachellia caven (Molina) Seigler & Ebinger no Chaco Brasileiro ( Fig. 5).
Cylyndromyrmex brasiliensis Emery, 1901 predando cupim na mata ciliar do córrego Arco-Íris, Reserva Indígena Kadiwéu, MS.
As áreas estudadas apresentam diferentes arranjos na estrutura da fauna de formigas. Várias conjecturas podem ser apresentadas para explicar a desproporcionalidade dos registros de espécies para cada localidade, como a diferença no esforço amostral, o uso de metodologias não padronizadas entre as áreas, os efeitos sazonais e, também a experiência do coletor. Porém, não descartamos a real diferença na composição faunística de Formicidae entre as localidades, devido às condições específicas que cada área apresenta, principalmente em relação aos períodos de inundação que ocorrem no Chaco e no Pantanal. Como diferentes subconjuntos da fauna de Formicidae foram representados, no total das localidades amostradas, no estado de Mato Grosso do Sul, sugerimos que, tanto as áreas amostradas podem apresentar diferentes arranjos na estrutura da fauna de formigas, quanto, esses dados podem ser reflexo da metodologia não padronizada. As áreas de Florestas Estacionais Deciduais e Semideciduais, as fitofissionomias Chaquenhas e os ecótipos pantaneiros apresentaram uma lista expressiva de gêneros e espécies de formigas, ainda pouco representadas em coleções; muitos dos registros obtidos são novas ocorrências para o Mato Grosso do Sul. Aproximadamente 30% da fauna listada não era anteriormente conhecida para o Estado de Mato Grosso do Sul.
O status de conservação e possíveis conexões entre as áreas prístinas de florestas afetam o perfil da diversidade de espécies de formigas, criando oportunidades de colonização e sobrevivência de um número maior de espécies, em virtude da capacidade de suporte do meio, tanto em relação à população, como em relação à diversidade de espécies, proporcional à heterogeneidade dos ambientes. A conectividade das áreas florestadas cria corredores que favorecem a dispersão de espécies ( Andow, 1991Andow, D. A. 1991. Vegetacional diversity and arthropod population responses. Annual Review of Entomology 36:561-586. ; Byrne, 1994Byrne, M. M. 1994. Ecology of twig-dwelling ants in a wet lowland tropical forest. Biotropica 26:61-72. ; Delabie et al., 2007Delabie, J. H. C.; Jahyni, B.; Nascimento, I. C.; Mariano, C. S. F.; Lacau, S.; Campiolo, S.; Philott, S. M. & Leponce, M. 2007. Contribution of cocoa plantations to the conservation of native ants (Insecta: Hymenoptera: Formicidae) with a special emphasis on the Atlantic Forest fauna of southern Bahia, Brazil. Biodiversity and Conservation 16:2359-2384. ; Silvestre et al., 2012Silvestre, R.; Demétrio, M. F. & Delabie, J. H. C. 2012. Community structure of leaf-litter ants in a Neotropical dry forest: A biogeographic approach to explain betadiversity. Psyche 2012:1-15.). As áreas inseridas nos limites do Pantanal e do Chaco apresentaram uma estrutura faunística mais homogênea devido à influência direta do regime sazonal de cheia e seca bem definida ( Soriano & Galdino, 2002Soriano, B. M. A. & Galdino, S. 2002. Análise da distribuição da frequência mensal de precipitação para a subregião da Nhecolândia, Pantanal, Mato Grosso do Sul, Brasil. Boletim de Pesquisa 34:1-23. ). As áreas alagáveis como Pantanal, Chaco, Matas Ciliares e Várzeas, representam um real filtro para muitas espécies que nidificam na serapilheira. A biomassa mantida na serapilheira é outro fator preponderante na manutenção da diversidade de espécies ( Silvestre et al., 2012Silvestre, R.; Demétrio, M. F. & Delabie, J. H. C. 2012. Community structure of leaf-litter ants in a Neotropical dry forest: A biogeographic approach to explain betadiversity. Psyche 2012:1-15.). A caracterização faunística do Estado é extremamente relevante para corroborar com a proposta de uma diagonal seca que inclui as biotas da sub-região Chaquena ( Morrone, 2006Morrone, J. J. 2006. Biogeographic areas and transition zones of Latin America and the Caribbean islands based on panbiogeographic and cladistic analyses of the entomofauna. Annual Review of Entomology 51:467-494. ; Zanella, 2011Zanella, F. C. V. 2011. Evolução da Biota da Diagonal de Formações Abertas Secas da América do Sul. In: Carvalho, C. J. B. & Almeida, E. A. B. eds. Biogeografia da América do Sul. Padrões e processos. São Paulo, Editora Roca, p.198-220.).
Concluímos que é de fundamental importância ampliar as amostragens da fauna de formigas em outras regiões no Estado, para sermos capazes de conhecer o quanto da fauna é endêmica de cada região, contribuindo assim para aumentarmos as informações biogeográficas e reconhecermos quais tipos de filtros ambientais estão atuando para determinar a diversidade das assembleias de espécies de formigas, importante informação para fundamentarmos projetos de conservação.
Principais grupos de pesquisa e acervos. Os principais grupos de pesquisa no Brasil que desenvolvem trabalhos com Formicidae são: Sistemática, Evolução e Biologia de Hymenoptera, MZUSP; Laboratório de Mirmecologia, UESC/CEPLAC; Grupo de Estudo sobre a Biossistemática dos Artrópodes Neotropicais (GEBAN), UESB; Biodiversidade do Cerrado, UFG; Sistemática e Bioecologia de Formigas, MPEG; Bioecologia e Controle de Formigas Invasoras, UNESP; Biologia Comparada de Insetos, UFRRJ; Biologia dos Insetos Sociais, UECE; Biologia, Genética, Patologia e Ecologia de Abelhas, Vespas e Formigas, UFV; Pesquisa Básica e Aplicada com Formigas Cortadeiras, UFV; Comunidades de formigas urbanas e de serapilheira, UMC; Ecologia, Biologia Molecular e Filogenia de Cupins e Formigas, PUC; Campinas; Ecologia, Comportamento e História Natural de Formigas Neotropicais, Unicamp; Ecologia Comportamental e de Interações, UFU; Ecologia e Comportamento de Formigas, UFJF; Ecologia, Biologia e Controle Biológico de Insetos, UFT; Ecologia, Biologia e Genética Molecular de Insetos Sociais, UEFS; Formigas - Diversidade e funções ecológicas, UFLA; Formigas cortadeiras, UFPEL; Ecologia, Biogeografia e Conservação da Biota Neotropical, UFPE. No Estado de Mato Grosso do Sul destacam-se os grupos de pesquisa: Biodiversidade de Hymenoptera, UFGD; Manejo e Conservação de Insetos, UFGD; Biologia e Comportamento de Insetos Sociais, UEMS.
Os principais acervos de espécies-tipo de formigas estão no Museu de Zoologia da USP, São Paulo, sob curadoria do Dr. Carlos R. F. Brandão e no Laboratório de Mirmecologia da UESC/CEPLAC, sob curadoria do Dr. Jacques H. C. Delabie. Outros museus e coleções abrigam um acervo considerável como o Museu Emílio Goeldi, o Museu Nacional do Rio de Janeiro, o INPA na Amazônia e o Laboratório de Biologia Comparada de Hymenoptera da UFPR. Na Região Centro-Oeste destacam-se as coleções de Formicidae do Dr. Jorge M. Diniz da UFG e a coleção de Hymenoptera depositada no Museu de Biodiversidade (MuBio-FCBA-UFGD) sob a curadoria do Dr. Rogério Silvestre, que é a primeira coleção oficial de Formicidae implantada no Estado de Mato Grosso do Sul, com cerca de 400 espécies de formigas. A referida coleção também se encontra na base de dados e imagens do AntWeb.
Principais lacunas de conhecimento. Formicidae contempla mais de 15.957 nomes de espécies válidos mundialmente ( AntWeb, 2015AntWeb. 2015. Disponível em: < Disponível em: http://www.antweb.org
>. Acessado em 21/10/2013.
http://www.antweb.org...
), com estimativas que podem ultrapassar 20.000 espécies. Atualmente são 16 subfamílias e na Região Neotropical são conhecidas 14 destas, representadas por mais de 4.000 espécies válidas ( AntWiki, 2015AntWiki. 2015. Disponível em Disponível em http://www.http://www.antwiki.org/wiki/Species_Accounts
. Acesso em 30/09/2015.
http://www.http://www.antwiki.org/wiki/S...
). Ainda há uma imensa lacuna no conhecimento da fauna de formigas na região oeste do Brasil e na Amazônia Ocidental, com centenas de interações ecológicas e biologias para serem descritas. A padronização de coletas sistematizadas, apesar de ser bastante desenvolvida para o táxon, ainda é utilizada com pouca frequência. No estado do MS algumas regiões estão sob grande pressão antrópica, devido à mudança da base pecuária para a de monocultura agrícola. Pouco se sabe sobre a diversidade da entomofauna da região do Chaco brasileiro, que apresenta fitofisionomias arbóreas e florestadas muito particulares e que tem um grande contexto biogeográfico a ser explorado, mas que está desaparecendo numa velocidade alarmante em função do desmatamento. Esta região do Chaco seria apontada como um hotspot no Estado, pelo risco de desaparecimento eminente.
Perspectivas de pesquisa para o grupo nos próximos 10 anos. Existe a necessidade de se fortalecer a pesquisa mirmecológica no Estado, com o aumento da coleção científica de Formicidae, através de protocolos padronizados, configurando uma poderosa ferramenta de consulta para pesquisadores e estudantes, fomentando estudos mais direcionados em ecologia e biogeografia. A multiplicidade de ambientes naturais que o Mato Grosso do Sul apresenta permite um campo bastante amplo de investigação.
As ferramentas de identificação on-line que incluem fotos e mapas de ocorrência vêm estimulando novos pesquisadores e um avanço muito grande nos estudos de sistemática e ecologia são esperados para a próxima década. Com o avanço da Mirmecologia no Brasil algumas questões evolutivas e biogeográficas poderão ser respondidas para a Região Neotropical. Estamos próximos de conseguir um diagnóstico preciso da diversidade do táxon e de desvendar os padrões de raridade de espécies para a América do Sul.
Agradecimentos.
Agradecemos à Fundação de Apoio ao Desenvolvimento do Ensino, Ciências e Tecnologia do Estado de Mato Grosso do Sul (Fundect) e à Superintendência de Ciências e Tecnologia do Estado de Mato Grosso do Sul (Sucitec/MS) pelo convite de participação neste fascículo especial da Iheringia, Série Zoologia e o suporte financeiro para sua publicação. Nossos sinceros agradecimentos a Camila Aoki, Nelson Rodrigues da Silva pelas contribuições neste manuscrito; ao Dr. Jacques H. C. Delabie, Dr. Sebastien Lacau, Dr. Carlos Roberto Ferreira Brandão, Dr. Rogério Rosa da Silva, Dr. Rodrigo Feitosa e Benoit Jahyni pelo suporte oferecido e pela determinação de algumas espécies. Aos membros do “Exército de Libertação da Natureza”, coletores do Hecolab: Bhrenno Maycon Trad, Felipe Varussa de Oliveira Lima, Tiago Henrique Auko, Vander Carbonari, Thainá Grace Encina de Barros, Fabíola Bettinardi de Oliveira, Hadassa Costa, Rafael Crepaldi, Alcides Moraes, Daniel Alves (Xuxa), Murilo Moressi e Luna Carinyana Silvestre. Agradecemos a CAPES, CNPq e FAPESB e ao Instituto Chico Mendes pelo apoio recebido
REFERÊNCIAS BIBLIOGRÁFICAS
- Abdon, M. M. & Silva, J. S. V. 2006. Identificação de padrões em imagens Landsat-ETM+ para interpretação da vegetação arbórea do cerrado na sub-região de Cáceres, no Pantanal do estado do Mato Grosso. In: IX Semana de Geografia da Unemat. (SEMAGEO), Cáceres/MT. Anais… Cáceres, Unemat, p. 1-13.
- Agosti, D. & Alonso, L. E. 2000. The A. L. L. Protocol: a standard protocol for the collection of ground-dwelling ants. In: Agosti, D.; Majer, J. D.; Alonso, L. E. & Schultz, T. R. eds. Ants. Standard Methods for Measuring and Monitoring Biodiversity. Washington, Smithsonian Institution Press, p. 204-206.
- Andow, D. A. 1991. Vegetacional diversity and arthropod population responses. Annual Review of Entomology 36:561-586.
- AntWeb. 2015. Disponível em: < Disponível em: http://www.antweb.org >. Acessado em 21/10/2013.
» http://www.antweb.org - AntWiki. 2015. Disponível em Disponível em http://www.http://www.antwiki.org/wiki/Species_Accounts Acesso em 30/09/2015.
» http://www.http://www.antwiki.org/wiki/Species_Accounts - Barrow, L.; Parr, C. L. & Kohen, J. L. 2006. Biogeography anddiversity of ants in Purnululu (Bungle Bungle) National Park and Conservation Reserve, Western Australia. Australian Journal of Zoology 54:123-136.
- Boggiani, P. C.; Fairchild, T. R. & Coimbra, A. M. 1993. O grupo Corumbá (Neoproterozóico-Cambriano) na região central da Serra da Bodoquena (Faixa Paraguai) Mato Grosso do Sul. Revista Brasileira de Geociências 23:301-305.
- Bordignon, M. O. & França, A. O. 2004. Análise preliminar sobre a diversidade de morcegos no Maciço do Urucum, Mato Grosso do Sul, Brasil. Simpósio Sobre Recursos Naturais e Socioeconômicos do Pantanal, IV SINPAN. Corumbá, Embrapa Pantanal, p. 1-4.
- Brandão, C. R. F.; Diniz, L. M. & Tomotake, E. M. 1991. Thaumatomyrmex strips millipedes for prey, a novel predatory behaviour in ants and the first case of sympatry in the genus. Insectes Sociaux 38:335-344.
- Bucher, H. 1980. Ecología de la fauna Chaqueña. Una revisón. Ecosur 7(4):111-159.
- Byrne, M. M. 1994. Ecology of twig-dwelling ants in a wet lowland tropical forest. Biotropica 26:61-72.
- Colwell, R. K. 2006. EstimateS. Statistic estimation of species richness and shared species from samples. Version 8.2. Disponível em < Disponível em http://viceroy.eeb.uconn.edu/estimates >. Acessado em 21/10/2013.
» http://viceroy.eeb.uconn.edu/estimates - Del Toro, I.; Silva R. R & Ellison A. M. 2015. Predicted impacts of climatic change on ant functional diversity and distributions in eastern North American forests. Diversity and Distributions 21(7):781-791.
- Delabie, J. H. C.; Jahyni, B.; Nascimento, I. C.; Mariano, C. S. F.; Lacau, S.; Campiolo, S.; Philott, S. M. & Leponce, M. 2007. Contribution of cocoa plantations to the conservation of native ants (Insecta: Hymenoptera: Formicidae) with a special emphasis on the Atlantic Forest fauna of southern Bahia, Brazil. Biodiversity and Conservation 16:2359-2384.
- Delsinne, T.; Leponce, M. Theunis, L.; Braet, Y. & Roisin, Y. 2008. Rainfall Influences Ant Sampling in Dry Forests. Biotropica 40(5):590-596.
- Felfili, J. M. 2003. Fragmentos florestais estacionais do Brasil Central: diagnóstico e proposta de corredores ecológicos. In: Costa, R. B. ed. Fragmentação florestal e alternativas para o desenvolvimento rural na região Centro-Oeste. Campo Grande, UCDB, p. 139-160.
- Miles, L.; Newton, A. C.; Defries, R. S.; Ravilious, C.; May, I.; Blyth, S.; Kapos, V. & Gordon, J. E. 2006. A global overview of the conservation status of tropical dry forests. Journal of Biogeography 33:491-505.
- Morrone, J. J. 2006. Biogeographic areas and transition zones of Latin America and the Caribbean islands based on panbiogeographic and cladistic analyses of the entomofauna. Annual Review of Entomology 51:467-494.
- Morrone, J. J.; Mazzucconi, S. A. & Bachmann, A. O. 2004. Distributional patterns of Chacoan water bugs (Heteroptera: Belostomatidae, Corixidae, Micronectidae and Gerridae). Hydrobiologia 523:159-173.
- Noguchi, D. K.; Nunes, G. P. & Sartori, A. L. B. 2009. Florística e síndromes de dispersão de espécies arbóreas em remanescentes de Chaco de Porto Murtinho, Mato Grosso do Sul, Brasil. Rodriguésia 60(2):353-365.
- Pagotto, C. S. & Souza, P. R. org. 2006. Biodiversidade do Complexo Aporé-Sucuriú. Subsídios à conservação e ao manejo do cerrado: área prioritária 316-Jauru. Campo Grande, Editora UFMS. 308p.
- Pott, A. & Pott, V. J. 2003.Espécies de fragmentos florestais em Mato Grosso do Sul. In: Costa, R. B. org. Fragmentação florestal e alternativas de desenvolvimento rural na região centro-oeste. Campo Grande, UCDB p. 26-52.
- Prado, D. E. & Gibbs, P. E. 1993. Patterns of species distribution in the dry seasonal forest of South America. Annals of the Missouri Botanical Garden 80:902-927.
- Silva, R. R. & Brandão, C. R. F. 2010. Morphological patterns and community organization in leaf-litter ant assemblages. Ecological Monographs 80(1):107-124.
- Silva, R. R. & Silvestre, R. 2004. Riqueza da fauna de formigas (Hymenoptera: Formicidae) que habita as camadas superficiais do solo em Seara, Santa Catarina. Papéis Avulsos de Zoologia 44:1-11.
- Silvestre, R.; Brandão, C. R. F. & Silva, R. R. 2003. Grupos funcionales de hormigas: el caso de los gremios del Cerrado, Brasil. In: Fernández, F. ed. Introducción a las hormigas de la región Neotropical. Bogotá, Instituto Humboldt, p.113-143.
- Silvestre, R.; Demétrio, M. F. & Delabie, J. H. C. 2012. Community structure of leaf-litter ants in a Neotropical dry forest: A biogeographic approach to explain betadiversity. Psyche 2012:1-15.
- Soriano, B. M. A. & Galdino, S. 2002. Análise da distribuição da frequência mensal de precipitação para a subregião da Nhecolândia, Pantanal, Mato Grosso do Sul, Brasil. Boletim de Pesquisa 34:1-23.
- Spichiger, R.; Calenge, C. & Bispe, B. 2004.Geographical zonation in the Neotropics of tree species characteristic of the Paraguay-Parana Basin. Journal of Biogeography31:1489-1501.
- Uetanabaro, M.; Souza, F. L.; Filho, P. L.; Beda, A. F. & Brandão, R. A. 2007. Anfíbios e répteis do Parque Nacional da Serra da Bodoquena, Mato Grosso do Sul, Brasil. Biota Neotropica 7(3):279-289.
- Vanzolini, P. E. 1988. Distributional patterns of South American Lizards. In: Vanzolini, P. E. & Heyer, W. R. eds. Proceedings of a Workshop on Neotropical Distribution Patterns. Rio de Janeiro, Academia Brasileira de Ciências, p. 317-342.
- Wall, D. H. & Moore, J. C. 1999. Interactions underground. BioScience 49(2):109-117.
- Yanoviak, S. P. & Kaspari, M. 2000. Community structure and the habitat templet: ants in the tropical forest canopy and litter. Oikos 89:259-266.
- Zanella, F. C. V. 2011. Evolução da Biota da Diagonal de Formações Abertas Secas da América do Sul. In: Carvalho, C. J. B. & Almeida, E. A. B. eds. Biogeografia da América do Sul. Padrões e processos. São Paulo, Editora Roca, p.198-220.
Apêndice I.
Datas de Publicação
-
Publicação nesta coleção
2017
Histórico
-
Recebido
26 Dez 2016 -
Aceito
06 Fev 2017