Resumo
The rhythm of movements and feeding activity of juveniles of Loricariichthys anus (Valenciennes, 1840) in the Quadros lake, South Brazil, are investigated. Between October 1997 and August 1998, 236 specimens were captured during six bimonthly 24 hour gillnet surveys. Significantly elevated levels of movement and feeding activity during the day are registered. The patterns of movement and feeding activity displayed no significant difference, suggesting that high movement activity levels can be attributed to feeding activity. The mean of the intestinal quotient was 1,89, indicating omnivorous feeding habits.
Loricariichthys anus; juvenile; feeding rhythm; intestinal quotient
Loricariichthys anus; juvenile; feeding rhythm; intestinal quotient
Ritmo de alimentação de juvenis de Loricariichthys anus (Siluriformes, Loricariidae) da Lagoa dos Quadros, RS, Brasil
Feeding activity of juveniles of Loricariichthys anus (Siluriformes, Loricariidae) in the Quadros Lake, RS, Brasil
Ana Cristina Petry; Uwe Horst Schulz
Laboratório de Ecologia de Peixes, Centro de Ciências da Saúde. Universidade do Vale do Rio dos Sinos, UNISINOS. Caixa Postal 275, CEP 93022-010, São Leopoldo, RS, Brasil
ABSTRACT
The rhythm of movements and feeding activity of juveniles of Loricariichthys anus (Valenciennes, 1840) in the Quadros lake, South Brazil, are investigated. Between October 1997 and August 1998, 236 specimens were captured during six bimonthly 24 hour gillnet surveys. Significantly elevated levels of movement and feeding activity during the day are registered. The patterns of movement and feeding activity displayed no significant difference, suggesting that high movement activity levels can be attributed to feeding activity. The mean of the intestinal quotient was 1,89, indicating omnivorous feeding habits.
Keywords:Loricariichthys anus, juvenile, feeding rhythm, intestinal quotient.
INTRODUÇÃO
As espécies de peixes podem diferir amplamente nos seus padrões diários de atividade alimentar. Entretanto, a causa principal dos padrões de atividade é muitas vezes difícil de ser estabelecida, sendo que os mesmos podem funcionar como resposta ao risco de predação e disponibilidade de alimento (METCALFE et al., 1999). A variabilidade da morfologia de órgãos como estômago, intestino, dentes e arcos branquiais reflete o desenvolvimento adaptativo do sistema digestivo aos hábitos alimentares (VERIGINA, 1990). Dessa forma, o comprimento intestinal, nos peixes, pode funcionar como um indicador da dieta (KRAMER & BRYANT, 1995).
Loricariichthys anus (Valenciennes, 1840), conhecida popularmente por cascudo-viola, é uma das espécies mais numerosas da Lagoa dos Quadros, e, em função de sua importância para a pesca local e boa aceitação no mercado, pode ser um potencial candidato para a aqüicultura. Entretanto, pouco é conhecido sobre a biologia da espécie.
Objetiva-se investigar os ritmos de movimentação e alimentação dos indivíduos juvenis de L. anus da Lagoa dos Quadros, determinar a atividade nictemeral e estabelecer o quociente intestinal da espécie, relacionando-o ao espectro alimentar.
MATERIAL E MÉTODOS
A Lagoa dos Quadros, situada no litoral norte do Rio Grande do Sul, 29º40' S, 50º06' W, é uma das maiores lagoas costeiras do Estado. Sua área é de 119 km2 , com profundidade média de 4,22 m (SCHÄFER, 1992). Os ventos na região da lagoa causam, freqüentemente, circulações diárias no corpo d'água, resultando níveis altos de oxigenação e turbidez.
As coletas foram realizadas bimestralmente, no período de outubro de 1997 a agosto de 1998, próximo à margem da lagoa, junto à estação de aqüicultura da FEPAGRO (Fundação Estadual de Pesquisa Agropecuária), no município de Terra de Areia, RS. O local da captura apresenta profundidade de 1,5 a 2 m, fundo arenoso e presença de juncos. Os dados sobre a temperatura da água no período da captura foram registrados a cada hora, através de leitura pelo registrador automático Minilog (VEMCO, Canadá).
Para a captura foram utilizadas duas redes de espera, malha 15 mm de entre-nós, 20 m de comprimento e 1,5 m de altura. As coletas foram realizadas a cada 4 horas, num período total de 24h, sendo obtidas seis amostragens a cada campanha. As revistas para o recolhimento dos peixes capturados levaram, em média, 10 minutos no final de cada intervalo de 4 horas.
A atividade de movimentação de L. anus foi estabelecida com base na freqüência de indivíduos capturados a cada 4 horas, relativa à captura total do período de 24 horas. Utilizou-se a freqüência dos peixes capturados e do peso seco do conteúdo intestinal relativa ao período de 24 horas, com a finalidade de equilibrar os dados, em função das grandes variações no número de peixes capturados nas campanhas (nmín = 18; nmáx = 98), bem como para possibilitar a comparação dos padrões apresentados pelos ritmos de movimentação e alimentação dos indivíduos.
A atividade alimentar foi determinada pela avaliação do peso seco do conteúdo presente no tubo digestivo, cuja desidratação foi efetuada em estufa a 45ºC, até a estabilização do peso (BAGENAL, 1978). Os valores do peso seco, nos diferentes períodos de captura, também foram transformados em valores relativos ao peso registrado em cada campanha.
Efetuou-se o registro do comprimento total (cm; CT) e comprimento intestinal (cm; CI). O quociente intestinal (QI) foi determinado através da razão do comprimento do intestino pelo comprimento total (BARBIERI et al., 1994), por meio da expressão: QI = CI / CT. A investigação do grau de maturidade gonadal (VAZZOLER, 1996) demonstrou que 93 % da amostra constituíram-se de indivíduos juvenis.
A análise estatística dos dados foi realizada através dos softwares SPSS, versão 8.0 e STATISTIX 1996, versão 1.0. A existência de correlação entre o número de indivíduos capturados e a temperatura da água, assim como entre o CT e o CI, foi testada pela correlação linear de PEARSON. No teste da normalidade da distribuição do CT aplicou-se o Wilk-Shapiro Rankit Plot. Para investigar se os níveis de atividade de movimentação e alimentação diferem durante o dia (8-20h) e a noite (20-8h), adotou-se o teste Multinominal, comparando os valores esperados com aqueles observados, com um nível de significância p < 0,05. A hipótese zero testada foi: os níveis de movimentação e alimentação são iguais durante o dia e a noite resultando, desta forma, em valores esperados de 50 % para cada turno. Na comparação dos padrões apresentados pelos ritmos de movimentação e alimentação, em suas respectivas freqüências mínimas e máximas, utilizou-se as funções do teste Kolmogorov-Smirnov, com um nível de significância p < 0,05. Uma parte da captura foi depositada na coleção de referência do Museu de Zoologia, Universidade do Vale do Rio dos Sinos, São Leopoldo (UNISINOS).
RESULTADOS
Durante o período de amostragem foram capturados 236 indivíduos. O número de exemplares nas capturas variou de 18 (outubro) a 98 (dezembro), demonstrando uma tendência de aumento durante o verão (fig. 1). Contudo, a correlação entre o número de peixes capturados e a temperatura da água não foi significativa (r = 0,55; p = 0,3). A distribuição das classes de comprimento dos peixes capturados seguiu um padrão normal, com um comprimento médio de 19,9 cm (± 3,5).
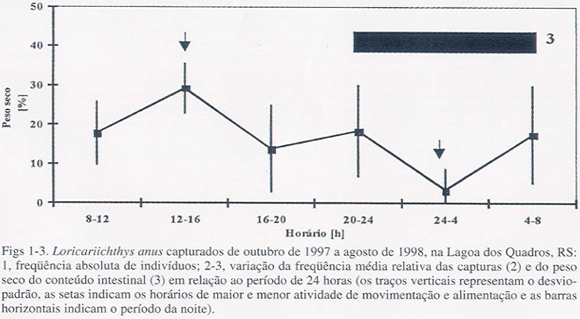
Conforme evidenciam as variações ao longo de 24h, 66% dos indivíduos foram capturados durante o dia e 34% durante a noite (fig. 2). O teste Multinominal demonstrou diferença significativa na comparação dos valores esperados com os valores observados (χ2 = 10,24; p = 0,001). A maior atividade de movimentação ocorreu entre 12 e 16h e a menor atividade entre 24 e 4h. O padrão de atividade alimentar seguiu o mesmo ritmo, demonstrando diferença significativa entre os períodos do dia e noite (fig. 3). Encontrou-se 62 % do peso seco total no intervalo do dia e 38 % no intervalo da noite (χ2 = 5,76; p = 0,016). A maior atividade ocorreu entre 12 e 16h, e a menor entre 24 e 4h. O teste Kolmogorov-Smirnov não detectou diferenças significativas na distribuição entre o ritmo de movimentação (fig. 2) e o padrão do ritmo de alimentação (fig. 3).
O comprimento do intestino variou entre 14,3 e 68,2 cm, com uma média de 37,6 cm (±9,7). Verificou-se uma correlação linear significativa entre o comprimento total do peixe e do intestino (r = 0,76; p<0,0001). O quociente intestinal médio foi 1,9 (±0,33) e sua distribuição seguiu um padrão normal.
DISCUSSÃO
Os Siluriformes, em geral, apresentam um ritmo de atividade noturno, como Silurus glanis (Linnaeus, 1758), o maior peixe de água doce europeu (WHEELER, 1983; Boujard & Luquet, 1996 apud BARAS et al., 1999). Para os Siluriformes da América do Sul, os padrões de atividade alimentar têm sido estabelecidos somente para algumas espécies (PEREIRA et al., 1982; SABINO & CASTRO, 1990; BUCK & SAZIMA, 1995; CASATTI & CASTRO, 1998). O ritmo de atividade noturno é exibido por Rhamdia sp. do lago de Valência, Venezuela (PEREIRA et al., 1982), Rhamdella minuta (Luetken, 1875) do Rio Indaiá, São Paulo (SABINO & CASTRO, 1990) e Hoplosternum littorale (Hancock, 1828) em lagoas da planície de inundação do Alto Rio Paraná, Brasil (HAHN et al., 1997). Entretanto, esse comportamento não foi observado nos indivíduos juvenis de L. anus da Lagoa dos Quadros. O ritmo diurno desses animais poderia estar relacionado com a alta turbidez da água da lagoa, uma vez que esta reduz a eficiência dos potenciais predadores do L. anus, que buscam alimento por meio de orientação visual. A mudança no comportamento de predadores de orientação visual foi descrita por NETTLES et al. (1987) para Salmo trutta (Linnaeus, 1758), que evitou áreas de alta turbidez do Lago Ontário e por CROWL (1989) para Micropterus salmoides (Lacepede, 1802), que alterou suas táticas de forrageio em relação à visibilidade da presa.
Investigando a atividade de loricarídeos de um riacho brasileiro, BUCK & SAZIMA (1995) encontraram padrões diferenciados de atividade para indivíduos adultos e juvenis de Harttia kronei (Miranda-Ribeiro, 1908) e Kronichthys heylandi (Boulanger, 1900). Essas diferenças no ritmo de atividade alimentar foram descritas para Harttia sp. e Hypostosmus garmani (Regan, 1904) nas cabeceiras do Rio São Francisco (CASATTI & CASTRO, 1998). Apesar de não haver explicação aparente para o comportamento diferenciado, BUCK & SAZIMA (1995) consideram possível que o ritmo diurno de atividade dos juvenis de H. kronei possa ser um componente do comportamento anti-predatório. POWER (1984) relatou a influência da predação na atividade e distribuição de loricarídeos em riachos no Panamá. Esse autor considerou fraca a variação do ritmo diurno e noturno dos animais, relacionando-a com o comportamento das aves piscívoras e mamíferos no Río Frijoles, que por sua vez, apresentam hábitos diurnos e noturnos. Entretanto, os peixes evitaram as áreas rasas, onde são mais suscetíveis aos predadores, preferindo as partes mais profundas para sua alimentação.
A relação entre a freqüência de peixes capturados nos diferentes horários representa uma medida da sua mobilidade. Dessa forma, foi verificada a existência de uma relação entre a mobilidade e a atividade alimentar, a partir da variação dos valores médios das capturas e do peso seco do conteúdo intestinal dos indivíduos amostrados. ANRAS et al. (1998) constataram o mesmo para Coregonus clupeaformis (Lacepede, 1803), Salmoniformes, em um experimento no Canadá, onde o nível máximo de movimentação ocorria no período de alimentação dos peixes.
A ocorrência de adaptações do organismo ao regime alimentar, na estrutura e comprimento do conduto gastrointestinal, pode refletir-se no alongamento do tubo digestivo no regime vegetariano, encurtamento no carnívoro e nos tamanhos intermediários pelo omnívoro (GURGEL et al., 1991). BARBIERI et al. (1994) estabeleceram relações entre o comprimento do intestino e o dos indivíduos para espécies de peixes, associando-as com o hábito alimentar investigado em outros trabalhos. Esses autores consideram o quociente intestinal uma medida diagnóstica que corrobora a determinação do regime alimentar dos peixes. Entretanto, para KRAMER & BRYANT (1995), as variações do quociente intestinal de peixes em diferentes categorias tróficas são, freqüentemente, amplas e sobrepostas.
Analisando o espectro alimentar de três espécies do Rio Paraná, FUGI & HAHN (1991) estabeleceram relações com a morfologia do aparelho digestivo, fazendo uso do comprimento padrão para fins de cálculo do índice intestinal. O valor médio do índice intestinal de Loricariichthys platymetopon (Issbrücker & Nijssen, 1979) foi de 1,9 (± 0,21), menor em relação ao de Prochilodus scrofa (Steindachner, 1882) e Curimata insculpta (Fernando-Yepez, 1948), consideradas iliófagas. Em função da maior proporção de detrito em seu espectro alimentar, L. platymetopon foi caracterizada como detritívora.
O valor do QI médio de L. anus é maior do que 1,17, QI determinado para o carnívoro Arius luniscutis (Cuvier & Valenciennes, 1840) (GURGEL et al., 1991) e menor do que 4,66, QI de Metynnis cf. rooseveltii (Eigenmann, 1915), considerado herbívoro (GURGEL et al., 1991). Valores de QI intermediários foram encontrados em outros omnívoros estudados por SABINO & CASTRO (1990) como Phalloceros caudimaculatus (Hensel, 1868), Deuterodon iguape (Eigenmann, 1907) e Geophagus brasiliensis (Quoy & Gaimard, 1824) que apresentaram, respectivamente QI de 1,78, 1,11, e 1,45.
A análise da dieta de 334 espécimens de L. anus da Lagoa dos Quadros detectou a presença de material vegetal, larvas de insetos aquáticos, com predominância de zooplâncton (Márcia F. Schneider, com. pessoal). A comparação do QI determinado para L. anus com aquele investigado por outros autores, para espécies que exibem hábitos alimentares carnívoro, herbívoro e omnívoro, bem como as informações sobre a origem do alimento utilizado relacionam a espécie investigada ao hábito alimentar omnívoro.
Agradecimentos. Ao coordenador do projeto "Corredor Ecológico Integrado do Litoral Norte", pelo auxílio financeiro obtido; à FEPAGRO, por ceder as instalações da Estação de Aqüicultura de Terra de Areia para a realização das coletas; e ao CNPq, pela bolsa de Iniciação Científica concedida ao primeiro autor.
Recebido em 14.05.1999; aceito em 27.12.1999.
- ANRAS, M. L. B.; BODALY, R. A. & MCNICOL, R. 1998. Use of na Acoustic Beam Actograph to Assess the Effects of External Tagging Procedure on Lake Whitefish Swimming Activity. Trans. Am. Fish. Soc., Bethesda, 127(2):329-335.
- BAGENAL, T. 1978. Methods for Assessment of Fish Production in Fresh Waters. Oxford, Blackwell Scientific. 352 p.
- BARAS, E.; TISSIER, F. et al. 1999. Sibling cannibalism among juvenile vundu under controlled conditions. II. Effect of body weight and environmental variables on the periodicity and intensity of type II canibalism. J. Fish. Biol., London, 54:106-118.
- BARBIERI, G.; PERET, A. C. & VERANI, J. R. 1994. Notas sobre a adaptação do trato digestivo ao regime alimentar em espécies de peixes da região de São Carlos (SP). I. Quociente Intestinal. Revta bras. Biol., Rio de Janeiro, 54(1):63-69.
- BUCK, S. & SAZIMA, I. 1995. An assemblage of mailed catfishes (Loricariidae) in southeastern Brazil: distribution, activity, and feeding. Ichthyol. Explor. Fresh., München, 6(4):325-332.
- CASATTI, L. & CASTRO, R. M. C. 1998. A fish community of the São Francisco River headwaters riffles, southeastern Brazil. Ichthyol. Explor. Freshwaters, München, 9(3):229-242.
- CROWL, T. A. 1989. Effects of crayfish size, orientation, and movement on the reactive distance of largemouth bass foraging in clear and turbid water. Hydrobiologia, Dordrecht, 183(2):133-140.
- FUGI, R. & HAHN, N. S. 1991. Espectro alimentar e relações morfológicas com o aparelho digestivo de três espécies de peixes comedores de fundo do Rio Paraná, Brasil. Revta bras. Biol., Rio de Janeiro, 51(4):873-879.
- GURGEL, H. C. B.; BARBIERI, G. et al. 1991. Análise quantitativa e qualitativa da nutrição de Arius luniscutis Cuvier & Valenciennes, 1840 (Siluriformes, Ariidae) do Estuário do Rio Potengi (Natal/RN). In: SEMANA REGIONAL DE ECOLOGIA, 4Ş, São Carlos. Anais... UFSCAR. p. 169-182.
- HAHN, N. S.; LESCANO DE ALMEIDA, V. L. & GASPAR DA LUZ, K. D. 1997. Alimentação e ciclo alimentar diário de Hoplosternum littorale (Hancock) (Siluriformes, Callichthyidae) nas lagoas Guaraná e Patos da planície do alto Rio Paraná, Brasil. Revta bras. Zool., São Paulo, 14(1):57-64.
- KRAMER, D. L. & BRYANT, M. J. 1995. Intestine length in the fishes of a tropical stream: 1. Ontogenetic allometry. Env. Biol. Fish., Dordrecht, 42:115-127.
- METCALFE, N. B.; FRASER, N. H. C. & BURNS, M. D. 1999. Food availability and the nocturnal vs. Diurnal foraging trade-off in juvenile salmon. J. Anim. Ecology, Oxford, 68:371-381.
- NETTLES, D. C.; HAYNES, J. M. et al. 1987. Seasonal movements and habitats of brown trout (Salmo trutta) in southcentral lake Ontario. J. Great Lakes Res., Ann Arbor, 13(2):168-177.
- PEREIRA, G.; ESCLAPES, M. E. & WEIBEZAHN, F. 1982. Contribucion al conocimiento de la ecologia alimentaria de algunos peces del Lago de Valencia (Venezuela). Mem. Soc. Ciens. Nat. La Salle, Caracas, 17:41-56.
- POWER, M. E. 1984. Depth distributions of armored cartifish: predator-induced resource avoidance? Ecology, Washington, 65(2):523-528.
- SABINO, J. & CASTRO, R. M. C. 1990. Alimentação, período de atividade e distribuição espacial dos peixes de um riacho da floresta Atlântica (Sudeste do Brasil). Revta bras. Biol., Rio de Janeiro, 50(1):23-36.
- SCHÄFER, A. 1992. Die Küstenseen Südbrasiliens Stuttgart, Franz Steiner. 203 p.
- VAZZOLER, A. E. A. de M. 1996. Biologia da reprodução de peixes teleósteos: teoria e prática. Maringá, EDUEM. 169 p.
- VERIGINA, I. A. 1990. Basic adaptations of the digestive system in bony fishes as a function of diet. J. Ichthyol., Moscow, 30(6):897-907.
- WHEELER, A. 1983. Süsswasserfische. London, Kingfisher Books. 124 p.
Datas de Publicação
-
Publicação nesta coleção
23 Ago 2010 -
Data do Fascículo
Nov 2000
Histórico
-
Recebido
14 Maio 1999 -
Aceito
27 Dez 1999