Atletas; cardiomiopatia dilatada; exercício; corrida; desempenho atlético
RELATO DE CASO
Corredor de longa distância com cardiomiopatia dilatada e excelente desempenho
Luciana Diniz Nagem Janot de MatosI,II; Luciene Ferreira AzevedoI; Patrícia Chakur BrumIII; Eduardo Argentino SosaI; Martino MartinelliI; Carlos Eduardo NegrãoI,III
IInstituto do Coração da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP - Brasil
IIHospital Israelita Albert Einstein, São Paulo, SP - Brasil
IIIEscola de Educação Física e Esporte da Universidade de São Paulo, São Paulo, SP - Brasil
Correspondência Correspondência: Luciana Diniz Nagem Janot de Matos Alameda Fernão Cardim, 140/192 - Jardim Paulista 01403020 - São Paulo, SP - Brasil E-mail: cndluciana@cardiol.br, lucianajanot@einstein.br
Palavras-chave: Atletas, cardiomiopatia dilatada, exercício, corrida, desempenho atlético.
Relato de caso
Esse relato de caso foi aprovado pela CAPPesq-HC e o paciente autorizou sua publicação.
Um corredor amador de 55 anos foi encaminhado ao Ambulatório de Cardiologia do Esporte para avaliação cardiovascular e melhora no desempenho aeróbico. Nos últimos dez anos, ele havia treinado corrida aeróbica com intensidade moderada (entre 74-90% da frequência cardíaca (FC) máxima) e vigorosa (acima de 90% da FC máxima), de 10 a 30 km/dia, 6 dias por semana. De fato, ele estava envolvido em competições de corrida uma vez por mês e corria 10 km em 42 minutos. O atleta não apresentava sintomas de doenças cardiovasculares, mas tinha histórico familiar de morte súbita prematura (mãe e pai).
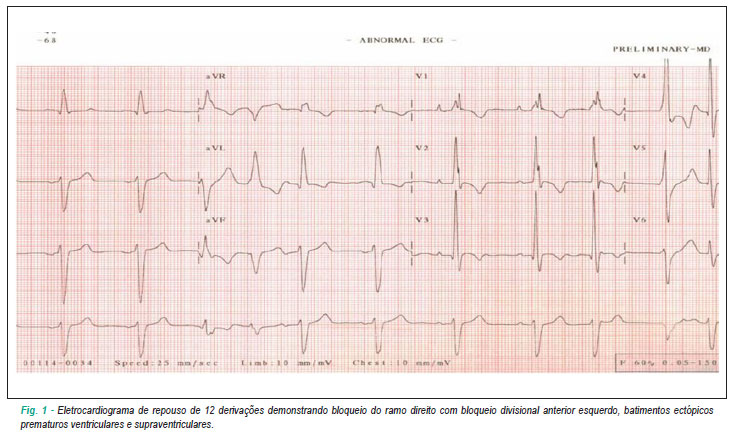
O ECG de 12 derivações revelou ritmo sinusal, bloqueio de ramo direito com bloqueio divisional anterior esquerdo associado com batimentos ectópicos ventriculares e supraventriculares prematuros (Figura 1). A ecocardiografia mostrou dilatação ventricular moderada com aumento das dimensões ventriculares internas direita e esquerda (50 mm e 60 mm, respectivamente) e diminuição da fração de ejeção do ventrículo esquerdo (FEVE, 30%). O teste de esforço cardiopulmonar na esteira (protocolo de rampa) mostrou um consumo de oxigênio de pico (VO2 pico) de 42 ml.kg-1.min-1 (125% de VO2 pico predito para idade)1, frequência cardíaca máxima de 147 bpm (90% da frequência cardíaca máxima predita), pulso máximo de oxigênio de 14.8 ml/batimento, limiar anaeróbico a 59% do VO2 pico, ponto de compensação respiratória a 85% do VO2 pico e 7,8 mph com inclinação 9% no pico do exercício.
As alterações no ECG e o fato de que o atleta havia nascido em Minas Gerais, uma região brasileira endêmica para Doença de Chagas, nos levaram a realizar um teste sorológico no sangue. O teste confirmou a Doença de Chagas como a etiologia para o diagnóstico da cardiomiopatia. Um exame mais detalhado revelou alto grau de batimentos ventriculares ectópicos (242 batimentos por hora) e taquicardia ventricular polimórfica não-sustentada durante a monitoração de Holter por 24 horas. Um fluxograma clínico é mostrado na Figura 2. Os estudos autonômicos por microneurografia2 mostraram efluxo simpático comparável ao encontrado em indivíduos saudáveis pareados por idade (20 impulsos/min). De forma similar, o fluxo sanguíneo no antebraço e as respostas da condução vascular no antebraço ao exercício da preensão manual avaliados através de pletismografia não foram diferentes das respostas observadas em nosso laboratório em indivíduos saudáveis (1,72 - 2,57 ml.min-1.100 ml tecido-1 e 1,96 - 2,68 Unidades, respectivamente). Manifestações não-cardíacas da Doença de Chagas não foram observadas nesse paciente.
Com base nas avaliações clínicas, o atleta foi desqualificado para competições de acordo com as recomendações internacionais3. Terapia farmacológica foi iniciada (inibidor de ECA - 40 mg por dia, beta-bloqueador - 12,5 mg por dia e diuréticos - 25 mg por dia) e treino aeróbico moderado (caminhada/corrida com FC entre o limiar anaeróbico e o ponto de compensação respiratória, 4 vezes por semana, 10 km/dia) foi recomendado. Após seis meses de seguimento, o atleta relatou um episódio de síncope sem relação com exercício e um estudo eletrofisiológico foi realizado. O exame revelou taquicardia ventricular sustentada monomórfica mal tolerada. A fim de evitar morte súbita, um cardioversor desfibrilador implantável (CDI) foi implantado no paciente. Durante o seguimento, o VO2 pico diminuiu para 31 ml.kg-1.min-1 (98 % do VO2 pico previsto para sua idade)1, mas ele permaneceu assintomático e nenhum choque foi relatado durante as sessões de treinamento. No ultimo seguimento, o VO2 pico estava significantemente reduzido a 19,9 ml.kg-1.min-1, (63% do previsto para a idade), o que foi associado com um funcionamento inadequado do marcapasso relacionado à redução da sensibilidade ventricular e arritmia supraventricular. O modo de estímulo do marcapasso foi mudado para modo VVI e a frequência de demanda reduzida para 40 ppm, o que resultou na melhora imediata de sua capacidade funcional.
Discussão
A cardiomiopatia dilatada é caracterizada por dilatação ventricular esquerda e disfunção sistólica. O paciente descrito aqui apresentava dois riscos para o desenvolvimento de cardiomiopatia dilatada: história familiar (pai e mãe morreram de morte súbita antes dos 40 anos) e infecção por Doença de Chagas (DC). A DC é uma doença parasitária transmitida aos seres humanos através das fezes de insetos hematófagos contaminados por um protozoário chamado Trypanosoma cruzi. A Organização Mundial da Saúde4 indica que há 18 milhões de pessoas cronicamente infectadas pelo Trypanosoma cruzi (T cruzi) e 200.000 novos casos ocorrem a cada ano. O envolvimento cardíaco é a manifestação mais frequente e mais grave da DC crônica, tipicamente resultando em arritmias atriais e ventriculares, insuficiência cardíaca e fenômenos tromboembólicos. O curso clínico da DC é variável e a identificação de pacientes em risco de morte permanece um desafio.
Embora a cardiomiopatia dilatada represente apenas 2% de todas as causas de morte súbita arrítmica em jovens/adultos que praticam atividades esportivas5, seu diagnóstico em atletas tem importantes implicações clínicas. Atletas com cardiomiopatia dilatada podem ser completamente assintomáticos, o que significantemente aumenta o risco de morte súbita durante exercício vigoroso. O presente caso mostra alguns achados muito interessantes. A despeito da cardiomiopatia dilatada, nosso atleta apresentava uma capacidade funcional extraordinária, o que fortemente sugere que sua capacidade de exercício dependia grandemente de adaptação periférica. Esse achado é consistente com estudos anteriores, os quais mostraram que a prática de exercícios melhora a tolerância ao exercício em pacientes disfunção ventricular esquerda grave ou moderada6,7, melhorando a captação e o uso do oxigênio, enzimas oxidativas musculares8 e alterações na composição das fibras musculares oxidativas9.
Outro achado interessante foi o controle neurovascular normal no caso relatado. A despeito da disfunção ventricular esquerda, a atividade nervosa simpática muscular e a resposta do fluxo sanguíneo muscular durante o exercício de preensão manual estavam dentro dos limites normais. Estudos anteriores tem mostrado de forma consistente que ambos os níveis de efluxo simpático e fluxo sanguíneo muscular estão diretamente associados com a gravidade da disfunção ventricular esquerda. Por que essa associação não foi vista no presente caso? A resposta à essa questão está fora do escopo do presente relato de caso, mas é legítimo atribuir o controle neurovascular normal ao alto nível de prática de exercícios físicos em nosso paciente. De fato, investigações anteriores claramente demonstraram que a prática de exercícios físicos dramaticamente reduz a atividade nervosa simpática muscular e significantemente melhora o fluxo sanguíneo em pacientes com disfunção ventricular esquerda7. É possível que a atenuação da vasoconstrição, e portanto, a resposta preservada do fluxo sanguíneo muscular durante o exercício tenham contribuído para o alto nível de VO2 pico em nosso paciente.
É também importante enfatizar a necessidade de acompanhar os parâmetros do CDI em pacientes com cardiomiopatia dilatada que praticam exercícios físicos regulares. Observamos que um simples ajuste inapropriado dos parâmetros do marcapasso foi suficiente para resultar em piora clinica e da capacidade funcional. Nesse caso, o teste cardiopulmonar foi fundamental para definir o melhor ajuste dos parâmetros. O tempo de intervalo de monitorização clínica de pacientes com cardiomiopatia dilatada é essencial e deve ser considerado individualmente. As avaliações de nosso paciente foram realizadas a cada três meses.
De fato, há poucos dados disponíveis sobre a real segurança para participação em esportes de pacientes portadores de CDI. À medida que essa população aumenta, os médicos são inquiridos sobre quais atividades esportivas são permitidas à esses pacientes. Embora, em teoria, os riscos incluam um aumento na frequência de arritmias com a prática de exercícios, um aumento no limiar de desfibrilação levando à falha da terapia por dispositivo, choques inapropriados secundários à taquicardia sinusal devido à dano ao aparelho e sistemas de eletrodos, Lampert e cols.10 demonstraram que apenas 10% dos médicos recomendavam evitar todas as atividades mais extenuantes do que golfe ou boliche. Nosso atleta, de forma similar, não apresentou nenhuma complicação durante o treinamento, nunca recebeu choques inapropriados, ou causou dano ao aparelho ou sistema de eletrodos.
Esse relato de caso reforça a idéia de que alto desempenho em exercícios e ausência de sintomas não excluem a presença de cardiomiopatia. Além disso, mostra que o acompanhamento de pacientes com CDI é essencial, principalmente aqueles que praticam exercícios físicos regularmente.
Potencial Conflito de Interesses
Declaro não haver conflito de interesses pertinentes.
Fontes de Financiamento
O presente estudo não teve fontes de financiamento externas.
Vinculação Acadêmica
Não há vinculação deste estudo a programas de pós-graduação.
Artigo recebido em 20/03/09; revisado recebido em 24/08/09; aceito em 01/09/09.
- 1. Morris CK, Myers J, Froelicher VF, Kawaguchi T, Ueshima K, Hideg A. Nomogram based on metabolic equivalents and age for assessing aerobic exercise capacity in men. J Am Coll Cardiol. 1993; 22 (1): 175-82.
- 2. Negrão CE, Rondon MUPB, Tinucci T, Alves MJN, Roveda F, Braga AMW, et al. Abnormal neurovascular control during exercise is linked to heart failure severity, Am J Physiol. 2001; 280 (3): H1286-H1292.
- 3. Maron BJ, Mitchell JH. 36th Bethesda Conference: Recommendations for Determining Eligibility for Competition in Athletes with Cardiovascular Abnormalities. J Am Coll Cardiol. 2005; 5 (8): 1322-75.
-
4World Health Organization. The World Health Report 2002. Annexes and Tables. Geneva: World Health Organization, 2002:192.
- 5. Bille K, Figueiras D, Schamasch P, Kappenberger L, Brenner JI, Meijboom FJ, et al. Sudden cardiac death in athletes: The Lausanne Recommendations. Eur J of Cardiovasc Prev Rehabil. 2006, 13 (6): 859-75.
- 6. Duscha BD, Schulze PC, Robbins JL, Forman DE. Implications of chronic heart failure on peripheral vasculature and skeletal muscle before and after exercise training. Heart Fail Rev. 2008; 13 (1): 21-37.
- 7. Roveda F, Middlekauff HR, Rondon MU, Reis SF, Souza M, Nastari L, et al. The effects of exercise training on sympathetic neural activation in advanced heart failure: a randomized controlled trial. J Am Coll Cardiol. 2003; 42 (5): 854-60.
- 8. Haykowsky MJ, Ezckowitz JA, Armstrong PW. Therapeutic exercise for individuals with heart failure: special attention to older women with heart failure. J Card Fail. 2004; 10 (2): 165-73.
- 9. Rusko H, Rahkila P, Karvinen E. Anaerobic threshold, skeletal muscle enzymes and fiber composition in young female cross-country skiers. Acta Physiol Scand. 1980; 108 (3): 263-8.
- 10. Lampert R, Cannom D, Olshansky B. Safety of sports participation in patients with implantable cardioverter defibrillators: a survey of heart rhythm society members. J Cardiovasc Electrophysiol. 2006; 17 (1): 11-5.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
04 Fev 2011 -
Data do Fascículo
Jan 2011
Histórico
-
Aceito
01 Set 2009 -
Revisado
24 Ago 2009 -
Recebido
20 Mar 2009