Resumos
OBJETIVO: A relação temporal entre disfunção ventricular (DV) após infarto do miocárdio (IM) e função mecânica do miocárdio remanescente não está estabelecida. O trabalho analisou, por ecodopplercardiograma (ECO), a função ventricular de ratos com IM de grandes dimensões e a função mecânica de músculos papilares (MP) no término do período de cicatrização. MÉTODOS: Estudados ECO e MP de 9 ratos Wistar (IM), três semanas após IM e 9 controles (C). Determinaram-se: tensão desenvolvida (TD) e sua primeira derivada positiva e negativa, tempo de pico de tensão, tensão de repouso e tempo de relaxamento a 50% de TD em concentrações de cálcio (em mM) de 0,5, 1,0, 1,5, 2,0 e 2,5. Após rianodina, foram promovidas contrações tetânicas em concentrações de cálcio de 1,5, 2,5 e 5,0. RESULTADOS: O ECO caracterizou DV com marcada anormalidade do volume diastólico e da fração de ejeção do VE, além de nítido padrão restritivo do fluxo sangüíneo pela valva mitral. Não foi identificada diferença significante entre os dados de mecânica miocárdica dos ratos IM e C. CONCLUSÃO: A insuficiência cardíaca (IC) que ocorre em ratos com IM > 40% do VE, no final do período de cicatrização, não depende de disfunção miocárdica. As modificações estruturais da câmara e a menor população de miócitos devem fundamentar a DV e a IC.
infarto do miocárdio; músculo papilar; disfunção ventricular; período de cicatrização; ratos
OBJECTIVE: The temporal relation between ventricular dysfunction (VD) after myocardial infarction (MI) and remanent myocardium mechanics is not yet clear. The present work investigated - through Doppler echocardiography (ECHO) - ventricular function in rats with extensive MI, as well as the mechanical function of papillary muscles (PM) at the end of the healing period. METHODS: ECHO and PM of 9 Wistar rats (MI) were studied against 9 controls (C) three weeks after LV myocardial infarction. The following were determined: developed tension (DT) and its first negative and positive derivative, time-to-peak tension (TPT), resting tension (RT), and relaxation time at 50% of DT at 0.5, 1.0, 1.5, 2.0 and 2.5 calcium concentrations (mM). Tetanic contractions were carried out after ryanodine administration at 1.5, 2.5 and 5.0 calcium concentrations. RESULTS: VD was characterized by ECHO, with marked abnormality of diastolic volume and LV and ejection fraction in addition to clear restrictive pattern of blood flow through the mitral valve. No significant difference was found in myocardial mechanics data either for MI or for C rats. CONCLUSION: The heart failure (HF) reported by MI rats with > 40% MI at the end of the healing period is not myocardial function dependent. Chamber structural changes and lower population of myocites should base VD and HF.
myocardial infarction; papillary muscle; ventricular dysfunction; healing period; rats
ARTIGO ORIGINAL
A função mecânica do miocárdio remanescente a um infarto do miocárdio é normal durante o período de cicatrização, embora exista insuficiência cardíaca
Alessandra P. O. N. Peron; Roberto M. Saraiva; Ednei L. Antonio; Paulo José Ferreira Tucci
Universidade Federal de São Paulo - UNIFESP - São Paulo, SP
Correspondência Correspondência Paulo José Ferreira Tucci Rua Estado de Israel, 181/94 04022-000 São Paulo, SP E-mail: ptucci@cardiol.br
RESUMO
OBJETIVO: A relação temporal entre disfunção ventricular (DV) após infarto do miocárdio (IM) e função mecânica do miocárdio remanescente não está estabelecida. O trabalho analisou, por ecodopplercardiograma (ECO), a função ventricular de ratos com IM de grandes dimensões e a função mecânica de músculos papilares (MP) no término do período de cicatrização.
MÉTODOS: Estudados ECO e MP de 9 ratos Wistar (IM), três semanas após IM e 9 controles (C). Determinaram-se: tensão desenvolvida (TD) e sua primeira derivada positiva e negativa, tempo de pico de tensão, tensão de repouso e tempo de relaxamento a 50% de TD em concentrações de cálcio (em mM) de 0,5, 1,0, 1,5, 2,0 e 2,5. Após rianodina, foram promovidas contrações tetânicas em concentrações de cálcio de 1,5, 2,5 e 5,0.
RESULTADOS: O ECO caracterizou DV com marcada anormalidade do volume diastólico e da fração de ejeção do VE, além de nítido padrão restritivo do fluxo sangüíneo pela valva mitral. Não foi identificada diferença significante entre os dados de mecânica miocárdica dos ratos IM e C.
CONCLUSÃO: A insuficiência cardíaca (IC) que ocorre em ratos com IM > 40% do VE, no final do período de cicatrização, não depende de disfunção miocárdica. As modificações estruturais da câmara e a menor população de miócitos devem fundamentar a DV e a IC.
Palavras-chave: infarto do miocárdio, músculo papilar, disfunção ventricular, período de cicatrização, ratos
Não é raro que o encontro de disfunção ventricular após um infarto do miocárdio (IM) desperte o conceito imediato de existir comprometimento da capacidade contrátil intrínseca do miocárdio, a contratilidade miocárdica. Contudo, nem sempre essa interpretação intuitiva é correta. É possível considerar que a capacidade de ejeção ventricular possa sofrer desvios da normalidade, embora o estado inotrópico das miofibrilas possa estar normal.
Se nos valermos das informações da literatura, não vamos encontrar unanimidade sobre as condições da capacidade contrátil do miocárdio remanescente a um IM. Alguns trabalhos1-8 que analisaram a capacidade contrátil miocárdica utilizando preparações em que foi focalizada a função sistólica global do ventrículo esquerdo (corações ejetantes ou isovolumétricos) relataram resultados concordantes, no sentido de que a função contrátil está deprimida. A grande maioria dos relatos resultantes de experiências conduzidas em músculos papilares isolados9-12 conflui para a idéia de depressão da contração do miocárdio. Há, contudo, um trabalho13 em que a função sistólica do músculo papilar foi verificada normal. Quando as avaliações da função contrátil foram desenvolvidas em preparações de miócitos isolados os resultados foram mais desencontrados. Li e cols.14 e Holt e cols.15 referiram que a capacidade de encurtamento de miócitos isolados do miocárdio remoto ao IM estava deprimida. Para Melillo e cols.16, células isoladas de regiões adjacentes ao IM têm capacidade de encurtamento deprimida; contudo, miócitos provenientes de miocárdio distante do IM mantêm a capacidade de encurtamento normal. Anand e cols.17 avaliaram corações isolados isovolumétricos e miócitos isolados do miocárdio remoto ao IM. Verificaram redução da pressão desenvolvida em corações isolados e capacidade de encurtamento normal dos miócitos isolados. Alguns autores18,19 consideram a possibilidade de haver comprometimento da função sistólica da câmara ventricular mesmo quando o estado inotrópico de fibras miocárdicas está normal.
Diferentemente da controvérsia existente acerca das repercussões do IM na função sistólica, os trabalhos que analisaram a função diastólica em corações infartados são concordes em considerar que, nessa situação, a complacência ventricular é restringida, concomitantemente com aumento da rigidez miocárdica5,7,8,20-23.
O tempo decorrido desde a oclusão da coronária, o tamanho do infarto e o tipo de preparação utilizada para estudar o desempenho miocárdico são fatores capazes de modular as repercussões funcionais acarretadas para o miocárdio remanescente a um IM e não foram semelhantes nesses trabalhos. Quando as sobrecargas cardíacas perduram por período prolongado, é regra que a evolução do remodelamento miocárdico termine comprometendo o estado contrátil. Resulta que nas avaliações tardias a um IM o rebaixamento do inotropismo seja habitual. Infartos do miocárdio de pequenas dimensões acarretam pouca repercussão para o miocárdio remanescente e, portanto, em geral, não afetam o inotropismo. Estudos que avaliam a função sistólica das câmaras ventriculares não necessariamente refletem a capacidade contrátil da musculatura subjacente, dado que alterações da geometria ventricular podem desvincular a capacidade de ejeção do estado contrátil das miofibrilas.
Este trabalho foi conduzido para avaliar a capacidade contrátil da musculatura miocárdica no final do período de cicatrização de um IM de grandes dimensões, confrontando os resultados com dados de ejeção ventricular obtidos por ecodopplercardiograma.
MÉTODOS
Dezoito ratos Wistar-EPM, machos, adultos foram acompanhados durante três semanas. Nove deles (356 ± 14 g) foram estudados três semanas após oclusão coronariana para promoção de infarto do miocárdio (IM) e outros nove animais (366 ± 15 g) compuseram o grupo controle (C).
Os animais eram anestesiados pela administração intraperitoneal de cetamina (50 mg/kg) e xilazina (10 mg/kg). Seguindo-se à intubação orotraqueal, o animal era submetido à ventilação mecânica com ventilador Harvard, modelo 683 (freqüência: 90 m/min, volume corrente: 2,0 ml). Após tricotomia, era realizada toracotomia no hemitórax esquerdo, no espaço intercostal do ictus cordis e o coração era rapidamente exteriorizado. O ramo interventricular anterior da artéria coronária esquerda era identificado e ocluído entre as bordas do apêndice auricular esquerdo e o tronco da artéria pulmonar com fio Prolene 6-0. Era promovida hiperinsuflação pulmonar e a parede torácica era fechada por sutura em bolsa previamente realizada.
Promovida a oclusão coronariana, os animais eram mantidos no biotério, por mais três semanas. Na terceira semana era realizado o ecodopplercardiograma (ECO) para confirmação da presença e avaliação do tamanho do infarto.
O ecocardiograma foi realizado com aparelho HP SONOS 5500 (Hewlett Packard, Andover, MA, USA) utilizando transdutor de freqüência fundamental de 12 MHz, com as imagens obtidas com profundidade de 2 cm.
Após anestesia, usando-se o mesmo esquema anterior, os animais eram posicionados em decúbito lateral esquerdo e três eletrodos eram colocados nas patas para obtenção do eletrocardiograma.
As imagens em cortes transversais do ventrículo esquerdo eram gravadas em fitas de vídeo para posterior análise. Foram utilizadas as janelas paraestenal esquerda (corte longitudinal e transversal) e apical (quatro câmaras e duas câmaras). As medidas lineares, realizadas nas imagens obtidas pelo modo-M, conforme Schiller e cols.24, foram: diâmetros do VE ao final da diástole (DDVE) e ao final da sístole (DSVE), e o diâmetro ântero-posterior do átrio esquerdo (AE). A extensão do infarto (%IM), avaliada pela medida do comprimento das regiões acinética e/ou hipocinética (RAH) das paredes ventriculares, foi expressa como porcentagem do perímetro total do contorno endocárdico (PE) em três cortes transversais do VE (nível das bordas das cúspides da valva mitral, dos músculos papilares e da região apical), segundo padronização anterior em nosso laboratório25, utilizando a fórmula:
A função sistólica foi avaliada pela fração de ejeção (FE). Os volumes ventriculares diastólico (Vd) e sistólico (Vs) do VE foram obtidos pelo método de Simpson biplano (apical, quatro e duas câmaras) e a FE foi calculada pela fórmula:
A função diastólica foi analisada utilizando-se os índices derivados da curva de velocidade do fluxo diastólico mitral obtidos pela técnica de Doppler pulsátil. A curva de velocidade do fluxo diastólico foi obtida a partir da imagem apical quatro câmaras, posicionando-se a amostragem de volume próximo à face ventricular da valva mitral. Foram determinadas: onda E, onda A e razão E/A.
Ao final do estudo por ECO, os animais em que o IM assumia tamanho maior do que 40% do VE eram encaminhados para o estudo da função mecânica dos músculos papilares. Com os animais ainda anestesiados, o tórax foi aberto, o coração removido rapidamente e colocado em solução de Krebs-Heinseleit previamente oxigenada com 100% de oxigênio e à temperatura de 28º C. Após retirada da musculatura do ventrículo direito, foi realizado corte no septo interventricular, de modo a expor os dois músculos papilares. O músculo papilar anterior era cuidadosamente dissecado e suas extremidades eram presas por dois anéis de aço inoxidável. Os músculos foram transferidos para câmara de vidro contendo solução de KH (composição em mM: NaCl 130; KCl 5,0; MgCl2 1,2; CaCl2 1,5; glicose 11, insulina 20 U e Hepes 20, como tampão) e eram mantidos na posição vertical. O pH da solução foi ajustado para 7,3 7,4 adicionando-se hidróxido de sódio em concentração de 20%. O anel inferior foi conectado a gancho existente na extremidade inferior da câmara de vidro. O anel superior foi conectado a transdutor de força (Grass, modelo FT 03) por fio de aço inoxidável. O comprimento em repouso do músculo papilar era determinado deslocando-se o transdutor no sentido vertical com auxílio de micromanipulador. Durante 45 minutos os músculos eram mantidos em contrações isotônicas ativadas por estímulos elétricos sob forma de onda quadrada de 5 ms de duração, 9 mV de intensidade e freqüência de 0,2 Hz, emitidos por estimulador DV&M, modelo ESF-10. Os músculos eram colocados em contrações isométricas durante 15 minutos e, a seguir, eram progressivamente estirados para definição do comprimento em repouso que propiciava a contração mais intensa, isto é, o Lmáx. Para tanto, os valores da tensão desenvolvida durante as contrações eram acompanhados durante estiramentos sucessivos de 30 µm até que o valor máximo da tensão desenvolvida fosse atingido.
Definido o estiramento do músculo que propiciava o maior valor da tensão desenvolvida, media-se o seu comprimento com auxílio de paquímetro Mitutoyo e os músculos eram deixados contrair isometricamente durante 15 minutos.
Foram analisados os valores das seguintes variáveis: tensão desenvolvida máxima (TD), tensão de repouso (TR), valor máximo da primeira derivada temporal positiva (+dT/dt) e negativa (-dT/dt) da variação de tensão, tempo para atingir o pico da tensão desenvolvida (TPT) e tempo para a tensão desenvolvida decrescer 50% a partir do seu valor máximo (TR50%).
Transcorrido o período de 15 minutos, durante os quais os músculos eram deixados alcançar estado de equilíbrio funcional, iniciava-se a aplicação propriamente dita do protocolo experimental.
A solução de Krebs-Henseleit contendo 1,5 mM de CaCl2 era trocada por outra contendo 0,5 mM deste sal e aguardava-se até que fosse atingido novo estado de equilíbrio. Obtido o registro das variáveis, a solução nutriente era novamente trocada por KH com 1,5 mM de CaCl2. Avaliações sucessivas das variáveis foram realizadas com soluções de KH com concentrações de CaCl2 de 1,0 mM, 1,5 mM, 2,0 mM, 2,5 mM. Entre as diferentes soluções utilizadas, o músculo foi, sempre, deixado equilibrar em solução de KH com concentração de CaCl2 de 1,5 mM.
Seguindo-se, procediam-se as manobras para produção de contrações tetânicas. A solução padrão de KH com 1,5 mM de CaCl2 era trocada por outra contendo a mesma concentração do sal e acrescida de rianodina na concentração de 1,0 µM. Os músculos eram mantidos durante 45 minutos nessa solução para obtenção do estado de equilíbrio. A freqüência de estímulos era aumentada para 1 Hz e, após nova estabilização, era aumentada para 10 Hz durante 10 segundos, produzindo contração tetânica. Outras contrações tetânicas foram produzidas em soluções de KH contendo 2,5 e 5,0 mM de CaCl2. Entre um tétano e outro, o músculo permaneceu por 5 minutos sob freqüência de contrações de 1 Hz.
Terminadas as manobras de avaliação da mecânica miocárdica, os músculos eram retirados do sistema e pesados em balança Fisher Scientific, modelo OCCU-124. Considerando a densidade muscular igual a 1, a área de secção transversa do músculo era estimada dividindo-se o seu peso pelo seu comprimento em repouso verificado em Lmáx.
Os dados foram organizados como médias ± desvios-padrão e as comparações dos resultados foram realizadas utilizando-se o teste "t" de Student para dados independentes nas comparações C vs IM. A significância dos valores obtidos nas cinco diferentes concentrações de cálcio foi definida por análise de variância (ANOVA) seguida de testes de Student-Newman-Keuls para comparações múltiplas, quando a ANOVA detectou significância. O limite de significância estatística adotado foi p < 0,05.
RESULTADOS
Os pesos corpóreos e das câmaras cardíacas verificados em C e IM são apresentados na figura 1. É interessante a verificação de que, embora não tenha havido diferença (p > 0,05) entre os pesos corpóreos (PC) dos dois grupos no momento em que os animais foram incluídos no protocolo (C: 366 ± 14 g vs IM: 356 ± 37 g; p > 0,05), detectou-se que o peso dos ratos do grupo IM (385 ± 50 g) foi inferior (p < 0,05) ao dos animais controle (433 ± 29 g) ao final do protocolo; isto é, os animais infartados ganharam menos peso do que os controles durante as três semanas que se seguiram à oclusão coronariana. Paralelamente, não se identificaram significâncias estatísticas entre os valores dos pesos do coração (Pc: C: 1.040 ± 373 mg vs IM: 1.093 ± 442 mg), do ventrículo esquerdo (Pve: C: 632 ± 179 mg; IM: 698 ± 208 mg) e do ventrículo direito (Pvd: C: 407 ± 210 mg; IM: 392 ± 263 mg). A inexistência de significância se manteve quando os diversos pesos cardíacos foram considerados em relação aos respectivos pesos corpóreos: Pc/PC: C: 2,42 ± 0,92 mg/g vs IM: 2,94 ± 1,42 mg/g, Pve/PC: C: 1,47 ±0,43 mg/g vs IM: 1,72 ± 0,85 mg/g e Pvd: C: 0,95 ± 0,51 mg/g vs IM: 1,07 ± 0,81 mg/g. Os valores de área de secção dos músculos papilares também não foram estatisticamente diferentes entre os grupos (C: 0,89 ± 0,15 mm2; IM: 0,92 ± 0,18 mm2).
Os infartos identificados nos animais submetidos à oclusão coronariana foram de tamanho expressivo: 50 ± 8% da circunferência do VE eram ocupados pela cicatriz do IM.
Os resultados verificados no ECO, ilustrados na figura 1, deixam patente a destacada anormalidade estrutural e funcional cardíaca nos animais infartados. O aumento do AE (C: 0,38 ± 0,03 cm vs IM: 0,63 ± 0,15 cm), do diâmetro diastólico (C: 0,66 ± 0,07 cm vs 0,95 ± 0,12 cm) e do diâmetro sistólico (C: 0,26 ± 0,08 cm vs IM: 0,80 ± 0,14 cm) do VE associado à FE reduzida (C: 84 ± 7% vs IM: 44 ± 12%) caracterizam o acentuado acometimento do VE. Paralelamente, é perceptível o padrão diastólico restritivo denunciado pelos dados da função atrial: aumento da onda E (C: 66 ± 10 cm/s vs IM: 90 ± 16 cm/s) e da razão E/A (C: 1,92 ± 0,31 vs IM: 5,90 ± 3,90). O menor valor numérico da onda A (C: 35 ±5 cm/s vs IM: 24 ± 17 cm/s) não assumiu nível de significância.
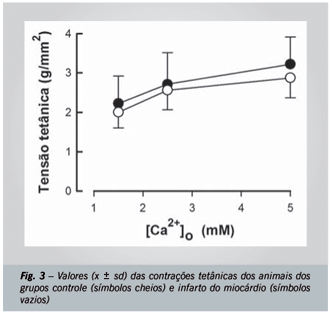
Na tabela 1 e nas figuras 2 e 3 são apresentados os resultados verificados para as funções sistólica e diastólica.
No que diz respeito às variáveis indicadoras da função contrátil (TD e +dT/dt, figuras 2A e 2B), fica patente que a elevação da concentração de cálcio na solução nutriente ([Ca2+]o) seguiu-se de elevação da capacidade contrátil miocárdica em ambos os grupos. Contudo, a significância estatística dos dados não ocorreu em todas as mudanças de [Ca2+]o. Os valores verificados em [Ca2+]o de 0,5 mM foram inferiores aos demais. As outras diferenças não assumiram significância. Quando se comparam os valores de TD e +dT/dt de C e IM, nas diversas [Ca2+]o, fica patente a analogia dos dados, indicando a inexistência de diferenças entre as capacidades contráteis dos dois grupos. A duração da sístole (TPT, figura 2C) não sofreu influência nem da presença de IM nem da [Ca2+]o.
Na tabela 2 são apresentados os resultados relativos à função diastólica, também ilustrados na figura 2.
A tensão de repouso (fig. 2D) não sofreu modificações com o IM e com as diferentes [Ca2+]o. O mesmo comportamento ocorreu com os valores da TR50% (fig. 2E), que não se alteraram. A taxa de decréscimo da tensão (-dT/dt, figura 2F) se acentuou com o aumento da [Ca2+]o; significâncias estatísticas foram identificadas nas comparações entre os dados verificados na [Ca2+]o de 0,5 mM e as demais, tanto em C quanto em IM.
As contrações tetânicas não diferenciaram, também, os dados de C e IM, (fig. 3). Os valores verificados para o tétano foram numericamente mais elevados nas [Ca2+]o mais elevadas; contudo, foi verificada significância apenas na comparação de 1,5 e 5,0 mM nos dois grupos de animais. Não houve significância entre os dados obtidos em C (1,5 mM: 2,22 ± 0,81 g/mm2; 2,5 mM: 2,71 ± 0,91 g/mm2; e 5,0 mM: 3,22 ± 0,84 g/mm2) e em IM (1,5 mM: 2,00 ± 0,42 g/mm2; 2,5 mM: 2,56 ± 0,54 g/mm2; e 5,0 mM: 2,87 ± 0,53 g/mm2).
DISCUSSÃO
Os dados ponderais por nós verificados não identificaram diferenças entre as massas miocárdicas dos animais C e IM, seja ao se considerarem os seus valores absolutos seja quando se consideram os pesos cardíacos relativamente aos pesos corpóreos. Dado que a necrose miocárdica e a subseqüente cicatriz reduzem o peso do ventrículo esquerdo, a inexistência de diferenças entre C e IM induz à conclusão de que os ratos infartados eram portadores de hipertrofia da musculatura do VE capaz de restaurar o peso da câmara. Adicionalmente, a igualdade de pesos do VD sugere que a repercussão hemodinâmica do IM, nesse período, não chegou a acarretar hipertensão pulmonar capaz de induzir hipertrofia expressiva da massa miocárdica do VD. Essa interpretação não exclui, contudo, a existência de congestão pulmonar. A clara redução da FE caracterizou a depressão sistólica ventricular associada a aumentos expressivos do VE e do AE em nossos animais, sugestivos da existência de hipertensão atrial esquerda e conseqüente congestão pulmonar. As nítidas alterações verificadas nos fluxos pela valva mitral, que caracterizaram o padrão restritivo de enchimento ventricular, consolidam a idéia de existir congestão pulmonar em nossos animais infartados. Adicionalmente, dados de nosso laboratório26 indicam que é elevado o teor de água dos pulmões de ratos com essas características ecocardiográficas, fortalecendo a hipótese de que os animais estudados ao final do período de cicatrização do IM se encontravam em insuficiência cardíaca (IC). Esse pressuposto tem respaldo em subsídios da literatura corroborando que ratos portadores de IM de tamanho equivalente ao dos nossos animais têm a IC instalada imediatamente após a oclusão coronária27,28. A interpretação conciliatória dessas informações prevê que os ratos infartados eram portadores de congestão pulmonar, e que o nível da hipertensão no VD e o breve período de evolução foram insuficientes para que o aumento do VD se manifestasse.
Nossos resultados se afiguram inegáveis como indicadores de ausência de comprometimento das funções de contração e de relaxamento do miocárdio remanescentes ao IM nesse período precoce de sobrecarga cardíaca. Os dados dos dois grupos estudados tiveram comportamentos análogos, superponíveis, em todos os indicadores analisados.
Não é grande o número de publicações dedicadas à análise das propriedades mecânicas miocárdicas precocemente, durante o período de cicatrização do infarto.
Stuver e cols.18, estudando músculos papilares de ratos com infarto do miocárdio ocupando 38±1% da musculatura do VE, após três semanas da oclusão coronariana, verificaram que houve aumento da massa do VD, caracterizando a disfunção ventricular esquerda. No estudo dos músculos papilares do VE, não identificaram diferenças na TD, +dT/dt, -dT/dt, TPT e TR50%. Esses resultados denunciam a existência de disfunção ventricular esquerda considerável, concomitante à capacidade contrátil miocárdica normal. Resultados semelhantes foram descritos por Cheung e cols.3, que encontraram disfunção ventricular esquerda expressiva três semanas após promoção de IM em ratos, associada a encurtamento de miócitos isolados normal em níveis fisiológicos de concentração de cálcio.
Os resultados de Li e cols.14 divergem desses anteriores. Estudando as propriedades mecânicas do VE contraindo isovolumetricamente e o transiente de cálcio de miócitos de ratos após 6 horas, dois a três dias, uma semana e um mês após infarto do miocárdio, esses autores verificaram que, em todos os períodos, a +dP/dt e dP/dt do VE infartado foram bem menores, quando comparadas com a de animais controles sem infarto. O mesmo resultado foi verificado para o pico de encurtamento e para a velocidade de encurtamento de miócitos isolados. Os valores da concentração intracelular de cálcio sistólico foram menores, e os valores de cálcio diastólico foram maiores no grupo infartado.
Anand e cols.17 estudaram a hemodinâmica in situ, VE isolado contraindo isovolumetricamente e miócitos isolados de ratos após uma, duas, quatro e seis semanas pós-infarto do miocárdio. Verificaram que os parâmetros de função sistólica estavam deprimidos tanto na hemodinâmica quanto nas análises do ventrículo isolado. Contudo, os dados de função contrátil foram normais nos miócitos isolados submetidos a concentrações crescentes de cálcio extracelular.
Mill e cols.11, estudando músculos papilares de ratos normotensos, espontaneamente hipertensos (SHR) e ratos submetidos a IM trinta dias antes, verificaram que os SHR desenvolveram forças mais elevadas, e os infartados desenvolveram menor força do que os controles, quando submetidos a concentrações crescentes de cálcio.
Esses resultados são concordes em apontar deficiência de contração da câmara ventricular, e discordam nas conclusões sobre a função miocárdica. Relatos de outros autores3,17,18 apontam para a inexistência de disfunção miocárdica nesse período precoce de cicatrização do infarto. Mill e cols.11 e Li e cols.14 referiram resultados que indicam comprometimento contrátil do miocárdio remanescente. Nossos dados não caracterizaram modificações da capacidade contrátil de ratos infartados no período pós-IM por nós analisado.
A disfunção do VE acompanhada de função miocárdica normal é possível de ser compreendida. A capacidade de ejeção ventricular é inversamente relacionada com o nível da pós-carga ventricular e, dadas as implicações da lei de Laplace, cavidades ventriculares dilatadas implicam valores elevados de pós-carga. Essas interações raio da cavidade/capacidade de ejeção caracterizam o diâmetro da cavidade como um componente interno da pós-carga e destacam as grandes cavidades como pouco eficientes na conversão da variável que regula a contração muscular (força) na variável que regula a ejeção ventricular (pressão). Essa circunstância de pós-carga elevada justifica a ejeção ventricular prejudicada conjugada com capacidade contrátil normal do miocárdio remanescente ao IM. Acrescente-se a isso a possibilidade de o menor número de unidades contráteis no VE dos animais infartados poder contribuir para a contração ventricular deficiente.
Em conclusão, nossos resultados indicam que no final do período de cicatrização de infartos do miocárdio de grandes dimensões existe significativo comprometimento da capacidade de ejeção ventricular, embora as propriedades mecânicas intrínsecas do miocárdio possam estar normais.
AGRADECIMENTOS
Este trabalho foi realizado durante vigência de bolsas de estímulo a pesquisa do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq processos 300.692/80-3NV e 131.946/2002-1) e da Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP processo 99/0045-3).
Recebido em 12/07/04
Aceito em 17/03/05
- 1. Schaible F, Scheuer J. Comparison of heart function in male and female rats. Basic Res Cardiol 1984;79:402-12.
- 2. Litwin SE, Litwin CM, Raya TE, Warner AL, Godman S. Contractility and stiffness of noninfarcted myocardium after coronary ligation in rats. Effects of chronic angiotensin converting enzyme inhibition. Circulation 1991;83:1028-37.
- 3. Cheung JY, Musch TI, Misawa H et al. Impaired cardiac function in rats with healed myocardial infarction: cellular vs. myocardial mechanisms. Am J Physiol 1994;266:C29-C36.
- 4. Tian R, Gaudron P, Neubauer S, Ju K, Ertl G. Alteration of performance and oxygen utilization in chronically infracted rat hearts. J Mol Cell Cardiol 1995;28:321-30.
- 5. Raya TE, Gaballa M, Anderson P, Goldman S. Left ventricular function and remodeling after myocardial infarction in aging rats. Am J Physiol 1997;273 (Heart Circ. Physiol 42):H2652-H58.
- 6. Gosselin H, Gi X, Rouleau JL. Correlation between cardiac remodeling, function, and myocardial contractility in rat hearts 5 weeks after myocardial infarction. Can J Physiol Pharmacol 1998;76:53-62.
- 7. Jain M, Liao R, Podesser BK, Ngoy S, Apstein CS, Eberli FR. Influence of gender on the response to hemodynamic overload after myocardial infarction. Am J Physiol Heart Circ Physiol 2002;283:H2544-H50.
- 8. Lapointe N, Blais CJ, Adam A et al. Comparison of the effects of an angiotensin-converting enzyme inhibitor and a vasopeptidase inhibitor after myocardial infarction in the rat. J Am Coll Cardiol 2002;39:1692-98.
- 9. Bing OHL, Fanburg BL. The influence of dietary protein deficiency on the performance of isolated muscle preparations from the rat left ventricle. Am J Med Sci 1985;290:192-5.
- 10. Litwin SE, Morgan JP. Captopril enhances intracellular calcium handling and b-adrenergic responsiveness of myocardium from rats with postinfarction failure. Circulation Research 1992;71:797-807.
- 11. Mill JG, Novaes MAS, Galon M, Nogueira JB, Vassallo DV. Comparison of the contractile performance of the hypertrophied myocardium from spontaneous hypertensive rats and normotensive infarcted rats. Can J Physiol Pharmacol 1998;76:387-94.
- 12. Thai HM, Van HT, Gaballa MA, Goldman S, Raya TE. Effects of AT1 receptor blockade after myocardial infarct on myocardial fibrosis, stiffness and contractility. Am J Physiol 1999;276(Heart Circ. Physiol 45):H873-H80.
- 13. Radvany P, Weinstein KB, Spadaro J, Fisbein M, Bing OHL. Hypertrophy of non-infarcted myocardium following experimental coronary artery occlusion. Abstracts Circulation 1978;57-58(suppl II):224.
- 14. Li P, Park C, Micheletti R et al. Myocite performance during evolution of myocardial infarction in rats: effects of propionyl-L-carnitine. Am J Physiol 1995;268(Heart Circ. Physiol 37):H1702-H13.
- 15. Holt E, Tonessen T, Lunde PK et al. Mechanisms of cardiomyocyte dysfunction in heart failure following myocardial infarction in rats. J Mol Cell Cardiol 1998;30:1581-93.
- 16. Melillo G, Lima JAC, Judd RM, Goldschmidt-Clermont PJ, Silverman H. Intrinsic myocyte dysfunction and tyrosine kinase pathway activation underlie the impaired wall thickening of adjacent regions during postinfarction left ventricular remodeling. Circulation 1996;93:1447-58.
- 17. Anand IS, Liu D, Chugh SS, et al. Isolated myocite contractile function is normal in postinfarct remodeled rat heart with systolic dysfunction. Circulation 1997;96:3974-84.
- 18. Stuver TP, Cove CJ, Hood WBJ. Mechanical abnormalities in the rat ischemic heart failure model which lie downstream to cAMP production. J Moll Cell Cardiol 1994;26:1221-6.
- 19. Chandrashekhar Y, Prahash AJ, Sen S, Gupta S, Anand IS. Cardiomyocytes from hearts with left ventricular dysfunction after ischemia reperfusion do not manifest contractile abnormalities. J Am Coll Cardiol 1999;34:594-602.
- 20. Fletcher PJ, Pfeffer JM, Pfeffer MA, Braunwald E. Left ventricular diastolic pressure-volume relations in rats with healed myocardial infarction Effects on systolic function. Circ Res 1981;49:618-26.
- 21. Pfeffer MA, Pfeffer JM, Steinberg C, Finn P. Survival after an experimental myocardial infarction: beneficil effects of long term therapy with captopril. Circulation 1985;72:406-12.
- 22. Pfeffer JM. Progressive ventricular dilatation in experimental myocardial infarction and its attenuation by angiotensin-converting enzyme inhibition. Am J Cardiol 1991;68:17D-25D.
- 23. Pfeffer JM, Pfeffer MA, Fletcher PJ, Braunwald E. Progressive ventricular remodeling in rat with myocardial infarction. Am J Physiol 1991;260:H1406-H14.
- 24. Schiller NB, Acquatella H, Ports TA et al. Left ventricular volume from paired biplane two-dimensional echocardiography. Circulation 1979;60;3:547-55.
- 25. Moisés VA, Ferreira RL, Nosawa E et al. Structural and functional characteristics of rat hearts with and without myocardial infarct. Initial experience with Doppler echocardiography. Arq Bras Cardiol 2000;75:131-6.
- 26. Saraiva RM, Kanashiro R, Moisés VA, Campos O, Carvalho AC, Tucci PJF. Doppler echocardiography can identify high left ventricular end-diastolic pressure in rats with chronic myocardial infarction. XIV Annual Scientific Sessions of the American Society of Echocardiography, 2003.
- 27. Yue P, Long CS, Austin R, Chang KC, Simpson PC, Massie BM. Post-infarction heart failure in the rat is associated with distinct alterations in cardiac myocyte molecular phenotype. J Mol Cell Cardiol 1998;30:1615-30.
- 28. Francis J, Weiss RM, Wei SG, Johnson AK, Felder RB. Progression of heart failure after myocardial infarction in the rat. Am J Physiol Regulatory Integrative Comp Physiol 2001;281:R1734-R45.
Correspondência
Datas de Publicação
-
Publicação nesta coleção
20 Fev 2006 -
Data do Fascículo
Fev 2006
Histórico
-
Recebido
12 Jul 2004 -
Aceito
17 Mar 2005