Diretrizes para Avaliação e Tratamento de Pacientes com Arritmias Cardíacas
Apresentação
As diretrizes para o diagnóstico e tratamento das arritmias cardíacas surgiram a partir da filosofia da Sociedade Brasileira de Cardiologia (SBC) de manter atualizadas as informações de procedimentos relacionados ao diagnóstico e tratamento de pacientes com cardiopatias.
O Departamento de Arritmias e Eletrofisiologia Clínica (DAEC) decidiu realizar um documento mais amplo que nos consensos realizados anteriormente, revisando criticamente, não apenas as informações das especialidades intervencionistas, como a eletrofisiologia invasiva e a estimulação cardíaca artificial, mas propondo diretrizes para temas anteriormente não abordados, de especial interesse dos cardiologistas clínicos, como as indicações e interpretações dos métodos não invasivos e o tratamento clínico das arritmias cardíacas.
Nestas diretrizes, que contaram com a participação de 50 especialistas considerados os mais destacados nas respectivas áreas, procuramos estabelecer normas técnicas para a realização dos procedimentos intervencionistas, como qualificação e habilitação dos recursos humanos, condições de segurança dos serviços e equipamentos indispensáveis para realização destes procedimentos. Estas informações podem ser úteis às instituições governamentais e organizações privadas que custeiam a sua execução, além de representarem a preocupação prioritária do DAEC com a segurança do paciente.
Seguindo as orientações da diretoria científica da SBC, as indicações clínicas para realização dos procedimentos e testes diagnósticos foram reavaliadas com espírito crítico, baseado em publicações científicas e, quando possível, na análise custo-efetividade.
O resultado deste trabalho será útil a todos os membros da SBC, que sem dúvida receberão um manuscrito realizado com cuidado e rigor científico.
Mauricio Ibrahim Scanavacca
ORGANIZAÇÃO:
Sociedade Brasileira de Cardiologia (SBC)
Presidente: Gilson Soares Feitosa
Diretor Científico: José Carlos Nicolau
COORDENAÇÃO:
Departamento de Arritmias e Eletrofisiologia Clínica (DAEC) da SBC
Presidentes:
Fernando E. S. Cruz (1997-1998)
Mauricio Ibrahim Scanavacca (1999-2000)
Sérgio Rassi (2001-2002)
COLABORAÇÃO:
Sociedade Brasileira de Cirurgia Cardiovascular (SBCCV)
Presidente: Paulo Brofman
Departamento de Estimulação Cardíaca Artificial (DECA) da SBCCV
Presidente: Luiz Antonio Teno Castilho
GRUPOS DE TRABALHO:
I) Avaliação Não Invasiva das Arritmias Cardíacas
Coordenadores: Fábio Sândoli de Brito (SP), Ivan G. Maia (RJ)
II) Avaliação Eletrofisiológica Invasiva das Arritmias Cardíacas
Coordenadores: Júlio Gizzi (SP), Márcio Fagundes (RJ)
III) Tratamento Clínico das Arritmias Cardíacas
Coordenadores: Adalberto Lorga (SP), Anis Rassi Jr (GO)
IV) Ablação por Cateter das Taquiarritmias Cardíacas
Coordenadores: Angelo A. V. de Paola (SP), Jacob Atié (RJ)
V) Estimulação Cardíaca Artificial
Coordenadores: Martino Martinelli Filho (SP), José Carlos Pachón Mateos (SP)
VI) Cardioversor e Desfibrilador Automático Implantável
Coordenadores: Eduardo Sosa (SP), Roberto Costa (SP)
PARTICIPANTES:
Adalberto Lorga (SP)
Adalberto Lorga Filho (SP)
André D'Ávila (SP)
Anis Rassi Jr (GO)
Angelo A. V. de Paola (SP)
Anísio Pedrosa (SP)
Álvaro Barros da Costa (RN)
Ayrton Peres (DF)
César Grupi (SP)
Cláudio Cirenza (SP)
Dalmo Moreira (SP)
Dário Sobral (PE)
Denise Hachul (SP)
Eduardo D'Andréa (RJ)
Eduardo Sosa (SP)
Epotamênides M. Good God (MG)
Fábio Sândoli de Brito (SP)
Fernando Cruz (RJ)
Guilherme Fenelon (SP)
Gustavo Glotz Lima (RS)
Hélio Brito (MG)
Ivan G. Maia (RJ)
Jacob Atié (RJ)
José Carlos Moura Jorge (PR)
José Carlos de Andrade (SP)
José Carlos Pachón Mateos (SP)
José Carlos Ribeiro (RJ)
João Pimenta (SP)
José Tarcísio de Vasconcelos (SP)
Júlio Gizzi (SP)
Leandro Zimerman (RS)
Luiz Antonio Teno Castilho (SP)
Márcio Fagundes (RJ)
Márcio Figueiredo (SP)
Martino Martinelli Filho (SP)
Maurício I. Scanavacca (SP)
Ney Valente (SP)
Paulo Medeiros (SP)
Paulo Brofman (PR)
Reynaldo Castro Miranda (MG)
Roberto Costa (SP)
Ricardo Kunyioshi (ES)
Roberto Sá (RJ)
Sérgio G. Rassi (GO)
Sérgio Siqueira (SP)
Silas Galvão (SP)
Silvana Nishioka (SP)
Tereza Grillo (MG)
Thiago da Rocha Rodrigues (MG)
Washington Maciel (RJ)
COMISSÃO DE REDAÇÃO:
Mauricio Ibrahim Scanavacca, Fábio Sândoli de Brito, Ivan Maia,
Denise Hachul, Júlio Gizzi, Adalberto Lorga, Anis Rassi Jr, Martino Martinelli Filho,
José Carlos Pachón Mateos, André D'Ávila, Eduardo Sosa
COORDENAÇÃO GERAL:
Mauricio Ibrahim Scanavacca
Parte I
Avaliação não Invasiva das Arritmias Cardíacas
Introdução
A decisão da utilização de métodos diagnósticos complementares para investigação de pacientes em medicina baseia-se na capacidade destes métodos em confirmar ou afastar a hipótese diagnóstica levantada durante a observação clínica sistemática. A falta de critérios objetivos na utilização destes métodos pode promover a realização de exames desnecessários, elevando seu custo na investigação. Portanto, o objetivo destas diretrizes é indicar os métodos diagnósticos mais adequados na investigação de pacientes com arritmias cardíacas, considerando a relação custo-efetividade.
Esclarecimento de sintomas provavelmente provocados por arritmias cardíacas
Holter e monitor de eventos
O esclarecimento da origem arrítmica de sintomas tais como palpitações, tonturas, síncopes ou equivalentes, depende do registro do eletrocardiograma (ECG) durante sua ocorrência, conseguido com sistemas de monitoração prolongada do ECG. No momento, estão disponíveis duas técnicas para esse registro. Uma grava continuamente o ECG, conhecida como sistema Holter, monitorização ambulatorial do eletrocardiograma, eletrocardiografia dinâmica, ou monitorização prolongada do eletrocardiograma. A outra, com gravação intermitente é denominada de monitorização de eventos sintomáticos ou Loop Event Recorder.
Sistema Holter
Especificações técnicas - O sistema Holter consiste em um conjunto de equipamentos utilizados para o registro ambulatorial contínuo dos sinais eletrocardiográficos, em geral por 24h (gravadores analógicos ou digitais) e de sua posterior análise (central de análise) 1,2.
As gravações são realizadas utilizando-se três derivações bipolares precordiais, sendo a derivação CM5 a que possui maior sensibilidade para o diagnóstico de alterações do ritmo e detecção de isquemia miocárdica.
A relação fenômeno/tempo é garantida por um dispositivo marcador, acionável pelo paciente durante o exame, que facilita a localização do evento, sintoma ou atividade, no momento da sua análise.
Apesar dos avanços tecnológicos, não existe um sistema de análise verdadeiramente automático, tornando-se necessário que os equipamentos permitam uma completa interação com o analista. Basicamente, todos devem oferecer possibilidade de reprodução das 24h gravadas, na forma de traçados compactos e em escala convencional, além da apresentação dos dados, sob a forma de tabelas, gráficos e histogramas.
Além de fornecer informações sobre o padrão circadiano eletrocardiográfico e quantificação das arritmias 3,4 o sistema Holter pode documentar alterações do ECG no momento da ocorrência de um sintoma, assim como distúrbios do ritmo assintomáticos, que permitem o diagnóstico presuntivo de causa arrítmica. É útil, também, em pacientes pouco colaborativos e naqueles nos quais os sintomas são incapacitantes.
Monitor de eventos sintomáticos
Uma das características dos equipamentos que realizam a gravação intermitente do ECG é a capacidade de transmissão por telefone do sinal eletrocardiográfico. Por serem de pequeno tamanho, baixo consumo de energia, facilmente toleráveis e reinstaláveis, podem permanecer com os pacientes por períodos de semanas a meses, permitindo o registro do ECG durante sintomas cuja ocorrência é esporádica.
Especificações técnicas - O sistema consiste em um pequeno gravador capaz de digitalizar o sinal eletrocardiográfico, gravá-lo e transmiti-lo por telefone a uma central de recepção que armazena e imprime os traçados eletrocardiográficos assim obtidos. Os gravadores mais utilizados apresentam memória circular e podem gravar e transmitir de uma a doze derivações.
O sistema com memória circular deve permanecer conectado ao paciente durante todo o tempo e o ECG permanentemente gravado e desgravado. Ao apresentar um sintoma, o paciente aciona um botão, que retém o ECG correspondente a alguns minutos prévios e posteriores ao evento. A transmissão do registro é realizada por via transtelefônica ou por leitura direta na central de recepção. Desta forma consegue-se uma perfeita correlação entre o sintoma e o traçado eletrocardiográfico4. A duração da gravação que apresenta a melhor relação custo/benefício é a de 15 dias para palpitações e de 30 dias para síncopes, no entanto, poderá ser estendida dependendo da necessidade de esclarecimento do sintoma 5,6,7.
Os monitores implantáveis são pequenos dispositivos introduzidos no subcutâneo da região infraclavicular, que podem manter uma monitorização do ECG por memória circular por até 18 meses. São indicados, para surpreender sintomas de ocorrência pouco freqüente 4,8.
Para sintomas que não provocam comprometimento hemodinâmico importante e persistem por alguns minutos, a utilização de monitores intermitentes, colocados sobre o tórax e ativados após o início do sintoma (pós-evento), podem ser úteis.
Escolha do método para avaliação de sintomas provocados por arritmias cardíacas
A escolha do método de registro dependerá da freqüência de ocorrência dos sintomas - diria, semanal ou esporadicamente. O registro contínuo (Holter) é particularmente útil nos pacientes que apresentam sintomas diários. Naqueles com sintomas esporádicos o uso do gravador de eventos é o mais adequado 9-13.
A história clínica caracterizando o tipo, os fatores desencadeantes, a freqüência, a duração e o comprometimento hemodinâmico, é fundamental na indicação do método e no sucesso da investigação 14-16. Os sintomas relacionados a fatores desencadeantes deverão ser avaliados sob a ação desses estímulos. Quando os sintomas forem severos, colocando em risco a vida do paciente, deverão ser investigados em regime de internação hospitalar.
Recomendações para utilização da monitorização eletrocardiográfica para avaliação de sintomas possivelmente relacionados com distúrbios do ritmo cardíaco
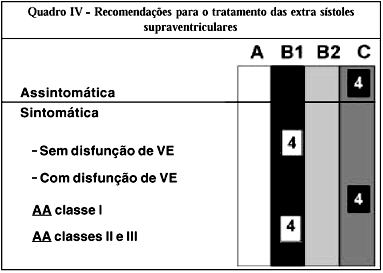
Grau A - Síncope; palpitações; pré-síncope ou tonturas.
Grau B1 - Síncope, pré-síncope, tontura ou palpitações onde provável causa não arrítmica tenha sido identificada, mas com persistência de sintomas, apesar do tratamento desta causa; recuperados de PCR.
Grau B2 - Episódios paroxísticos de dispnéia, dor precordial ou fadiga, são explicadas por outras causas; pacientes com embolia sistêmica quando se suspeita de fibrilação ou flutter atrial.
Grau C - Nenhuma.
Referências
1. Di Marco JP, Philbrick JT. Use of ambulatory electrocardiographic (Holter) monitoring. Ann Intern Med 1990; 113: 53-68.
2. Bigger JT, Rolnitzky LM, Leahey EB, LaPook JD. Duration of recording; activity protocol. In: Wenger NK, Nock MB and Ringquist I. Chicago: Year Book Medical. Publishers Inc., 1981: 87-102.
3. Crawford MH, et al. ACC/AHA Guidelines for Ambulatory Electrocardiography. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines for Ambulatory Electrocardiography. J Am Coll Cardiol 1999; 34: 912-48.
4. Zimetbaum PJ, Josephson ME. The Evolving Role of Ambulatory Arrhythmia Monitoring in General Clinical Practice. Ann Intern Med 1999; 130: 848-56.
5. Reiffel JA, Schulhof E, Joseph B, Severance E, Wyndus P, McNamara A. Optimal duration of transtelephonic ECG monitoring when used for transient symptomatic event detection. J Electrocardiol 1991; 24: 165-8.
6. Zimetbaum PJ, Kim KY, Josephson ME, Goldberger AL, Cohen DJ. Diagnostic yield optimal duration of continuous loop event monitoring for the diagnosis of palpitations. A cost effectiveness analysis. Ann Intern Med 1998; 128: 890- 5.
7. Grupi CJ, Barbosa AS, Sampaio CR, Moffa PJ. The contribution of event monitor recorder to the diagnosis of symptoms. Arq Bras Cardiol 1998; 70: 309-14.
8. Krahn AD, Klein GL, Yee R, Takle-Newhouse T, Noris C. Use of un extended monitoring strategy in patients with problematic syncope. Revel investigators. Circulation 1999; 99: 406-10.
9. Zeldis SM, Levine BJ, Michelson EL. Cardiovascular complaints: Correlation with cardiac arrythmias on 24-hour eletrocardiographic monitoring. Chest 1980; 78: 456-61.
10. Clark PI, Glasser SP, Spoto E Jr. Arrhythmias detected by ambulatory monitoring: Lack of correlation with symptoms of dizziness and syncope. Chest 1980; 77: 722-5.
11. Zimetbaum PJ, Josephson ME. Evaluation of patients with palpitations. N Engl J Med 1998; 388: 1369-73.
12. Kus T, Nadeau R, Costi P, Molin F, Primeau R. Comparison of the diagnostic yield of Holter versus transtelephonic monitoring. Can J Cardiol 1995; 11: 891- 4.
13. Kinlay S, Leitch JW, Neil A, Chapman BL, Hardy DB, Fletcher PJ. Cardiac event recorders yield more diagnoses and are more cost- effective than 48 hour Holter monitoring in patients with palpitations. A controlled clinical trial. Ann Intern Med 1996; 124: 1620.
14. Clair WK, Wilkinson WE, McCarthy EA, et al. Spontaneous occurrence of symptomatic paroxysmal atrial fibrillation and paroxysmal supraventricular tachycardia in untreated patients. Circulation 1993; 87: 1114-22.
15. Page RL, Wilkinson WE, Clair WK, et al. Asymptomatic arrhythmias in patients with symptomatic paroxysmal atrial fibrillation and paroxysmal supraventricular tachycardia. Circulation 1994; 89: 224-7.
16. Wu J, Kessler DK, Chakko S, Kessler KM. A cost-effectiveness strategy for transtelephonic arrhytmia monitoring. Am J Cardiol 1995; 75: 184-5.
Teste ergométrico
As modificações neuro-humorais 1, eletrofisiológicas2 e hemodinâmicas 3 provocadas pelo exercício podem induzir arritmias cardíacas. O significado prognóstico destas arritmias está relacionado a sua apresentação eletrocardiográfica, manifestações clínicas e à gravidade de possível cardiopatia associada 4-6. Por outro lado, a aplicação do teste ergométrico na avaliação de sintomas tem especial interesse quando estes guardam relação com o exercício, acontecendo durante ou imediatamente após a sua prática 7-10.
Recomendações para utilização do TE para avaliação de sintomas possivelmente relacionados com distúrbios do ritmo cardíaco
Grau A - Palpitações referidas durante ou após exercício físico; síncope, pré- síncope ou tontura relacionadas com o esforço; palidez e/ou sudorese fria e/ou dispnéia desproporcional e/ou mal estar, referidos durante ou após exercício físico.
Grau B1 - Nenhuma.
Grau B2 - Recuperados de parada cardiorrespiratória; síncope ou pré-síncope sem relação ao exercício, em portadores de cardiopatias arritmogênicas; síncope ou pré-síncope sem relação com exercício em pacientes com bradicardia sinusal significativa.
Grau C - Síncope ou palpitações em portadores de cardiopatias obstrutivas.
Referências
1. Hauswirth O, Noble D, Tsien RR. Adrenaline: Mechanism of action of the pacemaker potential in cardiac Purkinje fibers. Science 1968; 162: 916-9.
2. Wit AL, Cranfield PF. Triggered activity in cardiac muscle fibers of the simian mitral valve. Circ Res 1976; 38: 85-92.
3. Jelinek MV, Lown B. Exercise testing for exposure of cardiac arrhythmias. Prog Cardiovasc Dis 1974; 16: 497-522.
4. Pontoon JA. Prevalence and nature of cardiac arrhythmias in apparently normal well trained runners. Am Heart J 1982; 104: 762-8.
5. Vitasalo MT, Kalo R, Eisalo A, Haloman PT. Ventricular arrhythmias during exercise testing, jogging and sedentary life. Chest 1979; 76: 21-7.
6. Amsterdam EA. Sudden death during exercise. Cardiology 1990; 77: 411-7.
7. ACC/AHA Guidelines for Exercise Testing. J Am Coll Cardiol 1997; 30: 260-315.
8. Ellestad MH, Wan MK. Predictive implications of stress testing. Follow up of 2700 subjects after maximum treadmill stress testing. Circulation 1975; 5: 363-9.
9. Lauer MS, Okin PM, Larson MG, Evans JC, Levy D. Impaired heart rate response to graded exercise. Prognostic implications of chronotropic incompetence in the Framingham Heart Study. Circulation 1996; 93: 1520-6.
10. Corbelli R, Masterson M, Wilkoff BL. Chronotropic response to exercise in patients with atrial fibrillation. Pacing Clin Electrophysiol 1990; 13:179-87.
Teste de inclinação ortostática
O teste de inclinação ortostática (TI) ou Tilt Table Test é um método provocativo utilizado para avaliação da susceptibilidade à síncope neurocardiogênica ou vaso-vagal 1-3.. O estresse postural induzido pela inclinação passiva do paciente do decúbito dorsal horizontal para posição ortostática reproduz nesses indivíduos hipotensão e bradicardia neuromediadas responsáveis pelos eventos sincopais 4,18.
Especificações técnicas
-
Quanto mais próximo do evento sincopal, maior a probabilidade diagnóstica.
-
Existem protocolos passivos ou com sensibilização farmacológica
12,29,20. No entanto, as informações obtidas a partir do teste passivo prolongado são mais específicas.
-
Deve sempre ser realizado por médico acompanhado de auxiliar de enfermagem capacitado para atendimento de emergência em ambiente hospitalar.
-
O laboratório deve ter equipamento de reanimação cardiorrespiratória, apesar de raras as intercorrências durante o teste
7,10,12,14,19.
-
O ambiente deve ser silencioso, com pouca iluminação e temperatura agradável.
-
Não se recomenda a permanência de familiares no laboratório.
-
A monitorização do eletrocardiograma e pressão arterial deve ser contínua. No caso de monitorização intermitente, recomenda-se que as medidas sejam feitas com a maior freqüência possível, especialmente no caso do aparecimento de sintomas.
-
Manipulações venosas devem ser evitadas, pois aumentam a vulnerabilidade ao reflexo vasovagal.
-
Pode ser realizado no período matutino ou vespertino, no entanto, estudos repetidos com objetivo de avaliação de eficácia terapêutica, devem ser realizados no mesmo período do dia
12,20-22.
-
O paciente deve permanecer em jejum oral por pelo menos 6h e adequadamente hidratado.
-
Recomenda-se inclinação ortostática a 60 ou 70 graus com suporte para os pés e cintos de segurança
12,20.
-
O período de repouso deve ser de pelo menos 20min e a exposição à postura ortostática entre 40 e 45min para o teste passivo
12,19,20. Em crianças, 20min em postura ortostática são suficientes
12,23.
-
Em idosos, a massagem dos seios carotídeos deve ser realizada em postura ortostática, que sensibiliza o método e possibilita o diagnóstico da forma vasodepressora da hipersensibilidade do seio carotídeo
24.
Sensibilização farmacológica - Em não havendo um teste padrão ouro, a sensibilidade do teste de inclinação não pode ser avaliada com precisão. A decisão sobre usar ou não protocolos sensibilizados, deve respeitar a necessidade individual de cada paciente e sua interpretação deve ser criteriosa. Sabe-se que o teste passivo prolongado, cujo valor diagnóstico varia de 30 a 50%, tem o maior índice de positividade para avaliação de síncope inexplicada, quando comparado a qualquer outro teste diagnóstico. O teste basal prolongado sempre deve ser realizado, pois fornece diagnóstico com alta especificidade e as informações obtidas a partir da resposta positiva podem ser úteis para orientar a terapêutica 12,20.
A síncope vasovagal é uma condição clínica vulnerável a todo ser humano. A administração de agente sensibilizante sempre leva à perda da especificidade, perda esta que pode ser maior ou menor, de acordo com a dose do fármaco, tempo de exposição e ângulo de inclinação utilizado. A interpretação do resultado do teste sensibilizado deve ser individualizada, levando-se em consideração a reprodução do sintoma clínico do paciente. Embora vários agentes farmacológicos provocativos tenham sido propostos, os mais aceitos atualmente são o isoproterenol, e os nitratos sublinguais. O isoproterenol tem a desvantagem de requerer punção venosa, que comprovadamente aumenta a susceptibilidade ao reflexo vasovagal. No entanto, quando administrado em doses baixas, com objetivo de aumentar a freqüência basal em 25 a 30%, apresenta boa especificidade, podendo ser complementar ao teste basal prolongado. Normalmente este objetivo é atingido com doses de 1 a 2mcg/min 12,25. O teste com isoproterenol é contra-indicado em pacientes portadores de doença arterial coronariana, estenose aórtica, miocardiopatia hipertrófica, devendo ser realizado com cuidado em portadores de taquiarritmias ventriculares. As complicações relatadas na literatura restringem-se aos testes com isoproterenol: vasoespasmo coronariano, cefaléia, indução de arritmias, intolerância à droga 12,26.
O uso de dinitrato sublingual em dose baixa (1,25mg), com exposição ortostática a 60 ou 70º por 20min, tem boa especificidade com boa acurácia diagnóstica, além da vantagem de evitar punção venosa 27,28. Sua utilização clínica está cada vez mais ampla e aceita pela facilidade de execução e ausência de complicações.
Resultados esperados - O critério de positividade do teste de inclinação ortostática é a reprodução de sintomas clínicos associada a colapso hemodinâmico. Hipotensões assintomáticas e autolimitadas devem ser interpretadas com reserva. Existem vários tipos de resposta observados durante o teste de inclinação e pelo menos duas classificações propostas 2,12,19,20:
I. Resposta vasovagal clássica - 1) vasodepressora: queda da pressão arterial sistólica >30mmHg, sem alterações significativas da freqüência cardíaca; 2) cardioinibitória: pausa sinusal maior que 3s (ou mais raramente bloqueio atrioventricular transitório) associada à queda da pressão arterial. Neste caso o fenômeno bradicárdico precede a hipotensão; 3) mista: queda da pressão arterial sistólica >30mmHg, associada à queda da freqüência cardíaca. A hipotensão geralmente precede a bradicardia, mas pode ser concomitante.
II. Resposta disautonômica - 1) Hipotensão ortostática; 2) queda gradual e progressiva da pressão arterial ao longo da exposição ao decúbito ortostático, algumas vezes acompanhada de discreto aumento da freqüência sinusal.
III. Síndrome postural ortostática taquicardizante (SPOT) - Incremento de mais de 30 batimentos na freqüência cardíaca basal imediatamente ao se assumir a postura ortostática, mantida durante os 40min de exposição, com sintomas de intolerância à postura, acompanhados ou não de hipotensão arterial, porém sem atingir níveis para desencadear hipofluxo cerebral 29-31.
IV. Síncope cerebral - Perda de consciência por vasoconstrição cerebral documentada ao Doppler transcraniano sem alterações hemodinâmicas periféricas 32. O diagnóstico somente é possível quando o TI for realizado simultaneamente ao Doppler transcraniano.
A escola européia classifica a resposta vasovagal clássica, com modificações que se referem à forma cardioinibitória 33: 1) tipo 1- mista; 2) tipo 2- cardioinibitória; tipo 2A (sem assistolia): queda da pressão arterial >30mmHg, associada à queda da freqüência cardíaca para 40bpm ou menos, mantida por mais de 10s. A hipotensão neste caso precede a bradicardia; tipo 2B: assistolia superior a 3s acompanhada de hipotensão arterial. A assistolia precede a hipotensão; 3) tipo 3: vasodepressora pura.
Em testes com nitratos foi descrita a resposta exagerada, caracterizada por queda gradual e progressiva da pressão arterial com taquicardia sinusal progressiva. Assemelha-se à resposta disautonômica, mas pode ser atribuída ao efeito intrínseco do vasodilatador. Da mesma forma, taquicardia sinusal exagerada não deve ser interpretada como SPOT após a infusão de isoproterenol ou nitrato.
Recomendações:
Grau A - Síncope recorrente de origem não esclarecida em paciente sem cardiopatia estrutural, com ou sem história sugestiva de etiologia vasovagal; episódio isolado de síncope inexplicada em paciente sem cardiopatia em pacientes de risco (profissões de risco, atletas, aqueles com traumatismo físico associado à queda, idade avançada, pródromos curtos ou ausentes); síncope recorrente na presença de cardiopatia, desde que afastadas causas relacionadas a esta, ou caso a história seja muito sugestiva de etiologia vasovagal; avaliação de pacientes com bradiarritmias sintomáticas documentadas (pausas sinusais, bloqueios atrioventriculares paroxísticos) durante ECG ambulatorial onde o diagnóstico de mecanismo autonômico afeta o tratamento. Neste caso, a identificação de origem autonômica pode evitar o implante de marcapasso desnecessário; diagnóstico diferencial entre síncope convulsígena e epilepsia.
Grau B1 - Avaliação de pacientes com síncope associada a esforço físico ou exercício, depois de afastadas causas cardíacas; quedas recorrentes, inexplicadas em idosos; pré-síncopes e tonturas recorrentes sem etiologia definida, levando-se em conta as mesmas considerações descritas nos itens das indicações grau A; avaliação de síncope e pré-síncope recorrente em presença de neuropatia periférica ou autonômica; seguimento clínico e avaliação de eficácia terapêutica de pacientes com síncope vasovagal.
Grau B2 - Ataque isquêmico transitório recorrente se a avaliação ultrassonográfica e angiográfica do sistema vértebro-basilar e carotideano, assim como a ecocardiografia transesofágica não esclarecerem a origem do sintoma; síndrome da fadiga crônica; recuperados da Síndrome da Morte Súbita Infantil (SMSI); episódio isolado de síncope sugestiva de vasovagal, em pacientes sem atividade de risco, para liberação de atividades profissionais ou desportivas.
Grau C - Bradiarritmia documentada, onde o mecanismo vasovagal não modifica o planejamento terapêutico; síncope em paciente com cardiopatia obstrutiva (estenose aórtica grave, miocardiopatia hipertrófica com gradiente importante e estenose mitral crítica); síncope em presença de coronariopatia obstrutiva proximal; síncope em presença de doença cerebrovascular obstrutiva.
Referências
1. Kenny RA, Ingram A, Bayless J, Sutton R. Head up tilt: A useful test for investigation of unexplained syncope. Lancet 1986; 1: 1352-5.
2. Grubb B. Neurocardiogenic Syncope. In: Blair Grubb and Brian Olshansky eds. Syncope: Mechanisms and Management. Armonk: Futura Publishing Co. Inc., 1998: 73-106.
3. Neurocardiogenic Syncope. An International Symposium. PACE 1997; 20 (II).
4. Benditt DG, Lurie K, Adler WS, Sakaguchi S, Schultz J. Pathophysiology of vasovagal syncope. In: Blanc, J J; Benditt, D; Sutton, R, eds. Neurally mediated syncope: Pathophysiology, investigation and treatment. 1st ed. Armonk: Futura Publishing Co., 1996: 1-24.
5. Quan KJ, Carlson MD, Thames MD. Mechanisms of heart rate and arterial blood pressure control: Implications for the pathophysiology of neurocardiogenic syncope. PACE 1997; 20: 764-74.
6. Benditt D, Chen MY, Hansen R, Buetikofer J, Lurie K. Characterization of subcutaneous microvascular blood blow during tilt table induced neurally mediated syncope. J Am Coll Cardiol 1995; 25: 70-5.
7. Mansouratti J, Blanc JJ. Tilt test procedure: Angle, duration, positivity criteria. In: Blanc JJ, Benditt D, Sutton R. eds. Neurally mediated syncope. Pathophysiology, investigations and treatment. 1st ed. Armonk: Futura Publishing Co., 1996: 79-83.
8. Sneddon JF, Counihan PJ, Bashir Y, Haywood G, Ward D, Camm J. Impaired immediate vasoconstrictor responses in patients with recurrent neurally mediated syncope. Am J Cardiol 1993; 71: 72-6.
9. Grubb B, Gerard G, Roush K. Cerebral vasoconstriction during head upright tilt-induced vasovagal syncope: A paradoxic and unexpected response. Circulation 1995; 84: 1157-64.
10. Kapoor W, Smith M, Miller N. Upright tilt testing in evaluating syncope: A comprehensive literature review. Am J Med 1994; 97: 78-88.
11. Grubb B, Kosinski D. Tilt table testing: Concepts and limitations. PACE 1997; 20: 781-7.
12. Benditt D, Ferguson D, Grubb B, et al. ACC Expert Consensus Document: Tilt table testing for assessing syncope. J Am Coll Cardiol 1996; 28: 263-75.
13. Kapoor WN. An overview of the evaluations and management of syncope. In: Grubb B, Olshansky B. Eds. Syncope: Mechanisms and Management. 1st ed. Armonk: Futura Publishing Co., 1998: 1-13.
14. Linzer M, Grubb B, Ho Simon, Ramakrishnan L, Bronfield E, Estes M. Cardiovascular causes of loss of consciousness in patients with presumed epilepsy: A cause of the increased sudden death rate in people with epilepsy? Am J Med 1994; 96: 146-54.
15. Hachul D, Scanavacca M, Sosa E. Role of tilt table test negativation in the evaluation of therapeutic efficacy of neurocardiogenic syncope. PACE 1999; 22: 791.
16. Natale A, Sra J, Dhala A, et al. Efficacy of different treatment strategies for neurocardiogenic syncope. PACE 1995; 18: 655-62.
17. Sheldon R. Pacing to prevent vasovagal syncope. Cardiology Clinics 2000; 18: 81-93.
18. Ector H, Reybrocuck T, Heidbuchel H, Gewillig M, Van de Werf F. Tilt Training: A new treatment for recurrent neurocardiogenic syncope and severe orthostatic intolerance. PACE 1998/21 (II): 193-6.
19. Hachul D, Sosa E, Consolim F, et al. Valor diagnóstico do teste de inclinação na avaliação da síncope de origem indeterminada. Resultados preliminares. Arq Bras Cardiol 1994; 62: 7-9.
20. Sutton R, Bloomfield D. Indications, methodology and classification of results of tilt table test. Am J Cardiol 1999; 84: 10-9.
21. Hachul D, Sosa E, Consolim F, et al. Reprodutibilidade do teste de inclinação em pacientes com síncope neurocardiogênica. Arq Bras Cardiol 1994; 62: 297-9.
22. Grubb B, Wolfe D, Tenesy-Armos P, Hahn H, Elliott L. Reproducibility of head upright tilt table test results in patients with syncope. PACE 1992; 15: 1477-81.
23. Wu TC, Hachul D, Scanavacca M, Sosa E. Valor diagnóstico do teste de inclinação em crianças e adolescentes. Arq Bras Cardiol (In press).
24. McIntosh SJ, Lawson J, Kenny RA. Clinical characteristics of vasodepressor, cardioinhibitory and mixed carotid sinus syndrome in the elderly. Am J Med 1993; 100: 418-22.
25. Morillo C, Klein G, Sandri S, Yee R. Diagnostic accuracy of a low dose isoproterenol head up tilt protocol. Am Heart J 1995; 129: 901-6.
26. Wang P. Coronary vasospasm during isoproterenol infusion. Am J Cardiol 1997; 80: 1508-10.
27. Ammirati F, Colivicchi F, Biffi A, Magris B, Pandozi C, Santini M. Head-up tilt testing potentiated with low-dose sublingual isosorbide dinitrate: A simplified time-saving approach for the evaluation of unexplained syncope. Am Heart J 1998; 135: 671-6.
28. Brito Jr HL, Bianchi FN, Toledo RM, et al. Teste de inclinação abreviado potencializado com dinitrato de isossorbida sublingual (1,25mg) versus teste basal prolongado: especificidade preservada? Arq Bras Cardiol 2000; 74(supl I): 20.
29. Hachul D, Ludovice AC, Scanavacca M, Sosa E. Postural orthostatic tachycardia syndrome during tilt-table test: a positive response? J Am Coll Cardiol 1998; 31: 353 (abstract).
30. Morillo CA, Klein GJ, Thakur RK, Li H, Zardini M, Yee R. Mechanism of "inappropriate" sinus tachycardia. Role of sympathovagal balance. Circulation 1994; 90: 873-7.
31. Schondorf R, Low P. Idiopathic postural tachycardia syndrome. In: Low P, ed. Clinical autonomic disorders. 1st ed. Boston: Little, Brown and Co., 1993: 641-52.
32. Grubb B, Samoil D, Kosinski D, et al. Cerebral Syncope: Loss of consciousness associated with cerebral vasoconstriction in the absence of systemic hypotension. PACE 1998; 21(I): 652-8.
33. Sutton R, Petersen M, Brignole M, Raviele A, Menozzi C, Giani P. Proposed classification for tilt induced vasovagal syncope. Eur J Cardiac Pacing Electrophysiol 1992; 2: 180-3.
Estimulação atrial transesofágica
Especificações técnicas
O esôfago relaciona-se anatomicamente com o átrio esquerdo (AE) e a face posterior do ventrículo esquerdo. A menor distância existente entre a parede posterior do AE e o esôfago situa-se na porção média do AE. Neste local, estímulos elétricos com largura de pulso variando entre 5 a 20ms e amplitude de 5 a 30 mA capturam os átrios de modo estável, com relativo conforto para o paciente 1,2,3.
O sistema utilizado para realização de estimulação atrial transesofágica é composto por um estimulador de pulsos elétricos programável e um cateter flexível com dois a quatro eletrodos na extremidade distal. O estimulador deve ser capaz de gerar estímulos e extra-estímulos de baixa a alta freqüência, além de ter circuito de sensibilidade capaz de detectar a atividade elétrica espontânea do coração 4.
A estimulação atrial transesofágica (CETE) é altamente eficaz em induzir e interromper as taquicardias supraventriculares clínicas 4-9. A fibrilação atrial pode ocorrer durante o procedimento. Neste caso, pacientes com pré-excitação ventricular podem apresentar alta resposta ventricular e, raramente, fibrilação ventricular. Por isso, deve ser sempre realizada em ambiente hospitalar com estrutura para ressuscitação cardiorrespiratória.
O registro da atividade elétrica atrial transesofágica durante taquicardia induzida ou espontânea é útil no diagnóstico diferencial das taquiarritmias supraventriculares (TSV). O intervalo do início do eletrograma ventricular (complexo QRS ou R) ao início do eletrograma atrial (P´) intervalo RP - menor ou igual a 60ms sugere tratar-se de taquicardia por reentrada nodal (TRN). A existência de duas ondas atriais para uma ventricular favorece ao diagnóstico de taquicardia atrial (ou flutter atrial). Intervalo RP maior que 70ms sugere a presença de uma via anômala (taquicardia por reentrada atrioventricular TAV) já que TRN com intervalo VA >70ms tem baixa prevalência (2%) 3.
Indicações
1) Diagnóstico de palpitação taquicárdica - A indução de taquicardia reentrante pode variar de 70 a 100% no adulto 5,7,8 e de 60 a 72% na criança 8. O uso de isoproterenol e/ou atropina pode elevar um pouco mais esses índices.
2) Avaliação da terapêutica ablativa 9,10 - Em pacientes com queixas de palpitação taquicárdica após a ablação por radiofreqüência de taquicardia supraventricular, a estimulação atrial transesofágica pode identificar os casos de insucesso.
3) Avaliação da capacidade de condução anterógrada de via anômala manifesta - a indução da fibrilação atrial e análise do menor intervalo RR pré-excitado, o aumento progressivo da freqüência de estimulação atrial e o uso de extra-estímulos atriais até o bloqueio anterógrado da via anômala apresentam resultados superponíveis 5,11.
4) Estudo da vulnerabilidade atrial - A indução de flutter/fibrilação atrial apresenta resultados superponíveis à da estimulação endocárdica com 90% de sensibilidade e especificidade 12.
5) Diagnóstico de bradiarritmias - A análise da função do nódulo sinusal pela estimulação atrial transesofágica, ou invasiva, apresenta baixa sensibilidade diagnóstica 13, 14.
Limitações - A realização da CETE não é possível em 10 a 15% dos casos 15 devido especialmente ao desconforto causado ao paciente ou por falha de captura atrial 16. A náusea e o reflexo do vômito durante a passagem do cateter naso-esofágico são queixas comuns 16. A tosse ocorre devido à estimulação concomitante da carina 14. O desconforto retroesternal ou a sensação de queimação é proporcional a intensidade de corrente. Não se documentou dano esofágico, mesmo sob estimulação de alta intensidade 17-19. Outras complicações menos comuns são: estimulação do nervo frênico 2, estimulação do nervo braquial em crianças 20, estimulação ventricular na porção basal do ventrículo esquerdo 21 com indução de fibrilação ventricular 22.
Recomendações para utilização da cardioestimulação transesofágica para avaliação de sintomas possivelmente relacionados com distúrbios do ritmo cardíaco
Grau A - Nenhuma.
Grau B1 - Palpitação taquicárdica recorrente de caráter paroxístico sem documentação eletrocardiográfica.
Grau B2 - Síncope por suposta disfunção sinusal.
Grau C - Avaliação de síncope com suspeita de taquicardia ventricular; avaliação de síncope por suposto bloqueio atrioventricular de 2º grau.
Referências
1. Gasco FLC, Cabedo JAF. Analisis de la despolarization auricular inducida por estimulacion transesofagica. Rev Española Cardiol 1980; 33: 103.
2. Gallagher JJ, Smith WM. Esophageal Pacing: a Diagnostic and Therapeutic Tool. Circulation 1982; 65: 336.
3. Pachón M, JC. Estudo Eletrofisiológico Transesofágico. SOCESP Cardiologia - Atualização e Reciclagem. Barreto ACP e Sousa AGMR, Editora Atheneu, 1a. edição, 1994: 192-207.
4. Pachón-M JC, Kormann DS, Pachón EI, Pachón MZC, Souza JEMR, Jatene AD. Cardioestimulador Transesofágico. Arq Bras Cardiol 1984; 43 (supl. 1): 19.
5. Pachón-M JC, Pachón-M EI, Kormann DS. Estudo Eletrofisiológico Transesofágico - Contribuição ao Diagnóstico das Taquicardias - Moffa PJ, Sanchez PCR, Ramires JAF, Oliveira AS. Eletrocardiograma: Normal e Patológico - 7.ed. São Paulo: Rocca, 2001- (Série InCor), cap.29: 755-84.
6. Andréa EM. Reversão do Flütter Atrial pela Estimulação Atrial Transesofágica. Análise Adicional de Drogas Antiarritmicas. REBRAMPA 1993;6(2).
7. Harte MT, Teo KK, Horgan JH. The diagnosis and Management of Supraventricular Tachycardia by Transesophageal Cardiac Stimulation and Recording. Chest 1988; 93: 339.
8. Benson Jr DW, Dunnigan A. Transesophageal Electrocardiography and Cardiac Pacing: State of The Art. Clinics in Perinatology 1988; 15: 619.
9. Pachón-M JC. Estudo Eletrofisiológico Transesofágico Contribuição ao Diagnóstico e Tratamento Intervencionista das Taquicardias Supraventriculares através de Ablação por Radiofreqüência. Tese de Doutoramento pela Faculdade de Medicina da Universidade de São Paulo, 1997.
10. Horta JA, Sosa E, Scanavacca M, et al. Palpitações persistentes após ablação por cateter com radiofreqüência. Arq Bras Cardiol 1997; 68: 103-6.
11. Andréa EM. Avaliação de Pré-excitação Ventricular através da Estimulação Atrial Transesofágica. REBRAMPA 1993; 6:35-43.
12. Delise P, D'Este D. Stimulazione Transesofagea e Vulnerabilita Atriale. In: Disertori M, Marconi P (eds.). La Estimulazione Cardíaca Transesofagea. Roma: CIC Ed. Internazionali, 1987: 51.
13. Santini M, Ansalone G. Transesophageal pacing. PACE 1990; 13: 1298.
14. Maciel WA. Cardioestimulação transesofágica. Centro de Ciências Médicas e Biológicas Pontifícia Universidade Católica do Rio de Janeiro. (Dissertação de Mestrado) 1987.
15. Matheus RV, Hsakell RJ, et al. Early Experience with Esophageal Pill Electrode in the Diagnosis of Coronary Artery Disease a trend toward improved specificity compared to treadmill exercise. J Electrocardiol 1987; 20: 157.
16. Christensen J. Origin of sensation in the esophagus. Am J Physiol 1984; 246:21.
17. Nishimura M, Katoh T, Hanai S and Watanabe Y. Optimal mode of transesophageal Atrial Pacing. Am J Cardiol 1986; 57: 791.
18. Ledley RS, Huang HK, Mazziotta JC. Cross-sectional Anatomy. An Atlas for Computerized Tomography. Baltimore: Willims & Wilkins, 1977, p 91.
19. Montoyo JV, Angel J. Valle V, Gausi C. Cardioversion of tachycardias by transesophageal atrial pacing. Am J Cardiol 1973; 32: 85.
20. Benson Jr DW, Dunnigan A. Transesophageal study of infant supraventricular tachycardia: electrophysiologic characteristics. Am J Cardiol 1983; 52: 1002.
21. Benson Jr DW, Sanford M, Dunnigan A, Benditt DG. Transesophageal atrial pacing threshold: Role of interelectrode spacing, pulse width, and cateter insertion depth. Am J Cardiol 1984; 53: 63.
22. Guaragna RF, Barbato G, Brancchetti G. Fibrillazione ventricular indotte dalla stimolazione transesofagea attuatu per il tratamento di un flutter atriale. G Ital Cardiol 1988; 18: 160.
Avaliação não invasiva do risco de taquicardia ventricular sustentada e de morte súbita
Função ventricular
A disfunção ventricular, traduzida habitualmente pela fração de ejeção (FE) do ventrículo esquerdo, é um marcador de risco da morte cardíaca, em especial da morte súbita, independente da presença de arritmias ventriculares 1-11.
Vários mecanismos respondem pela má evolução de pacientes com a função ventricular esquerda comprometida. Alguns são irreversíveis, determinados pelas alterações estruturais e hemodinâmicas da cardiopatia subjacente e outros reversíveis, devido a alterações hidro-eletrolíticas, neuro-humorais e a ação de fármacos.
Os métodos mais difundidos para avaliar a FE são o ecocardiograma (ECO), os que empregam radioisótopos 12, e a ressonância magnética (RM) 13. O ECO é o mais empregado, por ser de fácil e rápida aquisição, não só avaliando o grau de disfunção do VE, como também identificando a sua causa. Pode ser obtido à beira do leito, com um índice de acurácia muito alto, capaz de fazer distinção entre a disfunção diastólica e a sistólica. Os radioisótopos e a RM ainda são pouco utilizados devido às dificuldades para a sua realização e principalmente, ao alto custo. Deve ser ressaltado, no entanto, que a RM não necessita de contraste, fornece a FE com grande acurácia, e determina os volumes intracavitários, déficits contráteis de diferentes paredes e alterações anatômicas. Mesmo assim, os métodos mais sofisticados e mais caros devem ser requisitados apenas em raras ocasiões 13.
Como a avaliação da FE deve fazer parte de um laudo ecocardiográfico mínimo, sendo seu conhecimento, fundamental para tomadas de decisões clínicas terapêuticas e de estratificação, a sessão plenária dos participantes destas Diretrizes sugeriu que todos os indivíduos que por qualquer motivo sejam submetidos à estratificação de risco para a TVS e para MS tenham a sua função ventricular avaliada por meio da FE do VE.
Referências
1. Burggraf GW, Parker JO. Prognosis in coronary artery disease. Angiographic, hemodynamic, and clinical factors. Circulation 1975; 51: 146-56.
2. Massie B, Ports T, Chatterjee K, et al. Long-term vasodilator therapy for heart failure: clinical response and its relation to hemodynamic measurements. Circulation 1981; 63: 269-78.
3. Schulze Jr RA, Rouleau J, Rigo P, Bowers S, Strauss HW, Pitt B. Ventricular arrhythmias in the late hospital phase of acute myocardial infarction. Relation to left ventricular function detected by gated cardiac pool scanning. Circulation 1975; 52: 1006-11.
4. Schulze Jr RA, Strauss HW, Pitt B. Sudden death in the year following myocardial infarction. Relation to ventricular premature contractions in the late hospital phase and left ventricular ejection fraction. Am J Med 1977; 62: 192-6.
5. Bigger JT, Fleiss JL, Kleiger R, Miller JP, Rolnitzky LM. The relationships among ventricular arrhythmias, left ventricular dysfunction, and mortality in the 2 years after myocardial infarction. Circulation 1984; 69: 250-8.
6. De Sutter J, Kazmierczak J, Fonteyne W, Tavernier R, Jordaens LJ. Factors determining long-term outcomes and survival in patients with coronary artery disease and ventricular tachyarrhythmias. PACE 2000; 23 (part II): 1947-52.
7. The Multicenter Postinfarction Research Group. Risk stratification and survival after myocardial infarction. N Engl J Med 1983; 309: 331-5.
8. Caruso AC, Marcus FI, Hahn EA, Hartz VL, Mason JW and ESVEM Investigators. Predictors of arrhythmic death and cardiac arrest in the ESVEM Trial. Circulation 1997; 96: 1888-92.
9. Rassi Jr A, Waktare JEP, Rassi SG, et al. Chagas heart disease: long term prognostic significance of nonsustained ventricular tachycardia and left ventricular dysfunction. PACE 1999; 22 (part II): 862.
10. Rassi Jr A, Rassi SG, Rassi A. Morte súbita na doença de Chagas. Arq Bras Cardiol 2001; 76: 75-85.
11. Teerlink JR, Jalaluddin M, Anderson S, et al, PROMISE Investigators. Ambulatory ventricular arrhythmias in patients with heart failure do not specifically predict an increased risk of sudden death. Circulation 2000; 101: 40-6.
12. Henning H, Schelbert H, Crawford MH, Karliner JS, Ashburn W, O'Rourkke RA. Left ventricular performance assessed by radionuclide angiocardiography and echocardiography in patients with previous myocardial infarction. Circulation 1975: 52: 1069-75.
13. Rashid H, Exner DV, Mirsky I, Cooper HA, Waclawiw MA, Domanski MJ. Comparison of echocardiography and radionuclide angiography as predictor of mortality in patients with left ventricular dysfunction (studies of left ventricular dysfunction). Am J Cardiol 1999; 84: 299-303.
O teste de ergométrico
O teste de ergométrico produz alterações neuro-humorais, eletrofisiológicas e hemodinâmicas que podem estar envolvidas na gênese de arritmias cardíacas. Além disto pode provocar isquemia miocárdica, um dos fatores etiológicos da TVS e da MS, em pacientes com doença isquêmica do coração. Assim, o teste ergométrico se justifica nesta avaliação, como método de baixo custo e fácil realização, acessível praticamente a qualquer centro em que haja um cardiologista.
Durante a realização do teste ergométrico, é fundamental a atenção para o comportamento clínico do paciente, para seu desempenho físico, para a análise eletrocardiográfica e para a resposta cronotrópica e da pressão arterial sistólica ao exercício.
Os parâmetros extraídos do teste ergométrico e que são indicadores de maior risco para eventos como a TVS e a MS são 1: trabalho total, inferior a 6,5 mets; tempo total de exercício inferior a 200s utilizando o protocolo de Bruce; freqüência cardíaca <120bpm no esforço máximo, limitada por sintoma; elevação da pressão arterial sistólica £30mm/Hg ou queda durante o esforço; aparecimento de arritmias ventriculares complexas ou sua exacerbação; depressão isquêmica do segmento ST>2mm; depressão isquêmica do segmento ST em várias derivações; supradesnivelamento do segmento ST em derivação sem onda Q patológica; persistência das alterações isquêmicas por mais de 6min no período de recuperação.
Recomendações para a indicação do teste ergométrico na avaliação do risco para a taquicardia ventricular sustentada e morte súbita.
Grau A - Nenhum
Grau B1 - Recuperados de parada cardiorrespiratória; avaliação de taquiarritmias ventriculares nas síndromes elétricas primárias; pós IM fase precoce, antes da alta hospitalar; pós IM fase precoce após a alta hospitalar, caso o item anterior não tenha se concretizado.
Grau B2 - Pós IM tardio; qualquer cardiopatia estrutural.
Grau C - Cardiopatias obstrutivas.
Referências
1. ACC/AHA Guidelines for Exercise Testing. J Am Coll Cardiol 1997; 30: 260-315.
Monitorização ambulatorial (Holter)
A presença de arritmias ventriculares complexas, detectadas pela eletrocardiografia dinâmica, após a fase aguda do infarto do miocárdio é indicativa de mau prognóstico na evolução a médio prazo 1. Entretanto, embora a especificidade e o valor preditivo negativo de tal achado sejam elevados, a sensibilidade e o valor preditivo positivo permanecem baixos 1. Isso talvez se deva às características próprias das populações envolvidas nos estudos ou, então, significa que as arritmias são apenas marcadoras da gravidade da cardiopatia, não estando envolvidas diretamente na causa de morte 2,3.
O surgimento de arritmias ventriculares malignas depende da interação entre características do substrato arritmogênico (circuito de reentrada), presença dos gatilhos (extra-sístoles ou taquicardia sinusal), presença de isquemia e de fatores moduladores (representados pelas influências das catecolaminas, pH e perfusão teciduais, etc.) 4. O Holter avalia até três componentes desta complexa interação, ou seja, os gatilhos (quantidade ou características das extra-sístoles), a presença ou ausência de isquemia e a modulação autonômica. A presença de ectopias ventriculares durante a monitorização de 24h apresenta baixo valor preditivo positivo para morte súbita1. Entretanto, com a adição das informações obtidas pela análise da variabilidade do intervalo RR, resultado da influência do sistema nervoso autônomo, o valor preditivo da eletrocardiografia dinâmica na estratificação de risco em pacientes com arritmias aumenta 5-8. Sabemos que o estado da função ventricular determina o prognóstico de pacientes no período pós-infarto do miocárdio bem como daqueles com miocardiopatia dilatada (isquêmica ou não isquêmica) e insuficiência cardíaca. Além disso, a presença de arritmias ventriculares complexas associadas à disfunção ventricular (fração de ejeção <40) identifica os pacientes de maior risco. Por esta razão, o conhecimento do estado da função ventricular associado às informações do Holter, elevam o valor preditivo positivo desses exames complementares, mais do que a informação fornecida por qualquer deles isoladamente 1.
Devido à natureza não invasiva da eletrocardiografia dinâmica para avaliar pacientes com arritmias ventriculares complexas e à controvérsia a respeito do valor das informações fornecidas por esta técnica no que diz respeito aos resultados do tratamento baseado nos resultados deste procedimento, o Holter deve ser utilizado nestes pacientes como método de investigação adicional. Deve-se salientar que os resultados devem sempre ser analisados e considerados num contexto mais amplo correlacionando-os com outros métodos de investigação.
Recomendações para utilização do Holter para avaliação não invasiva do risco de TVS e morte súbita
Grau A - Pós-infarto do miocárdio com disfunção ventricular (FE < 40%); miocardiopatias não isquêmicas com disfunção ventricular; insuficiência cardíaca congestiva; síndromes elétricas primárias.
Grau B1 - Cardiomiopatia hipertrófica.
Grau B2 - Avaliação de isquemia residual nas síndromes isquêmicas agudas; pós-infarto do miocárdio; avaliação da carga isquêmica na doença coronariana crônica; pacientes com história de contusão cardíaca; hipertrofia ventricular esquerda; avaliação pré-operatória de arritmias em cirurgia não cardíaca.
Grau C nenhuma.
Referências
1. Crawford MH, et al. ACC/AHA Guidelines for Ambulatory Electrocardiography. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines for Ambulatory Electrocardiography. J Am Coll Cardiol 1999; 34: 912-48.
2. Ceremuzynsky L, Kleczar E, Krzeminska PM, et al. Effect of amiodarone on mortality after myocardial infarction: a double-blind, placebo-controlled, pilot study. J Am Coll Cardiol 1992; 20: 1056-62.
3. Doval HC, Nul DR, Grancelli HO, et al. Randomised trial of low dose amiodarone in severe congestive heart failure. Grupo de Estudio de la Sobrevida en la Insuficiencia Cardiaca en Argentina (GESICA). Lancet 1994; 344: 493-8.
4. Myerburg RJ, Kessler KM. Ventricular fibrillation. In: Kastor JA (ed). Arrhythmias. Philadelphia: WB Saunders, 1994: 395-420.
5. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability: standards of measurements, physiological interpretation and clinical use. Circulation 1996; 93: 1043-65.
6. Bigger JT Jr, Fleiss JL, Steinman RC, et al. Correlation among time and frequency domain measures of heart rate period variability 2 weeks after acute myocardial infarction. Am J Cardiol 1992; 69: 891-8.
7. Kleiger RE, Miller JP, Bigger JT Jr, et al. Decreased heart rate variability and its association with increased mortality after acute myocardial infarction. Am J Cardiol 1987; 59: 256-62.
8. Farrel TG, Bashir Y, Cripps T, et al. Risk stratification for arrhythmic events in post infarction patients based on heart rate variability, ambulatory electrocardiographic variables and the signal-averaged electrocardiogram. J Am Coll Cardiol 1991; 18: 687-97.
Eletrocardiografia de alta resolução
A eletrocardiografia de alta resolução é definida como um método de registro eletrocardiográfico de superfície capaz de detectar potenciais elétricos de baixa amplitude e alta freqüência, oriundos do miocárdio ventricular 1. Tais potenciais não são registráveis pela eletrocardiografia convencional.
O processo de cicatrização, que ocorre como conseqüência de um infarto ou durante a evolução das cardiomiopatias, produz um profundo desarranjo na estrutura miocárdica. A separação e perda de orientação das fibras miocárdicas compromete a condução tecidual, produzindo condução lenta regional expressa pela presença de potenciais de baixa amplitude (uV) e alta freqüência que em função do retardo, ocorrem no final do complexo QRS, chegando a ultrapassá-lo. Esses potenciais são considerados arritmogênicos, constituindo uma condição básica para a ocorrência de reentrada. Em função dos valores desses potenciais (uV), para os seus registros há necessidade do uso de técnicas especiais como a proposta pela eletrocardiografia de alta resolução 1. Os registros poderão ser obtidos em domínio de tempo (ms) ou de freqüência (Hz). Somente os resultados do primeiro (domínio de tempo) encontram-se padronizados, sendo necessário que os pacientes estejam em ritmo sinusal com condução intraventricular normal (ausência de bloqueios de ramo).
Considerações técnicas
Para registro do sinal eletrocardiográfico utilizam-se as derivações ortogonais X, Y e Z, que são registradas, promediadas, filtradas e combinadas em um vetor-magnitude final, gerando um complexo QRS filtrado. Para a definição da anormalidade (usando-se filtragem de 40Hz) são analisados três parâmetros no vetor-magnitude final: 1) duração total do complexo QRS filtrado, devendo ser superior a 140ms. 2) raiz quadrada da média da voltagem dos 40ms terminais do complexo QRS filtrado, devendo ser inferior a 20uV. 3) duração total dos potenciais com valores <40uV no final do complexo QRS filtrado, devendo ser superior a 38ms. A presença de dois ou mais parâmetros anormais define a positividade do teste, ou seja, a presença de potenciais elétricos tardios anormais no final do complexo QRS filtrado.
Indicações
Cardiopatia isquêmica - No paciente pós-infarto do miocárdio o eletrocardiograma de alta resolução é um preditor de risco independente para o desenvolvimento de taquicardia ventricular sustentada. Potenciais tardios anormais têm sido registrados em 39 a 93% dos pacientes que desenvolveram taquicardia ventricular sustentada no pós-infarto do miocárdio. Em todos os estudos prospectivos observa-se que <5% dos pacientes com um teste normal desenvolvem arritmias ventriculares malignas. Assim, o método apresenta um elevado valor preditivo negativo (>95%) quando usado para estratificação de risco nessa população específica 2.
Vinte e cinco a 30% das síncopes que ocorrem em pacientes pós-infarto do miocárdio são devidas à taquicardia ventricular sustentada. A presença de um eletrocardiograma de alta resolução negativo reforça o diagnostico de uma origem não arrítmica para o quadro sincopal 3,4.
O desaparecimento ou a redução dos potenciais elétricos tardios anormais no eletrocardiograma de alta resolução após cirurgia para tratamento de taquicardia ventricular sustentada e no paciente pós-infarto do miocárdio, acompanha-se de uma evolução favorável.
Cardiopatias não isquêmicas - A cardiopatia arritmogênica do ventrículo direito apresenta importante percentual de taquicardia ventricular (TV) sustentada e de morte súbita, ao contrário da TV idiopática, com prognóstico bastante favorável. Oitenta por cento dos pacientes com cardiomiopatia arritmogênica do ventrículo direito e menos de 5% dos idiopáticos apresentam eletrocardiograma de alta resolução anormal 3-4. Assim, a eletrocardiografia de alta resolução é capaz de diferenciar as duas formas, sendo fundamental para o diagnóstico diferencial. Os níveis de evidência para estratificação de risco de taquicardia ventricular sustentada em pacientes com cardiopatias não isquêmicas não são os mesmos da cardiopatia isquêmica e, apesar de ter sido demonstrado o mesmo valor preditivo negativo (>95%), necessita de confirmação com estudos envolvendo um número mais substancial de pacientes.
Recomendações para utilização da eletrocardiografia de alta resolução para avaliação não invasiva do risco de TVS e morte súbita
Grau A - Nenhuma.
Grau B1 - Nenhuma.
Grau B2 - Pós-infarto do miocárdio com síncope de etiologia não esclarecida; diagnóstico diferencial entre a displasia de VD e a forma idiopática de arritmias do VD; taquicardia ventricular sustentada espontânea documentada após IAM e em miocardiopatias de qualquer etiologia; avaliação dos resultados da cirurgia para taquicardia ventricular sustentada; fase de recuperação de infarto agudo do miocárdio (após o sétimo dia de evolução).
Grau C - Nenhuma.
Referências
1. El-Sherif Nl, Turitto G. (Editores). High-Resolution Electrocardiography. Armonk: Futura, 1992.
2. Berbari EJ, Steinberg JS (Editores). A Practical Guide to the Use of the High-Resolution Electrocardiogram. Armonk: Futura, 2000.
3. Breithardt G, Cain ME, El-Sherif N, et al. Standards for analysis of ventricular late potential using high resolution or signal averaged electrocardiography: A statement by a Task Force Committee between the European Society of Cardiology, the American Heart Association and the American College of Cardiology. J Am Coll Cardiol 1991; 17: 999-1006.
4. Cain ME, Anderson JL, Arnsdorf MF, Mason JW, Scheinman MM, Waldo AL. Signal-Averaged Electrocardiography. ACC Expert Consensus Document. J Am Coll Cardiol 1996; 27: 238.
Variabilidade da freqüência cardíaca
O ritmo cardíaco sofre influência do sistema nervoso autônomo, que pode ser avaliada pela variação do ciclo sinusal. A ação vagal aumenta a variabilidade dos ciclos e a ação simpática diminui. Este fenômeno é denominado de variabilidade da freqüência cardíaca e reflete o tono autonômico dominante sobre o sistema cardiovascular em um determinado período 1.
Dois métodos são utilizados para a avaliação da variabilidade: 1) domínio do tempo, que utiliza índices medidos em milissegundos ou o percentual da variação ocorrida entre ciclos normais; 2) domínio da freqüência, que decompõe o sinal em suas freqüências medidas em Hertz. Observa-se uma excelente correlação entre os índices aferidos no domínio do tempo e da freqüência 2.
Existem evidências diretas e indiretas responsabilizando o sistema nervoso autônomo, em especial o simpático, na precipitação da morte cardíaca súbita e da taquicardia ventricular sustentada 3-5. O componente neural para esses eventos é bem evidenciado pela constatação de que a morte súbita obedece a um padrão circadiano, com maior concentração no período da manhã, no despertar, momento em que ocorre um declínio da atividade parassimpática e aumento da simpática. Assim, a aferição do padrão autonômico cardíaco tem importante implicação no prognóstico de possíveis eventos arrítmicos graves.
Índices da variabilidade da freqüência cardíaca (mantidas as siglas originais em língua inglesa)
Domínio do tempo - 1) SDNN: desvio padrão da duração dos ciclos cardíacos normais no período de análise (ms); 2) SDANN: desvio padrão da média da variabilidade dos ciclos cardíacos normais de todos os segmentos de 5min determinados durante o período de gravação (ms); 3) SDNN index: média do desvio padrão da variabilidade dos ciclos cardíacos normais de todos os segmentos de 5min avaliados durante o período de gravação (ms); 4) rMSSD: raiz quadrada da média da soma do quadrado das diferenças da variabilidade de ciclos cardíacos normais sucessivos durante o período de registro (ms); 5) pNN50: percentual de diferença maior do que 50ms na variabilidade dos ciclos cardíacos normais durante o período de gravação (%); 6) VFC index: integral do número total de R-R normais dividido pela distribuição máxima da densidade.
Domínio da freqüência - 1) CEAF: componente espectral de alta freqüência (0,15 a 0,40 Hz) - reflete a atividade parassimpática; 2) CEBF: componente espectral de baixa freqüência (0,04-0,15 Hz) - reflete a atividade simpática modulada pela parassimpática; 3) CEMBF: componente espectral de muito baixa freqüência: (0,0033-0,04 Hz)- FTE: energia total do espectro; 4) relação CEBF/CEAF: reflete o balanço simpático/vagal e a modulação simpática.
O SDNN é utilizado como índice de estratificação de risco no pós-infarto do miocárdio com valores anormais < 50ms. O RMSSD e pNN50 refletem a atividade vagal com valores normais para o primeiro índice de 35,0±8,0ms.
Considerações técnicas
A variabilidade da freqüência cardíaca pode ser determinada com registros de curta (mínimo de 5min) ou longa duração (24h) fazendo parte dos programas de análise da eletrocardiografia dinâmica pelo sistema Holter. É recomendável que a avaliação dos índices da variabilidade da freqüência cardíaca só seja feita em gravações de excelente qualidade, após edição manual rigorosa dos registros com correção e eliminação de ruídos, artefatos e arritmias que por ventura interfiram nos resultados.
Indicações clínicas
Embora a variabilidade da freqüência cardíaca acrescente importantes informações em relação ao perfil autonômico de pacientes cardiopatas e diabéticos, apresenta baixa sensibilidade e baixo valor preditivo positivo para estratificação de risco de morte arrítmica. Assim, deverá ser utilizada em associação com outros métodos, como presença de atividade ectópica ventricular ao Holter, ECG de alta resolução, fração de ejeção. Sabe-se que valores extremamente baixos da variabilidade da freqüência cardíaca relacionam-se com pior prognóstico na doença coronariana e na insuficiência cardíaca congestiva.
Recomendações para utilização da variabilidade da FC para avaliação do risco de TVS e morte súbita
Grau A - Nenhuma.
Grau B1 - Nenhuma.
Grau B2 - Pós-IAM; miocardiopatia hipertrófica; ICC.
Grau C - Arritmias com variação do ciclo cardíaco (FA, ectopias freqüentes, BAV variável, etc.); marcapasso cardíaco artificial.
Referências
1. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability: standards of measurements, physiological interpretation and clinical use. Circulation 1996; 93: 1043-65.
2. Bigger JT Jr, Fleiss JL, Steinman RC, et al. Correlation among time and frequency domain measures of heart rate period variability 2 weeks after acute myocardial infarction. Am J Cardiol 1992; 69: 891-8.
3. Kleiger RE, Miller JP, Bigger JT Jr, et al. Decreased heart rate variability and its association with increased mortality after acute myocardial infarction. Am J Cardiol 1987; 59: 256-2.
4. Farrel TG, Bashir Y, Cripps T, et al. Risk stratification for arrhythmic events in post infarction patients based on heart rate variability, ambulatory electrocardiographic variables and the signal-averaged electrocardiogram. J Am Coll Cardiol 1991; 18: 687-97.
5. La Rovere MT, Bigger JT Jr, Marcus FI, Mortara A, Schwartz PJ, for the ATRAMI (Autonomic Tone and Reflexes After Myocardial Infarction) investigators. Baroreflex sensitivity and heart rate variability in prediction of total cardiac mortality after myocardial infarction. Lancet 1998; 351: 478-84.
Índices da repolarização ventricular
O intervalo QT é determinado no ECG de superfície do início do complexo QRS até o final da onda T. Representa a duração total do processo de ativação e repolarização ventricular, sendo considerado uma expressão da duração total do potencial de ação transmembrana miocárdico. Dados experimentais e clínicos demonstram uma importante associação entre determinados padrões anormais da repolarização ventricular e a ocorrência de morte súbita e/ou arritmias ventriculares graves 1-4. Esses achados justificam a procura ou identificação de índices ou modelos de repolarização ventricular capazes de definir risco arritmogênico. Entre os métodos utilizados, incluem-se: a duração total do intervalo QT, a dinâmica do intervalo QT, a presença de alternância elétrica da onda T e a dispersão do intervalo QT.
Duração do intervalo QT - A duração total do intervalo QT não é atualmente considerada como um preditor de risco independente para qualquer tipo de mortalidade em paciente pós-infarto do miocárdio.
Na síndrome do QT longo congênito, existe uma clara correlação entre a duração do intervalo QT corrigido para a freqüência cardíaca observada (QTc) e o desenvolvimento de arritmias ventriculares graves (torsade de pointes).
Dinâmica do intervalo QT - A análise da dinâmica do intervalo QT fornece importantes informações quanto ao padrão de adaptação desse intervalo à duração dos ciclos cardíacos (ciclo-dependência), sendo ambos (duração dos intervalos QT e dos ciclos) fortemente influenciados pelo sistema nervoso autônomo. Existem padrões distintos de adaptação do intervalo QT ao ciclo cardíaco entre pacientes pós-infarto do miocárdio com e sem arritmias ventriculares sustentadas. No entanto, a metodologia de análise ainda não padronizada e os resultados considerados muito iniciais não recomendam o uso do método para estratificação de risco arritmogênico.
Alternância elétrica da onda T - Flutuações cíclicas na amplitude ou polaridade da onda T provocam um significativo grau de dispersão da repolarização ventricular com recuperação não homogênea, favorecendo a ocorrência de reentrada. Este fenômeno tem sido correlacionado com o desenvolvimento de arritmias ventriculares graves ou fatais. Na quase totalidade dos casos, a alternância elétrica da onda T ocorre em níveis de voltagem não detectável à inspeção ótica do ECG (micro-alternância), sendo necessária à utilização de técnicas espectrais para a sua identificação. A alternância da onda T identificada no ECG de superfície deverá ser valorizada como sinal premonitório de arritmias ventriculares graves. Embora os resultados iniciais tenham se mostrado bastante promissores na estratificação de risco da morte elétrica súbita, o método deve ser considerado ainda em fase de investigação.
Dispersão do intervalo QT - A repolarização ventricular não homogênea pode gerar mecanismos eletrofisiológicos indutores de taquiarritmias ventriculares (dispersão da repolarização ventricular). A medida da diferença entre o intervalo QT mais longo e o mais curto, determinado no ECG de superfície (12 derivações eletrocardiográficas), pode expressar e quantificar o grau de dispersão individual. Sugere-se que medidas superiores a 80ms em avaliação de pelo menos 10 das 12 derivações eletrocardiográficas têm valor prognóstico. Entretanto, estudos retrospectivos e prospectivos, avaliando a dispersão do intervalo QT como preditor de risco, são contraditórios. Dificuldades técnicas inerentes ao próprio método (difícil definição do final da onda T no ECG), assim como a falta de padronização tem limitado sua aplicação clínica, exceto no controle da resposta terapêutica em pacientes com a síndrome do QT longo congênito. A redução do intervalo QT e do seu grau de dispersão expressam uma adequada resposta ao uso dos betabloqueadores e de uma significativa redução de eventos arrítmicos nesta população.
Recomendações para utilização dos índices da repolarização ventricular para avaliação não invasiva do risco de TVS e morte súbita
Duração do intervalo QT
Grau A - Em pacientes em uso de drogas antiarrítmicas; grau B1: síndrome do QT longo congênito; grau C: nenhuma;
Dispersão do QT
Grau A - Nenhuma; grau B1: nenhuma; grau B2: monitorização da resposta terapêutica aos betabloqueadores na síndrome congênita do QT longo; grau C: nenhuma.
Considerações finais - Todos os índices não invasivos utilizados para a estratificação de risco de eventos arrítmicos ventriculares e morte elétrica súbita - fração de ejeção; arritmias ventriculares ao Holter; ECG de alta resolução; variabilidade da freqüência cardíaca e índices extraídos da repolarização ventricular - apresentam baixo valor preditivo positivo (variando em média de 15 a 20%). Assim, para melhor acurácia, associam-se os métodos citados. Utilizando-se esta estratégia, o valor máximo de previsão encontra-se próximo dos 50%.
Referências
1. Extramiana F, Neyroud N, Huikuri HV, et al. QT interval and arrhythmic risk assessment after myocardial infarction. Am J Cardiol 1999; 83: 266-9.
2. Hohnloser SH, Klingenheben T, Zabel M, et al. TWA during exercise and atrial pacing in humans. J Cardiovasc Electrophysiol 1997; 8: 987-93.
3. Zabel M, Kligenheben T, Franz M, et al. Assessment of QT dispersion for prediction of mortality or arrhythmic events after myocarial infarction: results of prospective, long-term follow-up study. Circulation 1998, 97: 2543-50.
4. Priori SG, Napolitano C, Diehl L, et al. Dispersion of QT interval: a marker of therapeutic efficacy in the idiopathic long QT syndrome. Circulation 1994; 89: 1681-9.
Parte II
Avaliação Eletrofisiológica Invasiva de Pacientes com Arritmias Cardíacas
A utilização dos estudos eletrofisiológicos na prática clínica resultou em um grande progresso na abordagem de pacientes com arritmias cardíacas. Nestes últimos 10 anos, houve um grande avanço não só do ponto de vista tecnológico, mas, sobretudo, um maior conhecimento dos mecanismos destas arritmias, propiciando uma abordagem mais efetiva diagnóstica e terapêutica 1.
Desde a última recomendação do DAEC/SBC sobre indicações dos estudos eletrofisiológicos 2, muito se tem aprendido pelos inúmeros ensaios clínicos publicados na literatura, tornando necessária uma revisão atual dessas indicações.
Diretrizes técnicas para o estudoeletrofisiológico
Características do laboratório
1) Recursos hospitalares e equipamentos necessários - O exame deve ser realizado em ambiente hospitalar; equipamento de hemodinâmica ou arco móvel de radiologia; recomendam-se equipamentos que minimizem a exposição à irradiação ionizante; polígrafo de eletrofisiologia com um mínimo de seis canais intracavitários; estimulador cardíaco com capacidade de gerar estímulos elétricos básicos e, no mínimo, três extra-estímulos; marcapasso cardíaco temporário; dois cardioversor-desfibriladores externos; um oxímetro de pulso; uma bomba de infusão; material de ressuscitação cardiopulmonar.
2) Recursos humanos - O médico responsável pelo procedimento deve ter o certificado de habilitação em Eletrofisiologia Clínica Invasiva conferido pelo DAEC; um segundo médico, o 1º auxiliar, com conhecimento em eletrofisiologia cardíaca; um médico anestesista para administrar a sedação; uma enfermeira(o) ou técnica(o) de enfermagem.
3) Características do procedimento - 1)O paciente é internado e admitido no Laboratório de Eletrofisiologia em jejum de seis horas, sendo monitorizado para observação contínua do eletrocardiograma de superfície; 2) Em geral, o exame é feito sob sedação e com supervisão do anestesista; 3) Monitoriza-se a oximetria, de forma não invasiva, durante todo o procedimento; 4) A via de acesso geralmente utilizada é a venosa. Através de punção da veia femoral direita e/ou esquerda, sob anestesia local, são utilizados de dois a quatro introdutores. Eventualmente, é necessária a punção das veias jugular interna ou subclávia; 5) Através dos mesmos, cateteres eletrodos de diagnóstico multipolares são avançados até o coração e posicionados em átrio direito, ao nível do folheto septal da valva tricúspide para registro do potencial de His, seio coronariano e ventrículo direito. Estes cateteres são utilizados tanto para registro dos potenciais intracardíacos, quanto para estimulação elétrica programada. Os potenciais são gravados e/ou impressos nas velocidades de 10 a 300mm/s; 6) As características eletrofisiológicas são analisadas em condições basais, durante o protocolo de estimulação elétrica programada e após provas farmacológicas com medicamentos, tais como: isoproterenol, atropina, procainamida e/ou adenosina; 7) Procede-se, inicialmente, à análise do ritmo cardíaco e da seqüência de ativação das diferentes regiões do coração, incluindo o sistema de condução. Através da estimulação elétrica programada dos átrios e ventrículos é efetuado o estudo da função sinusal e das conduções atrioventricular, intraventricular e ventrículo-atrial. Determina-se a refratariedade atrial, ventricular e de alguns segmentos do sistema de condução; investiga-se a presença de vias acessórias ocultas e manifestas e as suas propriedades eletrofisiológicas, bem como sua localização anatômica. Finalizando, avalia-se a vulnerabilidade atrial e ventricular, classificando e determinando o mecanismo da taquiarritmia induzida; 8) Após o término do exame, os introdutores e os cateteres são retirados. Realiza-se a compressão vascular, seguido do curativo compressivo local, devendo o membro inferior permanecer estendido e em repouso absoluto por 6h; 9) As complicações do estudo eletrofisiológico intracardíaco são raras (0,1 a 0,5%) e acontecem com maior freqüência quando o exame é seguido da ablação por cateter. Pode-se destacar: lesão vascular, embolia pulmonar, hemorragia, perfuração com tamponamento cardíaco, infecção no local da punção, isquemia cerebral e óbito.
Laudo mínimo do estudo eletrofisiológico - Descrição da punção, do posicionamento dos cateteres e do protocolo de estimulação elétrica programada; aferição dos intervalos: PA, AH, HV e a duração do complexo QRS; avaliação das conduções atrioventricular, His-Purkinje e ventrículo-atrial; determinação do ponto de Wenckenbach anterógrado do nó atrioventricular; descrever os elementos eletrofisiológicos empregados no diagnóstico diferencial da(s) taquiarritmia(s) induzida(s); recomenda-se que não conste no laudo indicação de outros procedimentos.
Referências
1. Josephson ME. Clinical Cardiac Eletrophysiology, Techniques and Interpretations. 2nd ed. Pennsylvania: Lea & Febiger, 1993.
2. de Paola AAV. Estudo eletrofisiológico e ablação de arritmias cardíacas utilizando radiofreqüência. Parecer técnico do Departamento de Arritmia e Eletrofisiologia Cardíaca. Arq Bras Cardiol 1995; 64: 585.
3. Tracy CM, Akhtar M, DiMarco JP. Clinical Competence Statement on Invasive Electrophysiology Studies, Catheter Ablation, and Cardioversion, ACC/AHA/ACP/ASIM, Task Force on Clinical Competence. J Am Coll Cardiol 2000; 36: 1725-36.
4. Podrid PJ, Kowed PR. Cardiac arrhythmia mechanisms, diagnosis and management. Williams & Wilkins, 1995.
Diretrizes clínicas do estudo eletrofisiológico
Indicações clínicas
A) Avaliação eletrofisiológica em pacientes com palpitações não esclarecidas
A palpitação é a sensação desagradável de batimentos cardíacos, seja de maneira lenta ou rápida, regular ou irregular 1. A palpitação é uma das queixas que mais levam os pacientes a procurar o auxílio médico. Usualmente benignas, podem ocasionalmente ser manifestação de uma condição com potencial risco de vida.
A avaliação diagnóstica de todos os pacientes com palpitações deve incluir uma detalhada história clínica, um minucioso exame físico e o registro do eletrocardiograma. Na história clínica devemos buscar características de apresentação, bem como a idade do início dos sintomas. A queixa da sensação de soco no peito, ou o coração parar e voltar a bater, geralmente é causada por contrações prematuras atriais ou ventriculares. A sensação de batimentos no pescoço é devida a perda do sincronismo atrioventricular, com refluxo de grau importante para as veias cavas 2. Quando percebida como batidas rápidas e regulares, é mais típica de arritmia supraventricular reentrante, particularmente a taquicardia nodal atrioventricular 3.
Embora o médico raramente tenha a oportunidade de examinar o paciente na vigência do episódio de palpitação, o exame físico é útil em detectar anormalidades cardiovasculares, que podem servir como substrato para a arritmia. Sinais clínicos de cardiomiopatia dilatada e insuficiência cardíaca congestiva levantam a possibilidade de arritmias ventriculares, bem como de fibrilação atrial 4.
A presença de intervalo PR curto e de onda delta no registro eletrocardiográfica confirmam o diagnóstico de pré-excitação ventricular. O achado de ondas "q", características de infarto prévio levanta a possibilidade de taquiarritmia ventricular sustentada ou não-sustentada. A taquicardia ventricular idiopática deve ser lembrada quando extra-sístoles ventriculares freqüentes ocorrem em pacientes com coração estruturalmente normal.
Exames adicionais para o diagnóstico estão indicados nos pacientes em que a abordagem inicial sugere uma causa arrítmica para as palpitações, àqueles que permanecem ansiosos por terem uma explicação específica de seus sintomas e ao grupo com elevado risco para arritmia, ou seja, portadores de uma doença cardíaca estrutural. O estudo eletrofisiológico está indicado quando o diagnóstico não foi esclarecido durante a investigação não invasiva e nas palpitações precedendo um episódio de síncope 5.
Recomendações para o estudo eletrofisiológico
Grau A, N2 - 1) Pacientes com palpitações taquicardias recorrentes, de início e término súbitos, não esclarecidas por avaliação não invasiva; 2) Pacientes com palpitações taquicárdicas, associadas à síncope, não esclarecidas por avaliação não invasiva.
Grau B1 - Nenhuma.
Grau B2, N4 - 1) Pacientes com palpitações taquicárdicas sem documentação eletrocardiográfica.
Grau C, N4 - 1) Pacientes com palpitações taquicárdicas documentadas devido a causas extracardíacas.
Referências
1. Massie E. Signs and symptons. Nome revista ??????? 1975; 16-290.
2. Brugada P, Gursoy S, Brugada J, Andries E. Investigation of palpitations. Lancet 1993; 341:1254-8.
3. Josephson ME, Wellens HJJ. Electrophysiologic evaluation of supraventricular tachycardia. Cardiol Clin 1997; 15: 567-86.
4. Zimetbaum P, Josephson ME. Current Concepts: Evaluation of patients with palpitations. N Engl J Med 1998; 338: 1369-73.
5. Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines. Circulation 1995; 92: 673-91.
B) Avaliação eletrofisiológica em pacientes com síncope inexplicada
A síncope é definida como uma perda súbita e transitória da consciência, acompanhada de perda do tônus postural com recuperação espontânea, que não requer intervenções ressuscitativas 1. Entre os pacientes que já sofreram um episódio de síncope as recidivas são comuns e ocorrem em torno de 30% dos casos 2. As causas possíveis de síncope são numerosas, e seu diagnóstico preciso crucial para a avaliação prognóstica e a necessidade de tratamento preventivo.
Pacientes com síncope de causa cardíaca, estrutural ou arrítmica, têm risco de morte em um ano muito superior aos pacientes com síncope sem doença cardíaca (18 a 33% versus 6%) 3. Nos pacientes sem arritmia cardíaca manifesta com eletrocardiograma e monitorização ambulatorial de 24h normais e sem doença cardíaca estrutural, a síncope neuralmente mediada é causa comum de síncope inexplicada, tendo o estudo eletrofisiológico baixa probabilidade de identificação da causa da síncope (inferior a 10%).
As arritmias cardíacas provavelmente são a causa mais comum de síncope em pacientes com doença cardíaca estrutural e, freqüentemente, são transitórias e de difícil documentação. Exames não invasivos para a avaliação diagnóstica isolada ou em combinação, poderão ser úteis; porém, em pacientes com suspeita de arritmia ventricular, estes não necessariamente precederão à avaliação eletrofisiológica. Pacientes com história de infarto do miocárdio prévio que apresentam síncope inexplicada têm alto risco de apresentar recorrência fatal 4. Nos pacientes pós-infarto do miocárdio que apresentam episódios clínicos documentados de taquicardia ventricular monomórfica sustentada (TVMS), aproximadamente 90 a 95% terão a taquicardia ventricular indutível durante o estudo eletrofisiológico 5.
O estudo eletrofisiológico visa a avaliação da função do nó sinusal, da condução atrioventricular e a indutibilidade de taquiarritmias supraventricular e/ou ventricular. Variáveis preditoras de um teste eletrofisiológico positivo incluem baixa fração de ejeção do ventrículo esquerdo, história de infarto do miocárdio prévio, bloqueio de ramo, taquicardia ventricular não-sustentada e insuficiência cardíaca.
Na grande maioria dos casos, as arritmias induzidas durante o estudo eletrofisiológico são comparadas aos traçados clínicos das arritmias espontâneas, porém, na avaliação de síncope inexplicada nenhum traçado eletrocardiográfico no momento do episódio está disponível. A relação entre os achados laboratoriais e os eventos clínicos será um diagnóstico presuntivo, a menos que o sintoma tenha reprodutibilidade no laboratório. A indução de TV monomórfica sustentada, taquicardia supraventricular e bloqueio no sistema His-Purkinje são de valor diagnóstico e prognóstico em pacientes com síncope inexplicada. Quando negativo, o estudo eletrofisiológico não descarta uma arritmia como causa dos sintomas referidos pelo paciente. Cerca de 35% dos casos com estudo sem diagnóstico continuam a experimentar episódios recorrentes; entretanto, a morte súbita parece ser rara, nessa situação 5. Quando se registra o ECG na vigência da síncope recorrente, após avaliação autonômica e eletrofisiológica negativas, as bradiarritmias são as anormalidades mais comumente identificadas 6.
Recomendações para o estudo eletrofisiológico
Grau A, N2 - 1) Pacientes com cardiopatia estrutural e síncope que permanece inexplicada após investigação não-invasiva.
Grau B1, N3 - 1) Pacientes sem cardiopatia estrutural, com síncope recorrente, após investigação não invasiva.
Grau B2, N4 - 1) Pacientes sem cardiopatia estrutural, 1º episódio de síncope com lesão corporal, nos quais a avaliação não invasiva foi inconclusiva.
Grau C, N4 - 1) Pacientes com síncope de causa determinada nos quais o estudo eletrofisiológico não contribuirá para o tratamento.
Referências
1. Kapoor WN. Syncope in older persons. J Am Geriatr Soc 1994; 42: 426.
2. Savage DD, Corwin L, McGee DL, et al. Epidemiologic features of isolated syncope: The Framingham study. Stroke 1985; 16: 626-9.
3. Kapoor WN, Karpf M, Wieand S, et al. A prospective evaluation and follow-up of patients with syncope. N Engl J Med 1983; 309: 197-204.
4. Coupples LA, Gagnon DR, Kannel WB. Long and short-term risk to sudden coronary death. Circulation 1992; 85: 11-8.
5. Di Marco JP. Value and limitations of electrophysiological testing for syncope. Card Clinics 1997; 15: 219.
6. Krahn AD, Klein GJ, Yee R. Unexplained syncope. Card Clinics 1997; 15: 313.
C) Avaliação eletrofisiológica para estratificação de risco de morte súbita
O reconhecimento clínico de uma morte arrítmica nem sempre é fácil. No entanto, há um consenso geral de que uma morte testemunhada, ocorrida instantaneamente, constitui o quadro clínico mais provável de uma arritmia cardíaca levando à morte súbita 1. Em uma série de 157 pacientes que tiveram morte súbita durante a monitorização ambulatorial, a taquicardia ventricular deflagrando fibrilação ventricular ocorreu em 62%, a fibrilação ventricular primária em 8%, torsades de pointes em 13% e bradiarritmias em 17% dos pacientes 2.
A fisiopatologia da morte cardíaca súbita pode ser vista como uma interação entre um substrato anatômico anormal, como cicatriz de infarto prévio, hipertrofia ventricular esquerda, cardiomiopatia, presença de via anômala; ou relacionados a alterações ultraestruturais nos canais iônicos das membranas celulares, freqüentemente de causa genética; e, a distúrbios funcionais transitórios, como isquemia, extra-sístoles, efeito indesejável de medicamentos e desequilíbrio eletrolítico e autonômico que deflagram a arritmia terminal 3. Estima-se que na presença de doença cardíaca estrutural, a morte cardíaca súbita seja decorrente de doença arterial coronariana em 80% dos casos, de cardiomiopatias (dilatada, hipertrófica) em 10 a 15% e em valvopatias em 5% 4-8.
A abordagem terapêutica mais agressiva da doença arterial coronariana (DAC) resultou em redução da mortalidade cardiovascular; porém, pacientes com DAC, disfunção ventricular esquerda e arritmias ventriculares assintomáticas permanecem com elevado risco para morte súbita ou não-súbita 8-10.
O estudo eletrofisiológico é útil para estratificar o risco de morte súbita em pacientes com cardiopatia estrutural. Pacientes com infarto do miocárdio prévio, disfunção ventricular esquerda (FEVE £35%) e taquicardia ventricular não-sustentada assintomática, nos quais taquiarritmias ventriculares sustentadas não são indutíveis durante a estimulação elétrica programada têm, significativamente, menor risco de morte súbita ou parada cardíaca do que pacientes similares com taquiarritmias sustentadas indutíveis 9. Nesses pacientes, a indução de TVS pela estimulação elétrica programada é um preditor independente de risco para a MS. Em contraste, portadores de cardiomiopatia dilatada idiopática, nos quais a mortalidade tem sido relacionada com o nível de disfunção ventricular esquerda e desempenho hemodinâmico, a estimulação elétrica programada não é adequada para avaliar a instabilidade elétrica ventricular 10-12.
O estudo eletrofisiológico é de valor discutível na avaliação de pacientes com arritmias ventriculares sem cardiopatia estrutural, pois os achados são inespecíficos. Entretanto, indivíduos com padrão eletrocardiográfico sugestivo de síndrome de Brugada apresentam alto risco de ocorrência de arritmias ventriculares polimórficas quando o estudo eletrofisiológico induz essas taquicardias sob protocolo específico 13.
Recomendações para o estudo eletrofisiológico
Grau A, N2 - 1) pacientes com IAM prévio (duas semanas a seis meses) portador de TVNS e FEVE £35%.
Grau B1 - nenhuma.
Grau B2, N4 - 1) Pacientes com síndrome de Brugada, assintomáticos e sem história familiar maligna (síncope, morte súbita); 2) pacientes com cardiopatia estrutural e TVNS associadas a fatores de risco específicos à doença de base.
Grau C, N4 - 1) Pacientes com expectativa de vida reduzida por doenças concomitantes.
Referências
1. Roberts WC. Sudden cardiac death: definitions and causes. Am J Cardiol 1986; 57: 1410-13.
2. De Luna AB, Coumel P, Leclerq JF. Ambulatory sudden cardiac death: Mechanisms of production of fatal arrhythmia on the basis of data from 157 cases. Am Heart J 1989; 117: 151-9.
3. Chugh SS, Kelly KL, Titus JL. Sudden cardiac death with apparently normal heart. Circulation 2000; 102: 649-54.
4. Takagi E, Yamakado T, Nakano T. Prognosis of completely asymptomatic adult patients with Hypertrophic Cardiomyopathy. J Am Coll Cardiol 1999; 33: 206-11.
5. Spirito P, Bellone P, Harris KM, Bernabo P, Bruzzi P, Maron BJ. Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. N Engl J Med 2000; 342: 1778-85.
6. Maron BJ, Shen WK, Link MS, et al. Efficacy of implantable cardioverter-defibrillators for the prevention of sudden death in patients with hypertrophic cardiomyopathy. N Engl J Med 2000; 342: 365-73.
7. Tavazzi L, Volpi A. Remarks about post infarction prognosis in light of the experience with the Gruppo Italiano per lo Studio della Sopravvivenza nell' Infarto Miocardico (GISSI) trials. Circulation 1997; 95: 1341-5.
8. Buxton AE, Lee KL, DiCarlo L, et al. For the Multicenter Unsustained Tachycardia Trial Investigators. Electrophysiologic testing to identify patients with coronary artery disease who are at risk for sudden death. N Engl J Med 2000; 342: 1937-45.
9. Brugada P, Wellens F, Andries E. A prophylactic implantable cardioverter-defibrillator. Am J Cardiol 1996; 78: 128-33.
10. Meinertz T, Treese N, Ksaper W, Geibel A. Determinants of prognosis in idiopathic dilated cardiomyopathy as determined by programmed electrical stimulation. Am J Cardiol 1985; 56: 337-41.
11. Veltri E, Platia EV, Griffith LSC, Reid PR. Programmed electrical stimulation and long-term follow-up in asymptomatic, nonsustained ventricular tachycardia. Am J Cardiol 1985; 56: 309-14.
12. Sulpizi AM, Friehling TD, Kowey PR. Value of electrophysiologic testing in patients with nonsustained ventricular tachycardia. Am J Cardiol 1987; 59: 841-5.
13. Naccarelli GV, Antzelevitch C. The Brugada syndrome: Clinical, genetic, cellular, and molecular abnormalities. Am J Med 2001; 110: 573-81.
D) Avaliação eletrofisiológica em pacientes recuperados de parada cardíaca
A indicação de estudo eletrofisiológico invasivo em sobreviventes de parada cardíaca é uma prática rotineira e classicamente recomendada pelas associações médicas 1,2. Contudo, após o advento dos cardioversores desfibriladores implantáveis (CDIs) 3-5 tornou-se importante reavaliar o papel do estudo eletrofisiológico invasivo como método propedêutico e auxiliar terapêutico nas vítimas de parada cardíaca recuperada 6-10.
O fundamento para utilização do estudo eletrofisiológico invasivo nos sobreviventes de parada cardíaca é estabelecer o mecanismo causador do evento e, conseqüentemente, orientar o tratamento individualizado mais adequado. Condições com significado clínico e terapêutico distintos podem ser identificadas nessa investigação: bradiarritmias 11-15: o estudo eletrofisiológico invasivo pode identificar a presença de distúrbio grave da condução atrioventricular, cujo tratamento envolveria simplesmente o implante de um marcapasso definitivo; taquicardias supraventriculares 16-18: síndrome de pré-excitação ou outra forma de taquicardia supraventricular, que em condições especiais deflagram fibrilação ventricular, podem ser diagnosticadas. A ablação por cateter permitiria uma terapêutica definitiva; taquicardias ventriculares monomórficas ou polimórficas, ou mesmo a fibrilação ventricular podem ser induzidas e indiretamente implicadas na gênese do evento clínico (parada cardíaca). Tal achado abriria um leque de possibilidades terapêuticas, como o tratamento farmacológico, a ablação por cateter ou cirúrgica e o implante de CDI 19-30.
A despeito dessas considerações é importante frisar que a morte súbita é uma síndrome complexa, cujos mecanismos são pouco compreendidos. As informações, fornecidas pelo estudo eletrofisiológico invasivo, permitem no máximo um diagnóstico presuntivo, que não necessariamente corresponde à causa do evento.
Recomendações para o estudo eletrofisiológico
Grau A, N2 - PCR recuperada, não documentada, não relacionada à fase aguda de infarto do miocárdio (>48h), sem causas determinadas e não associada a fatores reversíveis, a despeito da presença ou não de cardiopatia estrutural.
Grau B1, N3 - PCR documentada, com registro eletrocardiográfico do evento, não relacionada à fase aguda de infarto do miocárdio ( > 48hs) e não associada a fatores reversíveis, na presença de doença cardíaca cuja história natural envolva risco de morte súbita.
Grau B2 - Nenhuma.
Grau C, N3 - PCR relacionada à fase aguda de infarto do miocárdio (< 48hs), e/ou associada a fatores reversíveis.
Referências
1. Zipes DP, DiMarco JP, Gillette PC, et al. ACC/AHA Task Force Report. Guidelines for Clinical Intracardiac Electrophysiological and Catheter Ablation Procedures. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Clinical Intracardiac Electrophysiologic and Catheter Ablation Procedures). Developed in collaboration with the North American Society of Pacing and Electrophysiology. Published simultaneously in: J Cardiovasc Electrophysiol 1995; 6: 652-79. Circulation 1995; 92: 673-91. J Am Coll Cardiol 1995; 26: 555-73.
2. Sosa EA, Paola A, Gizzi JC, et al. Indicações para estudos eletrofisiológicos e ablação por cateter de arritmias cardíacas. Recomendações do DAEC da SBC. Arq Bras Cardiol 1995; 64: 149-51.
3. Böcker D, Block M, Borggrefe M, Breithardt G. Are electrophysiological studies needed before implantable cardioverter defibrillator surgery? Eur Heart J 1997; 18: 548-51.
4. Poole JE, Bardy GH. Sudden Cardiac Death. In: Zipes DP, Jalife J, eds. Cardiac Electrophysiology: From Cell to Bedside. Philadelphia: WB Saunders Co., 1995: 812-32.
5. Hallstrom AP, Eisenberg MS, Berner L. The persistence of ventricular fibrillation and its implication for evaluating EMS. Emerg Health Serv Q 1983; 1: 41-7.
6. Manolio TA, Furberg CD. Epidemiology of sudden cardiac death. In: Akhtar M, Myerburg RJ, Ruskin JN, eds. Sudden Cardiac Death. Prevalence, Mechanisms, and Approaches to Diagnosis and Management. Philadelphia: Williams & Wilkins, 1994: 3-20.
7. Wever EFD, Hauer RNW, van Capelle FJL, et al. Randomized study of implantable defibrillator as first-choice therapy versus conventional strategy in post infarct sudden death survivors. Circulation 1995; 91: 2195-203.
8. The antiarrhythmics versus implantable defibrillators (AVID) investigators. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med 1997; 337: 1576-83.
9. Connolly SJ, Gent M, Roberts RS, et al. Canadian implantable cardioverter defibrillator study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation 2000; 1297-302.
10. Kuck KH, Cappato R, Siebels J, Ruppel R. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation 2000; 102: 748-54.
11. Bayes de Luna A, Coumel P, Leclercq JF. Ambulatory sudden cardiac death: mechanisms of production of fatal arrhythmia on the basis of data from 157 cases. Am Heart J 1989; 117: 151-9.
12. Panidis IP, Morganroth J. Sudden death in hospitalized patients: cardiac rhythm disturbances detected by ambulatory electrocardiographic monitoring. J Am Coll Cardiol 1983; 2: 798-805.
13. Myerburg RJ, Estes D, Zaman L, et al. Outcome of resuscitation from bradyarrhythmic or asystolic prehospital cardiac arrest. J Am Coll Cardiol 1984; 4: 1118-22.
14. Luu M, Stevenson WG, Stevenson LW, et al. Diverse mechanisms of unexpected cardiac arrest in advanced heart failure. Circulation 1989; 80: 1675-80.
15. Remole S, Hansen R, Benditt DG. Mechanisms of bradyarrhythmic sudden death. In: Akhtar M, Myerburg RJ, Ruskin JN, eds. Sudden Cardiac Death: Prevalence, Mechanisms, and Approaches to Diagnosis and Management. Philadelphia: Williams & Wilkins, 1994: 407-15.
16. Klein GJ, Bashore TM, Sellers TD, et al. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. N Engl J Med 1979; 301: 1080.
17. Hays LJ, Lerman BB, DiMarco JP. Nonventricular arrhythmias as precursors of ventricular fibrillation in patients with out-of-hospital cardiac arrest. Am Heart J 1989; 118: 53-7.
18. Wang YS, Scheinman MM, Chien WW, et al. Patients with supraventricular tachycardia presenting with aborted sudden death: incidence, mechanisms, and long-term follow-up. J Am Coll Cardiol 1991; 18: 1711-9.
19. Weaver WD, Hill D, Fahrenbruch CD, et al. Use of automatic external defibrillator in the management of out-of-hospital cardiac arrest. N Engl J Med 1988; 319: 661-6.
20. Cobb LA, Weaver WD, Fahrenbruch CE, et al. Community-based interventions for sudden cardiac death: impact, limitations, and changes. Circulation 1992; 85: I-98 I-102.
21. Roy D, Waxman HL, Kienzle MG, et al. Clinical characteristics and long-term follow-up in 119 survivors of cardiac arrest: relation to inducibility at electrophysiologic testing. Am J Cardiol 1983; 52: 969-74.
22. Skale BT, Miles WM, Heger JJ, et al. Survivors of cardiac arrest: prevention of recurrence by drug therapy as predicted by electrophysiologic testing or electrocardiographic monitoring. Am J Cardiol 1986; 57: 113-9.
23. Eldar M, Sauve MJ, Scheinman MM. Electrophysiologic testing and follow-up of patients with aborted sudden death. J Am Coll Cardiol 1987; 10: 291-8.
24. Wilber DJ, Garan H, Finkelstein D, et al. Out-of-hospital cardiac arrest: use of electrophysiologic testing in the prediction of long-term outcome. N Engl J Med 1988; 318: 19-24.
25. Freedman RA, Swerdlow CD, Soderholm-Difatte V, et al. Prognostic significance of arrhythmia inducibility or noninducibility at initial electrophysiologic study in survivors of cardiac arrest. Am J Cardiol 1988; 61: 578-82.
26. Adhar GC, Larson LW, Bardy GH, et al. Sustained ventricular arrhythmias: differences between survivors of cardiac arrest and patients with recurrent sustained ventricular tachycardia. J Am Coll Cardiol 1988; 12: 159-65.
27. Furukawa T, Rozanski JJ, Nogami A, et al. Time-dependent risk of and predictors for cardiac arrest recurrence in survivors of out-of-hospital cardiac arrest with chronic coronary artery disease. Circulation 1989; 80: 599-608.
28. Poole JE, Mathisen TL, Kudenchuk PJ, et al. Long-term outcome in patients who survive out-of-hospital ventricular fibrillation and undergo electrophysiologic studies: evaluation by electrophysiologic subgroups. J Am Coll Cardiol 1990; 16: 657-65.
29. Natale A, Sra J, Axtell K, et al. Ventricular fibrillation and polymorphic ventricular tachycardia with critical coronary stenosis: does bypass surgery suffice? J Cardiovasc Electrophysiol 1994; 5: 988-94.
30. Marchlinski FE, Gottlieb CD, Callans DJ, et al. Ablative therapy for ventricular tachycardia in chronic coronary artery disease. In: Dunbar SB, Ellenbogen K, Epstein AE, eds. Sudden Cardiac Death. Past, Present, and Future. New York: Futura, 1997: 199-224.
Indicações por arritmias documentadas
A) Avaliação eletrofisiológica em pacientes com bradiarritmias
Bradiarritmia sinusal - Sua etiologia está relacionada a causas intrínsecas como doença degenerativa do sistema de condução, colagenoses, doença de Chagas e causas extrínsecas relacionadas, principalmente, ao uso de medicamentos ou mediadas pelo sistema nervoso autônomo (síncope neurocardiogênica, distúrbios situacionais) 1-4. Em geral, a documentação da relação dos sintomas com a bradicardia pela monitorização eletrocardiográfica define a conduta na maioria dos casos, não sendo necessário o estudo eletrofisiológico (EEF). Entretanto, quando este relacionamento não é obtido durante a avaliação não invasiva e há suspeita de outros mecanismos responsáveis pelos sintomas principalmente em pacientes com cardiopatia, o estudo eletrofisiológico está indicado.
Recomendações para o estudo eletrofisiológico 1,5,6
Grau A - Nenhuma.
Grau B1 - Nenhuma.
Grau B2 - 1) Pacientes sintomáticos com suspeita de disfunção do nódulo sinusal, após investigação não invasiva inconclusiva (N4); 2) pacientes com bradicardia sinusal, sem documentação dos eventos durante avaliação não invasiva e suspeita de taquiarritmias como causa dos sintomas.
Grau C - 1) pacientes assintomáticos com suspeita de disfunção do nódulo sinusal. (N2).
Referências
1. Mangrum JM, Dimarco JP. The evaluation and management of bradicardia. N Engl J Med 2000; 342:703-9.
2. Gregoratos G, Cheitlin MD, Conill A, et al. ACC/AHA guidelines for implantation of cardiac pacemakers and antiarrhythmia devices: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Pacemaker Implantation). J Am Coll Cardiol 1998; 31: 1175-209.
3. Andrade ZA, Camara EJ, Sadigursky M, et al. Envolvimento do nódulo sinusal na doença de Chagas. Arq Bras Cardiol 1988; 50: 153-8.
4. Pimenta J. Estudo dos bloqueios de ramo em pacientes chagásicos crônicos assintomáticos. Contribuição do estudo eletrofisiológico. São Paulo,1997 (Tese de doutorado Hospital do Servidor Público Estadual Francisco Morato de Oliveira).
5. Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Clinical Intracardiac Electrophysiologic and Catheter Ablation Procedures), developed in collaboration with the North American Society of Pacing and Electrophysiology. J Am Coll Cardiol 1995, 26: 555-73.
6. Sosa EA, de Paola A, Gizzi J, et al. Indicações para estudos eletrofisiológicos e ablação por cateter de arritmias cardíacas. Recomendações do DAEC da SBC. Arq Bras Cardiol 1995; 65:149-51.
Bloqueios atrioventriculares (BAV) - O EEF permite a localização anatômica do bloqueio atrioventricular 1: a) proximal (pré-Hissiano) - acima do feixe de His, representando atraso ou bloqueio na condução pelo nódulo AV; b) intra His, representando atraso ou bloqueio dentro do feixe de His; c) infra His, representando atraso ou bloqueio distal ao feixe de His.
Os BAV são classificados em bloqueios do 1º, 2º e 3º graus. O BAV de 1º grau apresenta apenas retardo na condução AV com valores do intervalo PR acima de 0,20s. Em geral não é preocupante, a não ser quando associado a sintomas de hipofluxo cerebral. Nesse caso, merece estudo invasivo, para avaliar se o bloqueio localiza-se no feixe de His. podendo evoluir com episódios de BAV total paroxístico. O BAV de 2º grau tipo I apresenta aumento gradual do intervalo PR culminando com uma onda P bloqueada, após a qual, o intervalo PR retorna ao valor inicial. O BAV de 2º grau tipo II apresenta condução AV 1: 1, sem aumento do intervalo PR, até o surgimento de uma ou eventualmente mais ondas P bloqueadas. Existem certas correlações entre a apresentação eletrocardiográfica e o local do bloqueio 2. O bloqueio de 2º grau tipo I com complexos QRS estreitos, usualmente localiza-se ao nível do nódulo AV, raramente, pode estar dentro do feixe de His. Quando o BAV de 2º grau tipo I apresenta complexos QRS largos, o bloqueio pode estar no nódulo AV, no tronco do feixe de His ou abaixo dele. O BAV de 2º grau tipo II localiza-se dentro ou abaixo do feixe de His e, freqüentemente, apresenta-se com bloqueio de ramo. O BAV total com ritmo de escape com complexos QRS estreitos, localiza-se no nódulo AV ou dentro do feixe de His e quando os complexos QRS apresentam-se alargados, pode localizar-se no nódulo AV, dentro do feixe de His ou mais abaixo desta estrutura. O curso clínico dos pacientes com BAV de 2º grau nodal é usualmente benigno e seu prognóstico depende da presença e severidade da doença cardíaca de base 3. Os casos de BAV localizados no feixe de His ou abaixo da sua bifurcação têm prognóstico pior, evoluindo para bloqueios de graus mais elevados, tornando-se sintomáticos 4. Pacientes com BAV total não tratados tornam-se freqüentemente sintomáticos, independendo do local do bloqueio 5.
Recomendações para o estudo eletrofisiológico 6-9
Grau A - Pacientes com BAV de 2º e 3º grau, com marcapasso implantado normofuncionante, nos quais persistem os sintomas e suspeita-se que outra arritmia seja a causa (N2).
Grau B1 - Portadores de BAV de 1º grau sintomáticos, com distúrbio na condução intraventricular, em que se suspeita de lesão no sistema His-Purkinje (N2).
Grau B2 - Pacientes com BAV de 2º grau, com distúrbios na condução intraventricular, assintomático (N3).
Grau C - BAVT permanente, assintomático (N2).
Referências
1. Damato NA, Lau SH, Helfant R, et al. A study of heart block in man using His bundle recordings. Circulation 1969; 39: 297-305.
2. Zipes DP. Second-degree atrioventricular block. Circulation 1979; 60: 465-72.
3. Strasberg B, Amat-Y-Leon F, Dhingra RC, et al. Natural history of chronic second-degree atrioventricular nodal block. Circulation 1981; 63: 1043-9.
4. Dhingra RC, Denes P, Wu D, Chuquimia R, Rosen KM. The significance of second-degree atrioventricular block and bundle branch block: observations regarding site and type of block. Circulation 1974; 49: 638-46.
5. Narula OS, Scherlag BJ, Javier RP, Hildner FJ, Samet P. Analysis of the AV conduction defect in complete heart block utilizing His bundle electrograms. Circulation 1970; 41: 437-48.
6. Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Clinical Intracardiac Electrophysiologic and Catheter Ablation Procedures), developed in collaboration with the North American Society of Pacing and Electrophysiology. J Am Coll Cardiol 1995, 26: 555-73.
7. Telfer EA, Olshansky B. Bradiarrhythmias as a cause of syncope. In Grubb BP, Olshansky B, eds: Syncope: Mechanisms and Management. 1st ed. Armonk: Futura Publishing Co., 1998: 127-66.
8. Sosa EA, de Paola A, Gizzi J, et al. Indicações para estudos eletrofisiológicos e ablação por cateter de arritmias cardíacas. Recomendações do DAEC da SBC. Arq Bras Cardiol 1995; 65: 149-51.
9. Mangrum JM, Dimarco JP. The evaluation and management of bradicardia. N Engl J Med 2000; 342: 703-9.
Distúrbios da condução intraventricular - Pacientes com bloqueio bifascicular e intervalo HV prolongado (>55ms) apresentam um discreto aumento no risco de desenvolver BAV total (2-3% ao ano). Entretanto, quando o intervalo HV ultrapassa 100ms o risco de BAVT aumenta significantemente 1-3. A indução de BAV de alto grau durante a estimulação atrial apresenta alto valor preditivo positivo para ocorrência espontânea de BAVT 4. É importante salientar que nestes pacientes a síncope ou a morte súbita podem ser secundárias às taquicardias ventriculares 5,6.
Recomendações para o estudo eletrofisiológico 7-10
Grau A - Pacientes com marcapasso implantado, normofuncionante, que permanecem sintomáticos, nos quais uma arritmia é suspeitada (N2).
Grau B1 - Nenhuma.
Grau B2 - Pacientes assintomáticos que necessitem de medicamentos com ação importante no sistema His-Purkinje (N4).
Grau C - Nenhuma.
Referências
1. Dhingra RC, Palileo E, Strasberg B, et al. Significance of the HV interval in 517 patients with chronic bifascicular block. Circulation 1981; 64: 1265-71.
2. Scheinman MM, Peters RW, Modin G, et al. Prognostic value of infranodal conduction time in patients with chronic bundle branch block. Circulation 1977; 56: 240-4.
3. McAnulty JH, Rahimtoola SH, Murphy E, et al. Natural history of high-risk bundle-branch block: final report of a prospective study. N Engl J Med 1982; 307: 137-43.
4. Dhingra RC, Wyndham C, Bauernfeind R, et al. Significance of block distal to the His bundle induced by atrial pacing in patients with chronic bifascicular block. Circulation 1979; 60: 1455-64.
5. Fish GR, Zipes DP, Fish C. Bundle branch block and sudden death. Prog Cardiovasc Dis 1980; 23: 187-224.
6. Ezri M, Lerman BB, Marchlinski FE, et al. Electrophysiologic evaluation of syncope in patients with bifascicular block. Am Heart J 1983; 106: 693-7.
7. Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Clinical Intracardiac Electrophysiologic and Catheter Ablation Procedures), developed in collaboration with the North American Society of Pacing and Electrophysiology. J Am Coll Cardiol 1995; 26: 555-73.
8. Telfer EA, Olshansky B. Bradiarrhythmias as a cause of syncope. In: Grubb BP, Olshansky B, eds. Syncope. Mechanisms and Management. 1st ed. Armonk: Futura Publishing Co., 1998: 127-66.
9. Sosa EA, de Paola A, Gizzi J, et al. Indicações para estudos eletrofisiológicos e ablação por cateter de arritmias cardíacas. Recomendações do DAEC da SBC. Arq Bras Cardiol 1995; 65: 149-51.
10. Mangrum JM, Dimarco JP. The evaluation and management of bradicardia. N Engl J Med 2000; 342: 703-9.
B) Avaliação eletrofisiológica em pacientes com taquicardia com QRS estreito
Nos últimos 30 anos, com o advento do estudo eletrofisiológico, os mecanismos responsáveis pela origem e manutenção dos circuitos arritmogênicos puderam ser esclarecidos e confirmados 1-3. Com a evolução do conhecimento e da tecnologia, o procedimento eletrofisiológico deixou de oferecer apenas a opção diagnóstica 4 e começou também a ser utilizado para o tratamento através da ablação 5.
Taquicardias supraventriculares - As taquicardias supraventriculares apresentam características eletrocardiográficas típicas que durante a análise do ECG sugerem seu diagnóstico, na maioria dos pacientes. Entretanto, em alguns casos o mecanismo da taquicardia só pode ser determinado pelo estudo eletrofisiológico.
Em pacientes com síndrome de Wolff-Parkinson-White, a presença de uma via acessória com capacidade de condução anterógrada rápida e período refratário curto acarreta o risco de fibrilação ventricular e morte súbita 6,7. O estudo eletrofisiológico identifica o paciente em risco 8 e permite que no mesmo procedimento, após a sua localização, a via acessória seja eliminada pela ablação.
O estudo eletrofisiológico invasivo está indicado previamente à realização da ablação para o perfeito diagnóstico do mecanismo da taquicardia, para identificar as estruturas cardíacas componentes do circuito e localizar a região vulnerável sobre a qual deverá ser realizada a ablação 3.
Recomendações para a indicação dos estudos eletrofisiológicos
Grau A, N2 - 1) Pacientes com crises de taquicardia supraventricular freqüentes ou mal toleradas hemodinamicamente, que não respondem ao tratamento ou então, situações em que a determinação dos componentes do circuito arritmogênico ou de suas propriedades eletrofisiológicas são importantes para o tipo de tratamento (ablação por cateter, marcapasso, desfibrilador atrial implantável, cirurgia); 2) pacientes que preferem submeter-se à terapêutica não farmacológica.
Grau B - Nenhuma.
Grau C (N4) - 1) Pacientes com episódios esporádicos de taquicardia revertidos com manobras vagais ou facilmente controláveis com antiarrítmicos; 2) pacientes que não aceitam a terapêutica não farmacológica.
Pacientes com pré-excitação ventricular
Recomendações para a indicação dos estudos eletrofisiológicos
Grau A, N2 - 1) Pacientes que serão submetidos à ablação cirúrgica ou por cateter.
Grau B1, N4 - 1) Pacientes assintomáticos com atividade de alto risco.
Grau C - Nenhuma.
Referências
1. Sherlag BJ, Lau SH, Helfant RH, et al. Catheter technique for recording His bundle activity in man. Circulation 1969; 29: 13-8.
2. Horowitz LN, Josephson ME, Farshidi A, et al. Recurrent sustained ventricular tachycardia. Role of the electrophysiologic study in selection of antiarrhythmic regimens. Circulation 1978; 58: 987-97.
3. Josephson ME. Clinical Cardiac Electrophysiology. Philadelphia: Lea & Febiger, 1993.
4. Horowitz LN, Kay HR, Kutalek SP, et al. Risk and complications of clinical electrophysiologic studies. A prospective analysis of 1000 consecutive patients. J Am Coll Cardiol 1987; 9: 1261-8.
5. Gallagher JJ, Svenson RH, Castle JH, et al. Catheter technique for closed chest ablation of the atrial ventricular conduction system: a therapeutic alternative for the treatment of refractory supraventricular tachycardia. N Eng J Med 1982; 306: 194-200.
6. Dreifus LS, Haiat R, Watanabe Y, et al. Ventricular fibrillation: a possible mechanism of sudden death in patients with Wolff-Parkinson-White syndrome. Circulation 1971; 43: 520-7.
7. Klein GJ, Bashore TM, Sellers TD. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. N Engl J Med 1979; 301: 1080-5.
8. ACC/AHA Task Force. Guidelines for clinical intracardiac electrophysiologic studies. Circulation 1995; 92: 673-91.
C) Avaliação eletrofisiológica em pacientes com taquicardia com QRS largo
A distinção entre taquicardias com QRS largo (duração do QRS maior que 120ms) ou estreito (menor que esse valor) é uma convenção adotada para uma simplificação de diagnósticos, uma vez que a presença de complexos alargados sugere, a princípio, a origem ventricular da arritmia. No entanto, por vezes se faz necessário o diagnóstico diferencial entre taquicardias supraventriculares com bloqueio de ramo (pré-existente ou funcional), taquicardias antidrômicas por via acessória, ou taquicardias ventriculares.
Vários critérios eletrocardiográficos são utilizados para auxiliar no diagnóstico diferencial destes mecanismos 1,2. O estudo eletrofisiológico invasivo está indicado quando o conhecimento do mecanismo exato da arritmia é importante para a decisão terapêutica. Com o advento da ablação por radiofreqüência, o diagnóstico diferencial deixa de ser um exercício clínico e passa a indicar de maneira mais precisa o tratamento 3.
Recomendações para a indicação dos estudos eletrofisiológicos
Grau A, N4 - 1) Pacientes com taquicardia com QRS alargado nos quais o mecanismo e/ou a origem da arritmia estão mal definidos por métodos não invasivos visando principalmente à terapia adequada; 2) pacientes com taquicardia de QRS alargado, mesmo que o mecanismo e/ou a origem da arritmia estejam bem definidos por métodos não invasivos, para melhor definição de terapêutica não farmacológica nos pacientes que necessitem dessa terapia; 3) pacientes com taquicardias supraventriculares com condução aberrante ou pré-excitadas, claramente definidas por métodos não invasivos em quem se considera a opção de terapia não farmacológica.
Grau B - Nenhuma.
Grau C - Pacientes com taquicardias supraventriculares com condução aberrante ou pré-excitadas claramente definidas, por métodos não invasivos, em quem não se considera terapia não farmacológica.
Referências
1. Brugada P, Brugada J, Mont L, et al. A new approach to the differential diagnosis of a regular tachycardia with a wide QRS complex. Circulation. 1991; 83: 1649-59.
2. Antunes E, Brugada J, Steurer G, et al. The differential diagnosis of a regular tachycardia with a wide QRS complex on the 12-lead ECG: ventricular tachycardia, supraventricular tachycardia with aberrant intraventricular conduction, and supraventricular tachycardia with anterograde conduction over an accessory pathway. PACE Pacing Clin Electrophisiol. 1994; 17: 1515-24.
3. Sosa EA, Lorga AM, de Paola AAV, et al. Indicações para estudos eletrofisiológicos intracardíacos - 1988. Recomendações da Comissão da Sociedade de Cardiologia do Estado de São Paulo e do Grupo de Estudos de Arritmias e Eletrofisiologia da Sociedade Brasileira de Cardiologia. Arq Bras Cardiol 1988; 51: 427-8.
Parte III
Tratamento Clínico das Arritmias Cardíacas
Introdução
Ao se indicar procedimentos terapêuticos em pacientes com arritmias cardíacas deve-se antes considerar as características clínicas do paciente, aspecto fundamental para o sucesso do tratamento. Assim, uma mesma arritmia pode ter repercussão e riscos diferentes, conforme a idade do indivíduo, o grau de acometimento cardíaco e a situação em que ocorre. Sempre que possível o mecanismo da arritmia e as estruturas envolvidas (átrios, ventrículos, nó AV, sistema de condução) devem ser identificados para a correta decisão terapêutica. O conhecimento preciso dos métodos diagnósticos e dos fármacos potencialmente úteis (quadro III) reforçará a eficácia terapêutica e a segurança no tratamento do paciente com arritmia cardíaca 1-8.
Esta diretriz tem a finalidade de analisar as indicações dos procedimentos diagnósticos e terapêuticos e avaliar os riscos e benefícios dessas indicações.
Extra-sístoles
As extra-sístoles (ES) atriais e ventriculares podem representar distúrbio elétrico isolado na formação de impulsos (ES idiopáticas) ou refletir hiperexcitabilidade miocárdica devido à estimulação adrenérgica excessiva (drogas estimulantes), distúrbio eletrolítico (hipopotassemia), intoxicação medicamentosa (digital), metabolismo aumentado (hipertireoidismo), ou ainda ser expressão de doença cardíaca (dilatação de câmaras ou cicatrizes miocárdicas), alterações isquêmicas ou de disfunção ventricular.
As ES podem ou não provocar sintomas (palpitações tipo falha). A manifestação de pré-síncope, síncope ou palpitações taquicárdicas sugere a presença de outras síndromes taquicárdicas associadas e justifica investigação específica. As ES quase nunca merecem tratamento medicamentoso, a não ser quando muito sintomáticas. Os fatores causais, quando identificados, devem ser corrigidos.
O tratamento das ES, como em qualquer outra condição clínica, deve considerar sempre a relação risco/benefício, devendo o médico procurar mantê-la no nível mais baixo possível. O risco proveniente do agente terapêutico potencialmente benéfico deve ser o primeiro ponto a ser considerado, sendo a pró-arritmia o mais importante 9 (quadros IV e V ).
Taquicardias supraventriculares
As taquicardias supraventriculares apresentam, em geral, complexos QRS estreitos (<120ms), bem definidos, regulares e semelhantes entre si. A freqüência cardíaca, em média, encontra-se entre 140 e 180bpm, exceto em crianças, nas quais a freqüência geralmente ultrapassa 200bpm. Às vezes, os complexos QRS apresentam-se alargados (>110ms), obrigando o diagnóstico diferencial com as taquicardias ventriculares.
Na taquicardia por reentrada nodal, a taquicardia supraventricular mais comum, o nó AV apresenta duas vias de condução com características eletrofisiológicas diferentes. Comumente a taquicardia inicia-se em decorrência de uma extra-sístole atrial, cujo estímulo é bloqueado na via rápida e conduzido pela via lenta. A taquicardia se estabelece quando a via rápida e a via lenta apresentam características funcionais, que permitem a manutenção do movimento circular. No mecanismo mais comum a via lenta é o componente anterógrado (condução para os ventrículos) e a via rápida o retrógrado (condução para os átrios). Raramente, a reentrada no nó AV ocorre em sentido inverso (incomum), sendo a via rápida responsável pela condução anterógrada e a via lenta pela retrógrada.
O outro mecanismo comum de taquicardia supraventricular usa pelo menos uma via de condução atrioventricular acessória no circuito de reentrada. Quando a via apresenta condução bidirecional pode ser facilmente identificada ao ECG, durante ritmo sinusal, pelo intervalo PR curto e onda delta (síndrome de Wolff-Parkinson-White). Mas, em torno de 35% desses pacientes, a via acessória apresenta condução ventrículo-atrial exclusiva, não podendo ser identificada durante o ritmo sinusal normal.
A identificação do tipo e mecanismo das taquicardias supraventriculares sustentadas auxilia tanto na reversão como na prevenção das crises (quadros VI e VII) 10.
Taquiarritmias atriais
As taquiarritmias atriais são classificadas em taquicardias atriais, flutter atrial e fibrilação atrial, segundo critérios de análise eletrocardiográfica. Os principais critérios diagnósticos são a origem, a regularidade e a freqüência da atividade atrial.
Taquicardias atriais
As taquicardias atriais podem ser automáticas ou reentrantes. Quando se apresentam com a morfologia da onda P diferente da onda P sinusal, são de fácil reconhecimento. Entretanto, as taquicardias que se originam na vizinhança do nó sinusal (taquicardia sinusal reentrante ou taquicardia sinusal inapropriada), podem ter características morfológicas idênticas à da taquicardia sinusal secundária a um mecanismo fisiológico ou patológico. A taquicardia sinusal reentrante é facilmente interrompida durante manobra vagal ou por injeção IV de adenosina ou verapamil. Já a taquicardia sinusal inapropriada responde a essas manobras de modo semelhante à da taquicardia sinusal fisiológica e para se confirmar o diagnóstico é necessário afastar outras causas de taquicardia sinusal secundária.
As taquicardias atriais automáticas apresentam-se, geralmente, sob a forma incessante ou em episódios autolimitados muito freqüentes, com fenômeno de aquecimento e desaquecimento. São suprimidas temporariamente pela infusão de adenosina. Ocorrem principalmente em crianças e apresentam-se, inicialmente, com quadro clínico benigno, devido à ausência de sintomas e de cardiopatia estrutural e entre 20% e 40% dos casos podem apresentar remissão espontânea. Entretanto, podem evoluir com quadro de insuficiência cardíaca congestiva (taquimiocardiopatia) e raramente podem levar à morte súbita.
As taquicardias atriais reentrantes estão freqüentemente associadas a cardiopatias estruturais, em particular à dilatação das câmaras atriais e em até 70% dos casos, são observados episódios concomitantes de flutter e fibrilação atrial. As taquicardias atriais reentrantes também são freqüentes no período pós-operatório tardio das cirurgias de correção de cardiopatias congênitas, e nesses casos, o mecanismo reentrante tem sido correlacionado com a presença de barreiras anatômicas (cicatrizes) criadas pela operação. Seu manejo é semelhante ao do flutter atrial.
Flutter atrial
O flutter atrial apresenta características eletrocardiográficas típicas. Diferencia-se da fibrilação atrial pela regularidade das ondas P e da taquicardia atrial, pela freqüência atrial, caracteristicamente em torno de 300bpm. Em geral o bloqueio se faz 2:1 e a freqüência cardíaca é de 150bpm. No flutter atrial há uma frente de onda de ativação atrial que circunda regularmente o anel da valva tricúspide no sentido anti-horário (flutter comum) ou horário (flutter incomum). Raramente, o circuito do flutter atrial organiza-se em outras estruturas anatômicas do átrio direito e esquerdo e nesses casos é denominado de flutter atípico.
O flutter atrial pode ocorrer em indivíduos com coração estruturalmente normal, mas é mais freqüente em pacientes com aumento do átrio direito. Está associado à doença pulmonar obstrutiva crônica, doença valvar mitral e tricúspide, tireotoxicose, pós-operatório recente das cirurgias cardíacas e tardio nos indivíduos submetidos a incisões atriais.
O significado clínico do flutter atrial está relacionado à freqüência cardíaca elevada, podendo levar ao quadro de taquicardiomiopatia. Pode favorecer a formação de trombos nos átrios e provocar embolia pulmonar ou sistêmica. A associação com síndrome de WPW com via acessória e período refratário curto pode levar à morte súbita. A forma mais efetiva de reverter o flutter atrial persistente é a cardioversão elétrica. Seu manejo clínico e os critérios para uso de anticoagulação e do eco transesofágico são os mesmos sugeridos aos pacientes com fibrilação atrial. As drogas antiarrítmicas apresentam baixa taxa de reversão do flutter atrial sustentado, sendo a cardioversão elétrica sincronizada o meio mais eficaz para sua reversão.
Fibrilação atrial
A fibrilação atrial, arritmia mais freqüente na clínica, atinge parte importante da população, principalmente de idosos, com repercussão hemodinâmica às vezes importante e complicações sérias (insuficiência cardíaca, embolias sistêmicas). Não raro paroxística e autolimitada, freqüentemente necessita intervenção médica para ser controlada. Dois terços das fibrilações atriais recentes revertem em 48h a ritmo sinusal, espontaneamente. Ainda não há consenso se a fibrilação atrial persistente deve ser tratada com controle do ritmo, por cardioversão elétrica ou química seguida de manutenção de ritmo sinusal (quadros VIII e IX) ou com controle de freqüência e manutenção da arritmia. Neste último caso, na maioria das vezes, temos que considerar a anticoagulação oral, com controle clínico e laboratorial rigorosos 11. Estes fármacos também devem ser utilizados antes, durante e depois de cardioversão elétrica ou química, conforme recomendação internacional 12,13.
Taquicardia ventricular monomórfica sustentada
As crises de taquicardia ventricular sustentada apresentam-se com graus variados de repercussão clínica, principalmente em função da presença ou não de disfunção ventricular. Quando sintomática ou persistente exige tratamento para reversão da crise (quadro X) e prevenção das recorrências. No controle da crise, a recomendação é sempre usar um único antiarrítmico e em caso de insucesso, cardioversão elétrica em seguida, sem insistir em outros fármacos, pelo alto risco de pró-arritmias 10.
Prevenção primária da morte súbita: o papel dos antiarrítmicos
A morte súbita é responsável por 400 mil mortes por ano nos Estados Unidos. No Brasil não dispomos de estatísticas desse tipo, mas supõe-se que, proporcionalmente, existam pelo menos 200 mil por ano. As etiologias mais freqüentes em nosso meio são a cardiopatia isquêmica e, provavelmente, a doença de chagas, principalmente em antigas áreas endêmicas. O principal mecanismo de morte súbita é a fibrilação ventricular, precedida ou não por taquicardia ventricular sustentada 14. Causas cardiovasculares não-arrítmicas (embolia pulmonar, acidente vascular encefálico, dissecção aguda da aorta, etc.) são menos freqüentes. As bradiarritmias são causas importantes de morte súbita em pacientes com insuficiência cardíaca avançada 15. As arritmias ventriculares não-sustentadas são reconhecidas como marcadores desse desenlace. Entretanto, o uso de drogas de classe I para diminuir sua ocorrência e, conseqüentemente, a morte súbita, apresentou resultado oposto ao esperado, por provável pró-arritmia 9.
Evidências mais recentes indicam que apenas os betabloqueadores e a amiodarona, entre os antiarrítmicos, são capazes de controlar arritmias sintomáticas, sem aumentar a mortalidade quando comparada a placebo ou a outros anti-arrítmicos 16. A indicação do cardioversor e desfibrilador automático implantável (CDI), nesta condição, será discutida em capítulo adiante. Novos estudos, em curso, responderão com mais segurança essa questão (SCB-HEFT, MADIT 2, DINAMIT). Os quadros XI a XV contêm as recomendações de antiarrítmicos nas várias situações clínicas com a intenção de prevenir morte súbita, em pacientes de alto risco.
Evidências recentes sugerem que, em situações específicas, o uso de CDI, pode ser mais eficaz que os fármacos antiarrítmicos, mas a um custo nem sempre adequado para o indivíduo ou a comunidade 17.
Pacientes recuperados de parada cardíaca. Avaliação e conduta imediata
Os principais objetivos no manejo de pacientes recuperados de parada cardíaca são estabelecer a situação clínica em que o evento ocorreu, reconhecer os possíveis fatores deflagradores, tratar as complicações secundárias à parada cardíaca e evitar que o evento se repita 18. A investigação está apresentada nos quadros XVI a XVIII e a indicação de antiarrítmicos dependerá do substrato clínico subjacente.
Arritmias ventriculares na doença de Chagas
As arritmias ventriculares são uma das manifestações mais expressivas da cardiopatia chagásica crônica, não só por provocarem sintomas, mas principalmente por constituírem importante fator de risco de morte súbita, especialmente se associadas a comprometimento da função ventricular 19. Podem ser classificadas em isoladas e repetitivas 20 e, estas últimas, subdivididas em pares de extra-sístoles ventriculares e episódios de taquicardia ventricular. A arritmia ventricular isolada corresponde às extra-sístoles ventriculares isoladas, mono ou polimórficas. A arritmia ventricular repetitiva é aquela que se manifesta em forma de dois ou mais batimentos ventriculares sucessivos. A presença de dois batimentos ventriculares sucessivos recebe a denominação de par de extra-sístoles, enquanto que três ou mais batimentos sucessivos constituem as taquicardias ventriculares, que podem ser não-sustentadas, quando a duração é <30s e sustentadas, quando a duração é >30s ou inferior a este período se interrompida elétrica ou farmacologicamente. As manifestações clínicas das arritmias ventriculares podem estar ausentes ou, quando presentes, traduzirem-se por palpitações, pré-síncope, síncope e morte súbita.
Pacientes assintomáticos ou oligossintomáticos com extra-sístoles ventriculares isoladas e até mesmo com episódios não-sustentados de taquicardia ventricular (TVNS), geralmente não devem ser tratados se a função ventricular for normal. Nos casos de opção pelo tratamento antiarrítmico (p.ex., densidade elevada de arritmia), a escolha do fármaco pode ser individualizada. Já os pacientes assintomáticos com TVNS acompanhada de disfunção ventricular, os sintomáticos com TVNS, os com taquicardia ventricular sustentada (TVS) hemodinamicamente estável e aqueles com TVS hemodinamicamente instável e fração de ejeção >35%, a princípio, têm indicação para o tratamento farmacológico e a amiodarona constitui o fármaco de primeira escolha. Vale ressaltar que apesar da inexistência de estudos randomizados, envolvendo drogas antiarrítmicas na cardiopatia chagásica crônica, resultados de estudos prospectivos randomizados e de meta-análises recentes em pacientes com cardiopatia de outras etiologias, como a isquêmica e a dilatada idiopática, indicam que a amiodarona, ao contrário dos antiarrítmicos da classe I, é capaz de prevenir a morte súbita e também de reduzir a mortalidade total em pacientes de alto risco, com arritmias ventriculares complexas e/ou insuficiência cardíaca 21. Além de reduzir a mortalidade, a amiodarona apresenta extraordinária eficácia antiectópica, pequena incidência de efeitos colaterais de monta e de pró-arritmia, particularmente quando administrada em doses baixas, e só excepcionalmente altera o inotropismo. Tais características, reforçadas por resultados de estudos observacionais 19,22 que atestam a eficácia da amiodarona, justificam a sua administração a chagásicos com arritmias ventriculares complexas e disfunção ventricular. Finalmente, e mais uma vez, por extrapolação de resultados obtidos em pacientes com taquiarritmias ventriculares de outras etiologias 23, a amiodarona e/ou o cardioversor-desfibrilador implantável (DCI) estão recomendados a pacientes com TVS hemodinamicamente instável ou fibrilação ventricular e fração de ejeção <35%, após cardioversão elétrica (CVE), como tratamento de manutenção, com vistas à profilaxia de recorrências e prevenção de morte súbita (quadro XIX).
Referências
1. Braunwald E, Zipes D, Libby P. Heart Disease. A Textbook of Cardiovascular Medicine. 6th Ed. Philadelphia: WB Saunders, 2001: Caps. 23 a 26.
2. Porto CC. Doenças do Coração. Rio de Janeiro: Guanabara-Kogan, 1998. Caps. 49 a 61.
3. Lorga AM. Manuseio Clínico das Arritmias Cardíacas. Soc Cardiol Estado de São Paulo 1998; 8: 1-208.
4. Motta P, Sanches PCR, Tranchesi B. Eletrocardiograma Normal e Patológico. 7ª Ed. São Paulo: Editora Roca, 2001: caps. 11-13.
5. Singh BN. Current Antiarrhythmic Drugs: An overview of mechanisms of action and potential clinical utility. J Cardiovasc Electrophysiol 1999; 10: 283-301.
6. Vaughan Williams EM. Classification of antiarrhythmic drugs. In: Sandoe E, Flenstedt Johnson E, Olesen KH. Eds. Symposium on Cardiac Arrhythmias. Sodertalje, Suécia: AB Astra, 1970: 440-69.
7. Nattel S, Singh BN. Evolution, mechanisms and classification of antiarrhythmic drugs: Focus on class III actions. Am J Cardiol 1999; 84 (9A) 11R-19R.
8. The Sicilian Gambit: A new approach to the classification of drugs based on their action on arrhythmogenic mechanisms. Circulation 1991; 84: 1831-51.
9. The CAST investigation; preliminary report: Effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med 1989; 321-406.
10. International Consensus on Science; Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardiovascular care. Circulation 2000; 102: I 112-I 171.
11. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med 1994; 154: 1449-57.
12. Working Group on Arrhythmias of the European Society of Cardiology. Atrial fibrillation: current knowledge and recommendations for management. Eur Heart J 1998; 19: 1294-320.
13. Hirsh J, Dalen J, Guyatt G for The American College of Chest Physicians. The sixth (2000) ACCP guidelines for antithrombotic therapy for prevention and treatment of thrombosis. Chest 2001; 119(1 suppl): 1S-2S.
14. Bayes de Luna A, Coumel P, Leqclerc JF. Ambulatory sudden death. Mechanism of production of fatal arrhythmia on the basis of data of 157 cases. Am Heart J 1989; 117: 151-9.
15. Luu M, Stevenson WG, Stevenson LW, Baron K, Walden J. Diverse mechanisms of Unexpected Cardiac Arrest in Advanced Heart Failure. Circulation 1989; 80: 1675-80.
16. Amiodarone Trials Meta-analysis Investigators Effect of prophylactic amiodarone on mortality after myocardial infarction and in congestive heart failure: Meta-analysis of individual data from 6500 patients from randomized trials. Lancet 1997; 350: 1417-24.
17. The Antiarrhythmics versus Implantable Defibrillator Investigators. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Eng J Med 1997; 337: 1576-83.
18. Goldstein S, Landis J, Leighton R, et al. Predictive survival models for resuscitated victims of out-of-hospital cardiac arrest with coronary heart disease. Circulation 1985; 71: 873-80.
19. Rassi Jr A, Rassi SG, Rassi A. Morte súbita na Doença de Chagas. Arq Bras Cardiol 2001; 76: 75-85.
20. Mendoza I, Guiniger A, Kushnir E, et al. Consenso do comitê de eletrofisiologia da "USCAS" sobre o tratamento das arritmias ventriculares na doença de Chagas. Arq Bras Cardiol 1994; 62: 41-3.
21. ATMA Investigators. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: Meta-analysis of individual data from 6500 patients in randomized trials. Lancet 1997; 350: 1417-24.
22. Scanavacca M, Sosa EA, Lee JH, Bellotti G, Pileggi F. Terapêutica empírica com amiodarona em portadores de miocardiopatia chagásica crônica e taquicardia ventricular sustentada. Arq Bras Cardiol 1990; 54: 367-71.
23. Connolly SJ, Hallstrom AP, Cappato R, et al. Meta-analysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmic vs. Implantable Defibrillator study. Cardiac Arrest Study Hamburg. Canadian Implantable Defibrillator Study. Eur Heart J 2000; 21: 2071-87.
Síncope neurocardiogênica
Pacientes com síncope indeterminada, sem doença cardíaca estrutural e com ECG normal, geralmente têm síncope neuromediada vaso-vagal 1-4. Esta é a causa mais comum de síncope, principalmente em crianças e adolescentes, correspondendo cerca de 30% de todas as etiologias 5.
Vários estímulos somáticos ou emocionais, como dor, medo, micção, evacuação ou tosse, podem desencadear o reflexo vaso-vagal. Quando o desencadeamento do reflexo se dá a partir dos macano-receptores intracardíacos, mediado pelo estresse ortostático, a síncope é denominada neurocardiogênica.
Assim, o termo síncope vasovagal abrange uma grande gama de desordens que causa perda da consciência por modificar o tônus vascular e a freqüência cardíaca reflexamente, com aumento na atividade eferente vagal em resposta à ativação de receptores centrais ou periféricos. A síncope vasovagal geralmente se apresenta com sintomas prodrômicos, como: fraqueza, sudorese, calor, náusea, tontura, borramento visual, cefaléia e palpitações. Estes sintomas podem ter duração variável, desde poucos segundos até vários minutos, progredindo para perda da consciência e do tônus postural. A síncope propriamente dita não costuma ter duração prolongada; por vezes pode ser acompanhada de convulsões, tornando difícil o diagnóstico diferencial com epilepsia. Mas ao contrário da convulsão epilética, a fase pós-sincopal não costuma apresentar desorientação nem retorno lento à consciência. Duração da perda da consciência maior que 5min sugere fortemente o diagnóstico de epilepsia 6.
Terapêutica clínica
A síncope neuromediada costuma ter bom prognóstico, embora recorrências freqüentes possam ter um grande impacto na qualidade de vida do paciente2,3. A maior parte dos pacientes não necessita de tratamento específico. Medidas gerais, como dieta rica em líquidos e sal, meias elásticas e atenção aos fatores desencadeantes são suficientes.
Utiliza-se tratamento específico em caso de recorrências apesar das medidas gerais, ou em caso de episódio isolado com trauma ou sem sintomas prodrômicos (onde o risco de injúria é maior), além de pacientes com profissão de risco.
Estudo randomizado demonstrou eficácia no controle de recorrências com atenolol assim como estudos controlados com paroxetina e midodrine 7-9. Relatos de séries envolvendo medicamentos como propranolol, metoprolol e fludocortisona, demonstraram bons resultados no controle de recorrências 10.
Mais recentemente, o treinamento postural passivo ou tilt training tem demonstrado eficácia no controle das recorrências, podendo ser empregado precocemente no manuseio síncope neurocardiogênica, quer seja de forma isolada como também associado a outras modalidades de tratamento 11,12.
A estimulação cardíaca através de marcapasso permanente, vem demonstrando redução no risco relativo de ocorrência de síncope em grupos seleto de pacientes 12-14. No entanto, os resultados deste procedimento até agora não foram comparados com tratamento farmacológico ou outras medidas não farmacológicas. Estudos adicionais são necessários para determinar a melhor terapêutica medicamentosa e definir o real papel do marcapasso na síncope vasovagal.
Recomendações para tratamento da síncope neurocardiogênica
Grau A - Medidas gerais dietéticas e posturais (N3).
Grau B2 - Betabloqueador (N2); fludocortisona (N3); midodrina (N2); inibidor de recaptação de serotonina (N3); marcapasso (N2); treinamento postural passivo (tilt-training) (N3).
Referências
1. Grubb BP, Gerard G, Roush K, et al. Cerebral vasoconstriction during head-upright tilt-induced vasovagal syncope. A paradoxical and unexpected response. Circulation 1991; 84: 1157-64.
2. Linzer M, Yang EH, Estes NA 3rd, Wang P, Vorperian VR, Kapoor WN. Diagnosing syncope1. Value of history, physical examination, and electrocardiography: Clinical Efficacy Assessment Project of the American College of Physicians. Ann Intern Med 1997; 126: 888-96.
3. Linzer M, Yang EH, Estes NA 3rd, Wang P, Vorperian VR, Kapoor WN. Diagnosing syncope2. Unexplained syncope: Clinical Efficacy Assessment Project of the American College of Physicians. Ann Intern Med 1997; 127: 76-86.
4. Kapoor WN, Hanusa B. Is syncope a risk factor for poor outcomes? Comparison of patients with and without syncope. Am J Med 1996; 100: 646-95.
5. Driscoll DJ, Jacobsen SJ, Porter CJ, Wollan PC. Syncope in children and adolescent. J Am Coll Cardiol 1997; 29: 1039-45.
6. Lempert T, Bauer M, Schmidt D. Syncope: a videometric analysis of 56 episodes of transient cerebral hipoxia. Ann Neurol 1994; 36: 233-7.
7. Mahanonda N, Bhuripanyo K, Kangkagate C, et al. Randomized double blind, placebo-controlled trial of oral atenolol in patients with unexplained syncope and positive upright tilt table test results. Am Heart J 1995; 130: 1250-3.
8. Di Girolamo E, Di Iorio C, Sabatini P, Leonzio L, Barbone C, Barsotti A. Effects of paroxatine hydrocloride, a selective serotonin reuptake inhibitor, on refractary vasovagal syncope: a randomized, double-blind, placebo-controlled study. J Am Coll Cardiol 1999; 33: 1227-30.
9. Perez-Lugones A, Schweikert R, Pavia S, et al. Usefulness of midodrine in patients with severely symptomatic neurocardiogenic syncope: A randomized control study. J Cardiovasc Electrophysiol 2001; 12: 935-8.
10. Ector H, Reybrouck T, Heidbuchel H, Gewillig M, Van de Werf F. Tilt training: a new treatment for recurrent neurocardiogenic syncope and severe orthostatic intolerance. Pacing Clin Electrophysiol 1998; 21(1 Pt 2): 193-6.
11. Di Girolamo E, Di Iorio C, Leonzio L, Sabatini P, Barsotti A. Usefulness of a tilt training program for the prevention of refractory neurocardiogenic syncope in adolescents: A controlled study. Circulation 1999; 100: 1798-801.
12. Kapoor WN. Primary Care Syncope. N Engl J Med 2000; 343: 1856-62.
Parte IV
Ablação por Cateter das Taquiarritmias Cardíacas
A ablação por cateter utilizando energia de radiofreqüência, revolucionou o tratamento das arritmias cardíacas. As lesões produzidas são bem delimitadas, medindo de 4 a 6mm, permitindo modificações bem controladas do substrato arritmogênico 1-3. Por esta razão, o número de procedimentos de ablação vem aumentando progressivamente. A ablação por cateter melhora a qualidade de vida dos pacientes tratados a um custo menor do que o tratamento medicamentoso a longo prazo 4,5.
O sucesso do procedimento, bem como suas complicações, variam conforme a arritmia a ser tratada e a experiência do laboratório de eletrofisiologia. As principais complicações da ablação são o bloqueio AV total, o tamponamento cardíaco e as lesões relacionadas à obtenção do acesso vascular. Acidente vascular cerebral, lesão valvar grave, oclusão coronariana e morte relacionada ao procedimento ocorrem em 0,2% dos pacientes 6-9.
Diretrizes técnicas
Ambiente hospitalar - 1) Sala de eletrofisiologia equipada com infra-estrutura para lidar com emergências cardiovasculares; 2) suporte de cirurgia cardíaca, de hemodinâmica, e de unidade de tratamento intensivo.
Pessoal - 1) Equipe médica treinada em eletrofisiologia invasiva, trabalhando sob a coordenação do eletrofisiologista habilitado pelo DAEC; 2) médico(a) anestesista para administrar a sedação do paciente; 3) enfermeiro(a) ou técnico(a) de enfermagem para realizar os trabalhos auxiliares do procedimento.
Equipamentos - 1) Arco rotável de raios-X para a obtenção das imagens fluoroscópicas ou aparelho de hemodinâmica. Recomendam-se equipamentos que minimizem a exposição à radiação; 2) polígrafo para obtenção e gravação de registros eletrocardiográficos, com número mínimo de oito canais simultâneos, com no mínimo de seis canais intracavitários para o mapeamento de todos os procedimentos de ablação; 3) estimulador cardíaco com capacidade de programar estímulos básicos e, no mínimo, três extra-estímulos; 4) gerador de radiofreqüência de, no mínimo, 50 Watts; 5) cateteres-eletrodos diagnósticos e terapêuticos diversificados; 6) desfibriladores cardíacos externos - mínimo de dois; 7) marcapasso temporário; 8) monitor de ECG; 9) oxímetro; 10) bomba de infusão IV; 11) material de reanimação cardiopulmonar.
Características do procedimento
Internação - Internação hospitalar para o procedimento é geralmente de um a três dias.
Monitorização - Durante o procedimento, o paciente permanece com eletrocardiograma, pressão arterial e oximetria continuamente monitorizados. A monitorização eletrocardiográfica é feita com o eletrocardiograma do polígrafo e do cardioversor-desfibrilador.
Sedação/anestesia - Com o uso da radiofreqüência, tornou-se dispensável a anestesia geral, exceto para crianças. Os pacientes podem ser submetidos à sedação com diferentes medicações: midazolan, opióides, propofol, etc.
Acessos - A maior parte dos procedimentos é realizada a partir de acessos venosos, sendo a veia femoral direita o acesso preferencial. Outros acessos venosos utilizados são a veia femoral esquerda, jugular direita (útil para colocação de cateter em seio coronariano). Quando necessário o acesso arterial, a artéria femoral direita é o acesso preferencial, sendo à esquerda a alternativa inicial. A punção transeptal é uma alternativa para a abordagem das câmaras esquerdas. A ablação realizada no seio coronariano é reservada aos casos de feixes ou circuitos epicárdicos que não se pode resolver por via endocárdica.
Número e característica dos cateteres - O número e característica dos cateteres usados variam habitualmente de 2 a 6 cateteres. Todos os cateteres usados são multipolares, sendo que os usados para a ablação apresentam eletrodo distal de ao menos 4mm. Alguns cateteres multipolares especiais podem ser usados em casos específicos.
Avaliação eletrofisiológica mínima e laudo mínimo
A avaliação eletrofisiológica realizada durante o procedimento de ablação e o laudo mínimo deve contemplar: 1) descrição das punções e do posicionamento dos cateteres; 2) avaliação da condução pela junção atrioventricular e sistema His-Purkinje: aferição dos intervalos AH e HV e a duração do QRS expressos em milissegundos; determinação do ponto de Wenckenbach anterógrado do nó atrioventricular durante estimulação atrial contínua; estabelecer a presença da condução ventrículo-atrial durante estimulação ventricular programada; 3) a avaliação eletrofisiológica mínima deve incluir os elementos necessários para o diagnóstico diferencial das taquiarritmias induzidas e para a seleção do alvo; 4) o laudo mínimo deve restringir-se à descrição do procedimento e ao resultado da avaliação eletrofisiológica. Pode conter apenas o diagnóstico final da arritmia, mas deve destacar os critérios utilizados para a seleção do alvo, o número de aplicações utilizadas e o resultado destas aplicações. Os traçados que demonstram os mecanismos da arritmia e o resultado da ablação devem ser anexados ao laudo; 5) o laudo não pode incluir indicações de novos procedimentos.
Indicações
Taquiarritmias
Taquicardia sinusal inapropriada - Taquicardia sinusal inapropriada é uma entidade caracterizada por uma freqüência cardíaca em repouso > 100bpm e/ou resposta exagerada da freqüência cardíaca (>100bpm) a mínimos esforços. O eixo e morfologia da onda P são iguais aos do ritmo sinusal. A ablação por radiofreqüência tem como objetivo a redução da freqüência cardíaca em torno de 30%, durante infusão de isoproterenol e/ou atropina, sendo a ablação total do nó sinusal e implante de marcapasso raramente recomendados. Dezesseis por cento dos pacientes necessitam de marcapasso por disfunção sinusal após a ablação e 32% dos pacientes apresentam sintomas recorrentes 10.
Recomendação A - Nenhuma.
Recomendação B2
Nível 2 - Taquicardia sinusal inapropriada sintomática refratária a drogas.
Recomendação C
Taquicardia sinusal inapropriada assintomática
Taquicardia atrial - As localizações mais comuns das taquicardias atriais são a crista terminalis e o orifício das veias pulmonares. A taquicardia atrial afeta menos de 10% dos pacientes com taquicardia supraventricular. Quando incessantes, podem gerar taquicardiomiopatia. O sucesso da ablação varia de 75-95% com uma recorrência de 5 a 20% 11-14.
Recomendação A
Nível 2 - Taquicardia atrial sintomática de difícil controle farmacológico; taquicardia atrial com taquicardiomiopatia.
Recomendação B1
Nível 2 - Taquicardia atrial sintomática; taquicardia atrial incessante ou recorrente controlável com antiarrítmicos, quando o paciente opta pelo tratamento não farmacológico.
Recomendação B2
Nível 2 - Taquicardia atrial incessante ou recorrente assintomática e sem evidência de taquicardiomiopatia.
Recomendação C
Nível 4 - Taquicardia atrial de causa transitória e reversível.
Ablação da junção AV
O controle da resposta ventricular em taquiarritmias atriais refratárias ao tratamento é de grande importância, devido à presença de sintomas e o possível desenvolvimento de taquicardiomiopatia. Nos casos em que não se consegue obter a cura da taquiarritmia atrial e o controle adequado da freqüência cardíaca, a ablação da junção atrioventricular e implante de marcapasso é uma alternativa eficaz. Pode haver retorno da condução pela junção em 5%. Em até 3% dos pacientes ocorre morte súbita após a ablação. Na ausência de miocardiopatia, a sobrevida de pacientes com fibrilação atrial submetidos à ablação do nó AV é similar a da população geral 15,16.
Recomendação A
Nível 2 - Taquiarritmias atriais sintomáticas, com desenvolvimento de taquicardiomiopatia ou gerando terapias inapropriadas do CDI, em que os métodos terapêuticos, farmacológicos ou não foram incapazes ou não puderam ser usados para restauração/manutenção do ritmo sinusal ou controle da freqüência ventricular.
Recomendação B2
Nível 3 - Permitir a otimização do intervalo AV em pacientes com estimulação cardíaca artificial.
Recomendação C
Controle da freqüência ventricular com drogas bem toleradas pelo paciente
Ablação da junção AV - O controle da resposta ventricular em taquiarritmias atriais refratárias ao tratamento é de grande importância, devido à presença de sintomas e o possível desenvolvimento de taquicardiomiopatia. Nos casos em que não se consegue obter a cura da taquiarritmia atrial e o controle adequado da freqüência cardíaca, a ablação da junção atrioventricular e implante de marcapasso são alternativas eficazes. Pode haver retorno da condução pela junção em 5%. Em até 3% dos pacientes ocorre morte súbita após a ablação. Na ausência de miocardiopatia, a sobrevida de pacientes com fibrilação atrial submetidos à ablação do nó AV é similar a da população geral 15,16.
Recomendação A
Nível 2 - Taquiarritmias atriais sintomáticas, com desenvolvimento de taquicardiomiopatia ou gerando terapias inapropriadas do CDI, em que os métodos terapêuticos, farmacológicos ou não foram incapazes ou não puderam ser usados para restauração/manutenção do ritmo sinusal ou controle da freqüência ventricular.
Recomendação B2
Nível 3 - Permitir a otimização do intervalo AV em pacientes com estimulação cardíaca artificial.
Recomendação C
Controle da freqüência ventricular com drogas bem toleradas pelo paciente.
Fibrilação atrial - Considerando os riscos potenciais e ainda o curto tempo de acompanhamento dos resultados, a ablação da FA deve ser reservada aos casos sintomáticos, que se apresentam refratários às drogas antiarrítmicas. Os pacientes com maior chance de se beneficiarem da ablação são aqueles com coração estruturalmente normal, que apresentam arritmia supraventricular freqüente ao Holter, sob forma de batimentos repetitivos ou extra-sístoles isoladas freqüentes, alternando com paroxismos de FA de curta duração 17-21.
Até que os resultados a longo prazo da ablação da FA sejam mais bem conhecidos, a ablação por cateter da FA deve ser restrita a centros de referência.
Recomendação B2
Nível 3 - FA paroxística, sintomática e de difícil controle farmacológico, em pacientes com átrio esquerdo normal e na ausência de condições metabólicas potencialmente correlacionadas à arritmia.
Recomendação B2
Nível 4 - FA paroxística e freqüente, de difícil controle farmacológico em pacientes com cardiopatia estrutural.
Recomendação C
Nível 4 - Primeiro episódio de fibrilação atrial; trombo intracardíaco ou contraste atrial espontâneo intenso ao ecocardiograma; contra-indicação a anticoagulação sistêmica; cardiopatia com indicação cirúrgica durante a qual a fibrilação atrial pode ser tratada concomitantemente; doença sistêmica debilitante ou potencialmente correlacionada à arritmia (tireotoxicose, uremia, pericardite, intoxicação alcoólica aguda, doença pulmonar obstrutiva crônica, trombo embolismo pulmonar).
Flutter atrial - O flutter atrial é um circuito macroreentrante que pode ocorrer em ambos os átrios. A forma mais comum de flutter atrial ocorre no átrio direito e depende da condução em torno do anel da valva tricúspide. A criação de uma linha de bloqueio entre o anel da tricúspide e a veia cava inferior (istmo cavotricuspídeo) elevou o índice de sucesso da ablação para 95% com recorrência de 5% 22-28.
Recomendação A
Nível 2 - Flutter atrial comum recorrente com sintomas claramente relacionados à arritmia.
Recomendação B2
Nível 4 - Flutter atrial assintomático; pacientes assintomáticos com flutter e fibrilação atrial com freqüência ventricular controlada.
Taquicardia por reentrada nodal - A taquicardia reentrante nodal (TRN) é a forma mais comum de taquicardia paroxística supraventricular (regular). A TRN geralmente ocorre em pacientes com coração normal apresentando-se como palpitações regulares paroxísticas, associada ou não a síncopes, A ablação por radiofreqüência da via lenta é o tratamento curativo de eleição com sucesso variando de 94 a 99%. As recidivas variam entre 3 a 7%. As complicações mais freqüentes são o bloqueio AV total que, dependendo da série, pode variar de 0,5 a 4%. Complicações como as lesões vasculares, derrame pericárdio, tamponamento cardíaco e morte ocorrem em menos de 0,1% dos pacientes 28-32.
Recomendação A
Nível 2 - Pacientes sintomáticos com TRN recorrentes.
Recomendação B1
Nível 2 - Dupla via nodal com eco nodal, registrado pelo EEF em paciente com documentação eletrocardiográfica; taquicardia sustentada induzida no EEF durante ablação de outra arritmia.
Recomendação B2
Nível 3 - Dupla via nodal com eco nodal, registrado pelo EEF em paciente com suspeita clínica, mas sem documentação eletrocardiográfica.
Recomendação C
Nível 4 - Achado de dupla via nodal com ou sem eco no EEF sem suspeita clinica de TRN.
Síndrome de Wolff-Parkinson-White e outras vias acessórias da condução atrioventricular
Existem diferentes tipos de vias acessórias, que são conexões musculares anômalas entre o átrio e o ventrículo. Uma grande variedade de taquiarritmias pode ocorrer nos pacientes com vias acessórias. Algumas dessas taquicardias são bem toleradas, porém outras podem levar à degeneração hemodinâmica, insuficiência cardíaca e morte súbita 33,34. Na dependência das características eletrofisiológicas da via acessória, a morte súbita pode ocorrer mesmo em pacientes assintomáticos. A ablação por radiofreqüência é a terapia de eleição com sucesso de 89 a 97% na dependência da localização da via. A recorrência da condução pela via acessória, após uma ablação ocorre em aproximadamente 5 a 12% dos casos, e esses pacientes podem ser submetidos a uma nova intervenção sem aumento do risco 35-37.
Embora a mortalidade do procedimento seja de apenas 0,1%, outras complicações relacionadas a localizações específicas, podem ocorrer, como: 1) bloqueio AV total: (0,2-0,6%): geralmente ocorrido nas vias ântero-septais e médio-septais, mas raramente em vias pôstero-septais; 2) infarto agudo (0,06%) do miocárdio por aplicação inadvertida dentro da circunflexa ou por dissecção de uma artéria coronária; 3) perfuração cardíaca e tamponamento (0,1%); 4) acidente vascular encefálico, ou acidentes isquêmicos transitórios (0,1%); 5) lesão valvar mitral ou aórtica (0,15%); 6) complicações arteriais e venosas (0,5%) no local da punção; 7) complicações secundárias à exposição de raioX.
Recomendação A
Nível 2 - Paciente com pré-excitação ventricular que já tenha apresentado um episódio de taquiarritmia.
Taquicardia sustentada mediada por via anômala induzida no EEF durante ablação de outra arritmia.
Recomendação B1
Nível 3 - Assintomático com pré-excitação ventricular e profissões de risco (piloto, motorista profissional de coletivos, etc.); assintomático com período refratário anterógrado da via acessória < 270ms e período refratário ventricular <220ms.
Recomendação B2
Nível 4 - Pré-excitação ventricular assintomática.
Recomendação C
Nível 3 - Pré-excitação ventricular assintomática de baixo risco quando a localização da via acessória estiver associado com risco aumentado de lesão no sistema de condução.
Taquicardia ventricular idiopática - A taquicardia ventricular idiopática ocorre preferencialmente na via de saída do ventrículo direito e próximo ao fascículo póstero-inferior do ramo esquerdo em pacientes com coração estruturalmente normal. Apesar da morte súbita ser rara, esses pacientes são freqüentemente sintomáticos, necessitando de terapia antiarrítmica. Com o advento e o desenvolvimento das técnicas de ablação de focos arritmogênicos com cateter, esses pacientes podem, em situações bem definidas, ser beneficiados com este procedimento. O índice de sucesso da ablação das taquiarritmias ventriculares idiopáticas é cerca de 85%. A recorrência é de aproximadamente 15%. As complicações são incomuns e sua incidência e distribuição não são superiores às relatadas em taquicardias supraventriculares 38,39.
Recomendação A
Nível 2 - Pacientes sintomáticos TVS de VD e de VE refratária ao tratamento medicamentoso ou quando houver intolerância às drogas.
Recomendação B1
Nível 4 - Pacientes sintomáticos com TVNS refratárias ao tratamento medicamentoso, ou quando houver intolerância às drogas.
Recomendação B2
Nível 3 - EV da via de saída de VD de difícil controle medicamentoso; pacientes sintomáticos que não desejam usar medicação.
Recomendação C
Nível 3 - Pacientes assintomáticos com taquicardia monomórfica não sustentada ou extra-sístoles.
Taquicardia ventricular com cardiopatia estrutural - A taquicardia ventricular (TV) ocorre na grande maioria dos casos associada à cardiopatia orgânica, constituindo uma complicação grave que pode levar a óbito. As TVs podem se apresentar clinicamente sob as formas sustentadas (duração maior de 30s ou com manifestações clínicas exigindo sua interrupção imediata) e não sustentadas. O sucesso da ablação por cateter da TV depende em última instância das características do substrato, da tolerabilidade da arritmia induzida e da experiência do grupo responsável pela realização do procedimento. De maneira geral, o sucesso da ablação oscila entre 40 a 80%. Do ponto de vista da relação custo-benefício, o tratamento ablativo, pelo menos quando realizado com cateteres irrigados, é superior a amiodarona 40-44.
Recomendação A
Nível 3 - Taquicardia ventricular incessante; taquicardia ventricular recorrente requerendo terapêuticas freqüentes do CDI; taquicardia ventricular tipo ramo-a-ramo.
Recomendação B1
Nível 2 - Taquicardia ventricular sustentada recorrente bem tolerada sem controle farmacológico.
Recomendação B2
Nível 2 - Taquicardia ventricular sustentada mal tolerada sem controle farmacológico; taquicardia ventricular não sustentada, sintomática, sem controle farmacológico; taquicardia ventricular sustentada recorrente bem tolerada.
Recomendação C
Taquicardia ventricular polimórfica secundária a distúrbios elétricos primários, como a síndrome do QT longo, a síndrome de Brugada, etc. ou aquelas ocorridas durante eventos deflagradores reversíveis, como isquemia miocárdica aguda e distúrbios hidroeletrolíticos; taquicardia ventricular não sustentada assintomática.
Procedimentos especiais
Técnica de punção transeptal - O acesso às câmaras esquerdas do coração pode ser conseguido pela abordagem transaórtica ou retrógrada, que envolve a cateterização do sistema arterial e a passagem do cateter pela valva aórtica, ou pelo método transeptal, que requer a cateterização cardíaca direita e punção do septo interatrial para o posicionamento dos cateteres nas câmaras esquerdas.
A técnica transeptal é eficiente e segura não só para a ablação de vias acessórias, como para outras arritmias esquerdas, e seu uso tem se disseminado, quer como abordagem primária ou como técnica complementar à abordagem transaórtica.
As complicações relacionadas à punção transeptal incluem perfuração de átrio esquerdo e raiz de aorta com hemopericárdio e tamponamento, espasmo coronariano e embolia arterial pelo introdutor. O índice de complicações é 1,3%, incluindo risco de 1,2% de tamponamento e mortalidade de 0,08% 44-46.
Recomendação A
Nível 2 - Arritmias atriais esquerdas; taquicardia AV por via acessória esquerda, na ausência de acesso arterial periférico, na presença de prótese valvar aórtica mecânica e estenose aórtica.
Recomendação B1
Nível 2 - Insuficiência aórtica e doenças da aorta.
Recomendação B2
Nível 2 - Insucesso da técnica transaórtica; crianças com menos de 20 kg; via acessória esquerda.
Recomendação C
Pacientes com deformidade torácica; anticoagulação oral.
Mapeamento e ablação epicárdica
Mapeamento epicárdico transvenoso - O mapeamento epicárdico transvenoso vale-se da ampla distribuição da rede venosa coronariana sobre a superfície do coração. O objetivo do mapeamento transvenoso é estabelecer referências epicárdicas fixas de modo a facilitar o reconhecimento da origem da TV e a provável organização do circuito reentrante. A rede venosa coronariana pode ser explorada em dois níveis: 1) seio coronariano e a grande veia cardíaca que podem ser explorados por cateteres multieletrodos convencionais; 2) veias cardíacas mais periféricas, as quais só podem ser exploradas por microcateteres especiais. A angiografia coronariana retrógrada é necessária nesta situação para definir a anatomia da circulação venosa coronariana. Podem ser introduzidos um ou mais microcateteres em diferentes segmentos venosos 47,48.
Mapeamento epicárdico transtorácico - No mapeamento epicárdico transtorácico, o cateter explorador é introduzido no saco pericárdico através de punção percutânea, como na técnica descrita para drenagem de derrame pericárdico, podendo ser, então, movimentado livremente sobre a superfície de ambos ventrículos. A ablação de circuitos epicárdicos pode ser realizada por esta via 49,50.
O risco de acidente de punção, com hemopericárdico é de 15%-20%, o sangramento geralmente é de pequena magnitude e raramente o procedimento tem que ser interrompido por este motivo. Complicações graves, como lesão de artéria coronária, sangramento necessitando de transfusão ou cirurgia, ocorrem em 3% dos casos.
Recomendação B2
Nível 3 - TVS incessante ou recorrente, sintomática, refratária aos fármacos antiarrítmicos após ablação endocárdica sem sucesso; TVS associada à cardiopatia chagásica, recorrente, sem tentativa prévia de mapeamento e ablação pela via endocárdica.
Recomendação C
TV com origem septal (definida em estudo eletrofisiológico prévio).
Mapeamento e ablação com sistema eletroanatômico - Este sistema é capaz de mapear e reconstruir detalhadamente as cavidades cardíacas de forma tridimensional, além de permitir o mapeamento de ativação e voltagem. O sistema permite a verificação constante da ponta do cateter dentro da cavidade, em tempo real, permitindo o reposicionamento do cateter de ablação com precisão de 0,7mm através da análise de sinais eletromagnéticos sem a necessidade de fluoroscopia 51,52.
Recomendação B1
Nível 3 - Arritmias atriais relacionadas à cicatriz cirúrgica; flutter atrial atípico; fibrilação atrial focal; flutter atrial esquerdo.
Recomendação B2
Nível 3 - Taquicardia atrial focal; taquicardia ventricular; recidiva de outras ablações; taquicardia ventricular hemodinamicamente instável.
Referências
1. Nath S, Redick JA, Whayne JG, Haines DE. Ultra structural observations in the myocardium beyond the region of acute coagulation necrosis following radiofrequency catheter ablation. J Cardiovasc Electrophysiol 1994; 5: 838-45.
2. Nath S, Haines DE. Biophysics and pathology of catheter energy delivery systems. Prog Cardiovasc Dis 1995; 37: 185-204.
3. Grubman E, Pavri BB, Lyle S, Reynolds C, Denofrio D, Kocovic DZ. Histopathologic effects of radiofrequency catheter ablation in previously infarcted human myocardium. J Cardiovasc Electrophysiol 1999; 10: 336-42.
4. Bathina MN, Mickelsen S, Brooks C. Radiofrequency catheter ablation versus medical therapy for initial treatment of supraventricular tachycardia and its impact on quality of life and healthcare costs. Am J Cardiol 1998; 82: 58993.
5. Zipes D, Di Marco J, Gillette P, et al. Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures. J Cardiovasc Electrophysiol 1995; 6: 652-79.
6. Calkins H, Yong P, Miller JM, et al. Catheter ablation of accessory pathways, atrioventricular nodal reentrant tachycardia, and the atrioventricular junction: final results of a prospective, multicenter clinical trial. The Atakr Multicenter Investigators Group. Circulation 1999; 99: 26270.
7. Evans GTJ, Scheinman MM, Zipes DP, et al. The Percutaneous Cardiac Mapping and Ablation Registry: final summary of results. Pacing Clin Electrophysiol.1988; 11: 1621-6.
8. Scheinman MM. NASPE survey on catheter ablation. Pacing Clin Electrophysiol. 1995; 18: 14748.
9. Hindricks G. The Multicentre European Radiofrequency Survey (MERFS): complications of radiofrequency catheter ablation of arrhythmias: the Multicentre European Radiofrequency Survey (MERFS) Investigators of the Working Group on Arrhythmias of the European Society of Cardiology. Eur Heart J 1993; 14: 164453.
10. Lee R, Kalman J, Fitzpatrick A, et al. Radiofrequency catheter modification of the sinus node in a patient with "inappropriate" sinus tachycardia. Circulation 1995; 92: 2919-28.
11. Sanders W, Sorrentino R, Greenfield R, et al. Catheter ablation of sinoatrial reentrant tachycardia. J Am Coll Cardiol 1994; 23: 926-34.
12. Tracy C, Swartz J, Fletcher R, et al. Radiofrequency catheter ablation of ectopic atrial tachycardia using paced activation sequence mapping. J Am Coll Cardiol 1993; 21: 910-17.
13. Pappone C, Stabile G, De Simone A, et al. Role of catheter-induced mechanical trauma in localization of target sites of radiofrequency ablation of automatic atrial tachycardia. J Am Coll Cardiol 1996; 27: 1090-7.
14. Lesh M, Van Hare G, Epstein A, et al. Radiofrequency catheter ablation of atrial arrhythmias. Circulation 1994; 89: 1074-89.
15. Fitzpatrick A, Kouruyan H, Siu A, et al. Quality of life and outcomes after radiofrequency His-bundle catheter ablation and permanent pacemaker implantation: impact of treatment in paroxysmal and established atrial fibrillation. AM Heart J 1996; 131: 499-507.
16. Ozcan C, Jahangir A, Paul A, et al. Long-term survival after ablation of the atrioventricular node and implantation of a permanent pacemaker in patients with atrial fibrillation. N Engl J Med 2001; 344: 1043-51.
17. Jais P, Haissaguerre M, Shah DC, et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation 1997; 95: 572-6.
18. Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339: 659-66.
19. Scanavacca M, Sosa E, D'Avila, et al. Ablação com radiofreqüência da fibrilação atrial paroxística. Arq Brás Cardiol 1999; 72: 693-700.
20. Rocha Neto AC, Farias RL, Paola AAV. Tratamento da fibrilação atrial através da ablação com radiofreqüência utilizando mapeamento multipolar simultâneo das veias pulmonares. Arq Bras Cardiol 2001; 77: 407-17.
21. Mehta N, Távora MZP, Tackeschita N, et al. Características clínicas úteis para seleção do candidato ideal para mapeamento e ablação de fibrilação atrial. Arq Bras Cardiol 2002; 78: 1-8.
22. Poty H, Saoudi N, Nair M, Anselme F, Letac B. Radiofrequency catheter ablation of atrial flutter. Further insights into the various types of isthmus block: application to ablation during sinus rhythm. Circulation 1996 15; 94: 3204-13.
23. Fischer B, Jais P, Shah D, et al. Radiofrequency catheter ablation of common atrial flutter in 200 patients. J Cardiovasc Electrophysiol 1996; 7: 1225-33.
24. Sosa EA, Scanavacca MI, Lewandowski A, et al. Radiofrequency catheter ablation of type I atrial flutter. Arq Bras Cardiol 1994; 63: 191-5.
25. Cruz Filho FE, Fagundes ML, Boghossian S, et al. Ablation therapy of type I atrial flutter with radiofrequency. Arq Bras Cardiol 1995; 64: 323-30.
26. Moreira JM, Alessi SR, Rezende AG, Prudêncio LA, de Paola AA. Catheter ablation of atrial flutter. Electrophysiological characterization of posterior and septal isthmus block. Arq Bras Cardiol 1998; 71: 37-47.
27. Scanavacca M, Sosa E, Velarde JL, et al. Type I atrial flutter radiofrequency ablation. Importance of bidirectional block of isthmus between theinferior vena cava and of tricuspid valve ring. Arq Bras Cardiol 1998; 71: 705-11.
28. Natale A, Newby KH, Pisano E, et al. Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter. J Am Coll Cardiol 2000; 35: 1898-904.
29. Kay GN, Epstein AE, Dailey SM, Plumb VJ. Selective radiofrequency ablation of the slow pathway for the treatment of atrioventricular nodal reentrant tachycardia. Evidence for involvement of perinodal myocardium within the reentrant circuit. Circulation 1992; 85: 1675-88.
30. Haissaguerre M, Gaita F, Fischer B, et al. Elimination of atrioventricular nodal reentrant tachycardia using discrete slow potentials to guide application of radiofrequency energy. Circulation 1992; 85: 2162-75.
31. Jackman WM, Beckman KJ, McClelland JH, et al. Treatment of supraventricular tachycardia due to atrioventricular nodal reentry by radiofrequency catheter ablation of slow pathway conduction. N Eng J Med 1992; 327: 313-8.
32. Silva MA, Scanavacca MI, D'Avila A, et al. Relationship between conduction persistence through the slow pathway after atrioventricular nodal reentry tachycardia radiofrequency ablation and its recurrence. Arq Bras Cardiol 1998; 71: 117-20.
33. Klein GJ, Bashore TM, Sellers TD, Pritchett EL, Smith WM, Gallagher JJ. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. N Engl J Med 1979; 301: 1080-5.
34. Torner PM. On behalf of the European Registry on Sudden Death in the Wolff-Parkinson-White syndrome. Ventricular fibrillation in the Wolff-Parkinson White Syndrome. Pace 1988; 11: 46.
35. Warin JF, Haïsaguerre M, d'Ivernois CH, LeMatayer P, Montserrat P. Catheter ablation of accessory pathways: Technique and results in 248 patients. Pacing Clin Electrophysiol 1990; 13: 1609-14.
36. Jackman WM, Wang XZ, Fryday KJ, et al. Catheter ablation of accessory atrioventricular pathways (Wolff-Parkinson-White syndrome) by radiofrequency current. N Engl J Med 1991; 324: 1605-11.
37. Atié J, Maciel W, Pierobom MA, Andrea E. Radiofrequency ablation in patients with Wolff-Parkinson-White syndrome and other accessory pathways. Arq Bras Cardiol 1996; 66: 29-37.
38. Buxton AE, Waxman HL, Marchlinski FE, et al. Right ventricular tachycardia: clinical and electrophysiologic characteristics. Circulation 1983; 68: 917.
39. Coggins DL, Lee RJ, Sweetney J, et al. Radiofrequency catheter ablation as a cure for idiopathic tachycardia of both left and right ventricular origin. J Am Coll Cardiol 1994; 23: 1333-41.
40. Morady F, Harvey M, Kalbfleisch SJ, El-Atassi R, Calkins H, Lamgberg JJ. Radiofrequency catheter ablation of ventricular tachycardia in patients with coronary artery disease. Circulation 1993; 87: 363-72.
41. Stevenson WG, Khan H, Sager P, et al. Identification of reentry circuit sites during catheter mapping and radiofrequency ablation of VT late after myocardial infarction. Circulation 1993; 88: 1647-70.
42. Gonska BD, Cao K, Schaumann A, Dorszewski A, von zur Mühlen F, Kreuzer H. Catheter ablation of ventricular tachycardia in 136 patients with coronary artery disease: results and long-term follow-up. J Am Coll Cardiol 1994; 24: 1506-14.
43. Wilber D, Kall J, Kopp D, et al. Catheter ablation of the mitral isthmus for ventricular tachycardia associated with inferior infarction. Circulation 1995; 92: 3481-9.
44. Kottkamp H, Hindricks G, Chen X, et al. Radiofrequency catheter ablation of sustained ventricular tachycardia in idiopathic dilated cardiomyopathy. Circulation 1995; 92: 1159-68.
45. Roelke M. The technique and safety of Transeptal left heart catheterization: the Massachusetts General Hospital experience with 1279 procedures. Cathet Cardiovasc Diagn 1994; 32: 332-9.
46. De Ponti R, Zardini M. Trans-septal catheterization for radiofrequency catheter ablation of cardiac arrhythmias. Eur Heart J 1998; 19: 943-50.
47. Arruda M, Chandrasekaran K, Reynolds D, Kugelmass A, Lazzara R, Jackman W. Idiopathic epicardial outflow tract ventricular tachycardia: implications for RF catheter ablation. PACE 1996; 19: 611, Abstract 183.
48. de Paola AA, Melo WD, Távora MZ, Martinez EE. Angiographic and electrophysiological substrates for ventricular tachycardia mapping through the coronary veins. Heart 1998; 79: 59-63.
49. Sosa E, Scanavacca M, D'Avila A, Pileggi F. A new technique to perform epicardial mapping in the electrophysiology laboratory. J Cardiovasc Electrophysiol 1996; 7: 531-6.
50. Sosa E, Scanavacca M, d'Avila A, Oliveira F, Ramires JAF. Nonsurgical transthoracic epicardial catheter ablation to treat recurrent ventricular tachycardia occurring late after myocardial infarction. J Am Coll Cardiol 2000; 35: 1442-9.
51. Gepstein L, Evans SJ. Electroanatomical mapping of the heart: Basic concepts and implications for the treatment of cardiac arrhythmias. Pace 1998; 21: 1268-78.
52. Charles C, Gornick , Stuart W, et al. Validation of a new noncontact catheter system for electroanatomic mapping of left vantricular endocardium. Circulation 1999; 99: 829-35.
Parte V
Estimulação Cardíaca Artificial
Características do centro de implante de marcapasso
Um centro de implante de marcapasso definitivo deve contar com recursos materiais indispensáveis à integridade e segurança do paciente e dos profissionais envolvidos 1,2.
Recursos hospitalares
Desde que o procedimento seja realizado com segurança e sob condições adequadas não deve haver influência sobre os resultados. Os locais destinados ao implante de marcapasso podem ser: a) sala nas instalações de um centro cirúrgico; b) sala no laboratório de hemodinâmica; c) sala designada especialmente para esse fim. A sala deve ter dimensões, iluminação e ventilação adequadas e lavatórios para anti-sepsia. Deve dispor de tomadas elétricas com voltagem de 110 e 220V, adequadamente aterradas para impedir interferências eletromagnéticas.
Equipamentos necessários
O requisito primordial para o laboratório de marcapasso deve ser um intensificador de imagem (fluoroscopia) portátil ou fixo com mobilidade para vizibilização de áreas de interesse (pescoço ao abdome).
A monitoração continua eletrocardiográfica é imprescindível. A pressão arterial e o oxímetro de pulso são benéficos, porém prescindíveis.
Também são consideradas presenças indispensáveis na sala: a) cardioversor-desfibrilador com suporte de marcapasso externo transtorácico; b) material cirúrgico de suporte correspondente a procedimento de pequeno ou médio porte (eletrocautério é opcional); c) analisador de marcapasso e acesso ao programador; d) suporte para emergências e complicações.
Recursos humanos
Deve ser composto por: a) médico responsável pelo procedimento do implante especialista ou habilitado pelo DECA ou órgão competente afim; b) médico auxiliar; c) instrumentadora com treinamento na área; d) atendente de sala para disponibilizar o material cirúrgico e drogas; e) assessor técnico, independente do fabricante.
Avaliação clínica mínima antes do implante
A abordagem inicial antes do implante deve constar de: avaliação clínica; eletrocardiograma de repouso; radiografia de tórax; exames laboratoriais (hemograma, coagulograma, urina I e bioquímica básica). O ecocardiograma está indicado quando a condição clínica justificar.
Imediatamente antes do implante deve-se programar jejum de 6h, tricotomia e antisepsia do local. A antibioticoterapia profilática é controversa. Geralmente, é indicada nos casos complexos, reoperações e para pacientes com baixa resistência.
Características do procedimento de implante
Monitoração - A monitoração eletrocardiográfica contínua é fundamental. A monitoração contínua da pressão arterial e oximetria são necessárias apenas em condições clínicas específicas.
Sedação, anestesia local e geral - A decisão de aplicação de anestesia geral ou sedação deve ser tomada de acordo com o caso, conforme decisão médica.
Acessos para implante - A escolha do acesso para implante de marcapasso deve considerar o local de implante do gerador e o tipo de abordagem venosa para a introdução dos cabos-eletrodos. Deve-se levar em conta as características do paciente, tais como: utilização recente de marcapasso provisório, cateter de infusão venosa central, cirurgias prévias, infecções de pele e outros. A região da bolsa do gerador deve ser peitoral ou abdominal e o acesso venoso deve ser, preferencialmente, por punção de veia subclávia ou a dissecção da veia cefálica, utilizando-se como alternativas a via jugular, femoral, axilar ou epicárdica.
Características dos sistemas de estimulação
a) cabos-eletrodos: a opção por cabos-eletrodos de fixação ativa ou passiva, tanto para a posição atrial ou ventricular, deve considerar a relação custo-benefício para cada caso. Sempre que possível, deve-se preferir a fixação passiva por apresentar maiores opções, além de proporcionar menores limiares de estimulação. Por outro lado, cabos-eletrodos de fixação ativa são imprescindíveis quando o deslocamento é previsível. O número de cabos pode variar de um a quatro e os parâmetros considerados fundamentais durante o procedimento devem incluir; limiares de estimulação e sensibilidade e impedâncias;
b) geradores:podem ser unicamerais, bicamerais ou específicos para estimulação multi-sítio. A opção por biosensores incorporados com funções diversas deve ser sempre considerada e do ponto de vista tecnológico é fundamental que sejam dotados de funções diagnósticas e de monitoração eletrocardiográfica.
Relatório mínimo do implante
Deve incluir identificação do paciente, o ato operatório, dados técnicos do dispositivo, que deve servir de documento para troca do aparelho (garantia ou recall).
Essas informações devem ser veiculadas através do Registro Brasileiro de Marcapassos, documento do Ministério da Saúde que há alguns anos tem sido gerenciado pelo Departamento de Estimulação Cardíaca Artificial.
Pós-operatório
Período de internação - Para implante ou troca de marcapasso, o paciente deve permanecer em ambiente hospitalar por pelo menos 24h. Esse período pode estender-se por alguns dias dependendo da gravidade do caso ou complicações.
Avaliação mínima no pós-operatório - Após o implante do marcapasso deverão ser realizadas: avaliação clínica, radiografia de tórax, eletrocardiograma, avaliação eletrônica do marcapasso e programação de alta conforme abaixo descrito.
Programação do marcapasso - A programação de alta após o implante deve respeitar dois princípios fundamentais: 1) segurança: energia de saída com margens calculadas conforme limiar de estimulação; 2) longevidade prolongada: freqüência de estimulação e energia de saída limítrofe; 3) otimização hemodinâmica: dirigida por parâmetros funcionais.
Riscos e complicações esperadas - Podem estar relacionadas à via de acesso cirúrgico, ao posicionamento dos eletrodos ou às disfunções do gerador. As mais comuns são: pneumotórax ou hemotórax; hematoma por punção arterial; perda de comando; deslocamento do eletrodo; problemas na bolsa do gerador; infecção; arritmias.
Seguimento dos pacientes após o implante do marcapasso
Avaliação clínica e eletrônica
No momento da alta hospitalar, o paciente deve receber um relatório médico com os achados cirúrgicos e os dados referentes ao sistema de estimulação cardíaca implantado.
Um cartão do registro do gerador e cabos-eletrodos será entregue ao paciente que deverá portá-lo sempre, em qualquer circunstância. Os cuidados pós-operatórios e as informações relativas ao MP devem ser oferecidos pelo médico que realizou o implante.
As clínicas de avaliação de MP devem, de preferência, estar instaladas no próprio hospital ou incorporadas ao consultório médico. A periodicidadedas avaliações deve ser a seguinte: alta hospitalar, 30 dias pós-implante, a cada 3 ou 6 meses, dependendo do tipo de estimulação, ou quando necessário por intercorrências.
A avaliação clínica básica deve constar deconsulta específica, ECG de repouso e os seguintes exames complementares: eco-Doppler, Holter 24h e teste ergométrico.
A avaliação eletrônica do MPdeve objetivar a análisedo estado da bateria, limiares de estimulação e sensibilidade, impedâncias e recuperação e análise de eventos armazenados. A programação do MPenvolve a escolha do modo de estimulação além da determinação da energia de saída, da margem de sensibilidade, do ajuste de sensores e dos intervalos básicos e funcionais.
Indicações de implante de marcapasso definitivo
O estabelecimento de critérios ou normas consensuais na tentativa de uniformizar ao máximo as indicações de implante de marcapassos tem demonstrado significativa contribuição na constante busca da melhor relação custo-benefício deste procedimento.
Documentos publicados através de entidades representativas da especialidade em nosso meio, nos EUA e Europa estabeleceram há alguns anos, e atualizam, periodicamente, as diretrizes relativas às indicações consideradas clássicas ou convencionais: doença do nó sinusal, bloqueio átrio/interventricular e hipersensibilidade do seio carotídeo. Recentemente, esse espectro foi ampliado e inúmeras outras morbidades foram incluídas, como passíveis de terapêutica por estimulação cardíaca artificial. Algumas dessas indicações apontam auspiciosas contribuições e outras carecem de melhor avaliação para conclusões definitivas.
Essas diretrizes irão abordar todas as condições que indicam o implante de marcapasso definitivo, incluindo a atualização sobre as entidades clínicas clássicas assim como considerações específicas acerca da relação custo-benefício que envolve as indicações mais recentes.
A) Doença do nó sinusal
Disfunção do nó sinusal caracteriza-se pelo espectro de distúrbios eletrocardiográficos e eletrofisiológicos que envolvem o nódulo sino-atrial e suas conexões 3. A associação de sintomas correlacionados a esses distúrbios é denominada doença do nó sinusal (DNS).
A DNS atinge mais freqüentemente as mulheres, com maior morbidade entre 60 e 69 anos 4-6. A forma primária da DNS, no entanto, pode ocorrer também em indivíduos mais jovens (<40 anos) e mesmo em crianças 7. Existe predisposição hereditária, de aparente caráter autossômico dominante 8-10. A literatura demonstra que em apenas 2% dos casos de DNS que acometem o jovem indica-se implante de marcapasso definitivo 11,12. A forma mais comum da doença não tem etiologia definida, sendo considerada idiopática ou primária 13,14 e a forma secundária está associada a algumas doenças cardíacas. A cardiopatia chagásica é a mais freqüente entre nós 15,16 e, nos EUA, a mais comum é a cardiopatia isquêmica 17. Doenças degenerativas, como amiloidose 18 e hemocromatose 19; doenças inflamatórias, como difteria, miocardite, pericardite e doença reumática; desordem neuro musculares e endócrinas e outras também podem se associar a DNS. O diagnóstico da doença é essencialmente eletrocardiográfico 20,25 e o Holter de 24h, permite correlacionar o ECG às manifestações clínicas 26. A evolução natural inclui a incidência da fibrilação atrial e o acometimento do sistema de condução (intra e atrioventricular).
Sutton e Kenny, em revisão de 1.395 casos, seguimento médio de 47 meses, documentaram incidência de BAV de 8,4% em pacientes com DNS 27. Um estudo envolvendo 1.171 pacientes demonstrou 15,8% de incidência de FA, em seguimento médio de 44 meses 28.
A taxa de sobrevida dos portadores de DNS é de 85 a 92% em um ano; 73 a 79% em 3 anos, 62 a 65% em 5 anos e 52% em 7 anos 29,30. A abordagem farmacológica para o tratamento da DNS tem sido desanimadora. Drogas do tipo atropina e sublinguais beta-adrenérgicos apresentam curta duração, efeitos adversos insuportáveis e absorção irregular 31,32.
Assim, o MP definitivo é considerado primeira escolha na terapêutica da DNS 33 e diversos estudos demonstraram que o modo VVI proporciona altas taxas de complicações, como FA, tromboembolismo e insuficiência cardíaca 34-37. Por outro lado, os modos AAI, C/R e DDD, C/R interferem, favoravelmente, na história natural da DNS; melhoram ou eliminam sintomas 38 e reduzem a incidência de FA (9% em modo AAI x 69% em VVI) 39, assim como de eventos tromboembólicos (1,6% em modo AAI,C x 13% em VVI) 40,41.
A DNS é, portanto, uma entidade nosológica de elevada prevalência nos EUA e relacionada, em nosso meio, à doença de Chagas e à senilidade. O tratamento mais efetivo é o implante de MP, modos AAI, C/R ou DDD, C/R, que embora não proporcione aumento da sobrevida, melhora a qualidade de vida.
Recomendações para implante de marcapasso definitivo na DNS
Grau A - DNS espontânea, irreversível ou induzida por fármacos necessários e insubstituíveis, com sintomas de síncopes, pré-síncopes ou tonturas e/ou IC relacionados à bradicardia (NE 2); síndrome bradi-taqui (NE 3); com intolerância aos esforços claramente relacionada à incompetência cronotrópica (NE 4).
Grau B - B1- irreversível ou induzida por fármacos necessários e insubstituíveis, com sintomas de síncopes, pré-síncopes ou tonturas não claramente relacionadas com a bradicardia, afastadas outras causas para os sintomas (NE 2); B1- bradiarritmia sinusal que desencadeia ou agrava IC, angina do peito ou taquiarritmias (NE = 4).
Grau C - Em pacientes assintomáticos; com sintomas comprovadamente independentes da bradicardia.
Recomendações para o modo de estimulação
Grau A - AAIC/R; DDDC/R.
Grau B - VVIC/R sem condução retrógrada.
Grau C - VVIC/R com condução retrógrada; VDDC/R.
Recomendações para o uso de sensores
Grau A Nenhuma.
Grau B - Volume minuto, movimento, contratilidade miocárdica respeitando-se os limites da cardiopatia, doenças associadas e estilo de vida; duplo sensor.
Grau C - Sensores rápidos para ICO e CMH.
B) Bloqueio atrioventricular
O bloqueio atrioventricular (BAV) é definido como um distúrbio da condução do impulso elétrico, que ocorre entre a despolarização atrial e a ventricular, devendo ser distinguido do fenômeno de refratariedade fisiológico (propriedade intrínseca das células do sistema de condução) 42. É uma entidade clinica descrita há séculos, caracterizada por uma variedade de condições e processos patológicos que, do ponto de vista anatômico, pode ter localização atrial, nodal AV ou no sistema His Purkinje. A abordagem clínica dos bloqueios AV consiste na avaliação de seu caráter reversível, quando desaparece com a eliminação de sua causa (isquemia, drogas depressoras do sistema de condução) e, por outro lado, irreversível, quando determinado por disfunção definitiva do sistema de condução. O bloqueio AV pode ser intermitente, quando se manifesta de modo paroxístico e sem relação com qualquer causa removível. Ao contrário, quando está sempre presente é considerado permanente. Também se pode apresentar de forma aguda ou crônica. A mais difundida e consagrada classificação para os bloqueios atrioventriculares é a eletrocardiográfica, que agrupa em: BAV 1º, 2º (tipo I ou II) ou 3º grau. Outras classificações, como por exemplo, a etiológica (congênito ou adquirido), eletrofisiológica (supra-hissiana, hissiana e infra-hissiana), também são utilizadas, sobretudo para estabelecer o prognóstico clínico 43,47. O marcapasso definitivo representa a primordial abordagem terapêutica do BAV. Nesse sentido, inúmeros estudos demonstraram as vantagens clínicas e hemodinâmicas da estimulação cardíaca artificial, assim como o papel do modo de estimulação 48-55.
Recomendações para implante de marcapasso definitivo em pacientes com bloqueio atrioventricular
BAV 1º Grau
Grau A - Nenhuma.
Grau B - B1 irreversível, com síncopes, pré-síncopes ou tonturas, de localização intra ou infra-His com agravamento por estimulação atrial ou teste farmacológico (NE 3); B2 sintomas conseqüentes à falta de sincronismo AV (NE 3).
Grau C - Assintomático (NE 4).
BAV 2º Grau
Grau A - Permanente ou intermitente, irreversível ou causado por drogas necessárias e insubstituíveis, independentemente do tipo e localização, com sintomas definidos de baixo fluxo cerebral e/ou IC conseqüentes a bradicardia (NE 3); tipo II, com QRS largo ou infra-His, assintomático, permanente ou intermitente e irreversível (NE 3); flutterou FA, com períodos de resposta ventricular baixa, em pacientes com sintomas definidos de baixo fluxo cerebral e/ou IC conseqüentes a bradicardia (NE 3).
Grau B - Avançado, adquirido, assintomático, permanente ou intermitente e irreversível (N 3); tipo II, com QRS estreito, assintomático, permanente ou intermitente e irreversível (NE 3); 2:1, assintomático, permanente ou intermitente e irreversível (NE 3); 2:1, com QRS estreito, assintomático, persistente após 15 dias de cirurgia cardíaca ou IAM (NE 3); irreversível, assintomático, associado a arritmias ventriculares que necessitam de tratamento com fármacos insubstituíveis, depressores da condução AV (NE 4); flutter ou FA, assintomático, com freqüência ventricular média <40bpm em vigília, irreversível ou por uso de fármaco necessário e insubstituível (NE 4).
Grau C - Tipo I, assintomático, com normalização da condução AV com exercício e/ou atropina intravenosa (N 3).
BAVT
Grau A - Permanente ou intermitente, irreversível, de qualquer etiologia ou local, com sintomas de hipofluxo cerebral e/ou IC conseqüentes a bradicardia (NE 3); assintomático, conseqüente a IAM, persistente >15 dias (NE 3); assintomático, após cirurgia cardíaca, persistente >15 dias, QRS largo (NE 3); assintomático, irreversível, intra/infra-His, ou ritmo de escape infra-His (NE 3); assintomático, irreversível, QRS estreito, com indicação de antiarrítmicos depressores do ritmo de escape (NE 4); adquirido, irreversível, assintomático, com FC média <40bpm na vigília e sem resposta adequada ao exercício (NE 4); irreversível, assintomático, com assistolia >3s na vigília (NE 4); irreversível, assintomático, com cardiomegalia progressiva (NE 4); congênito, assintomático, com ritmo de escape de QRS largo ou com FC inadequada para a idade (NE 3); adquirido, assintomático, de etiologia chagásica ou esclerodegenerativa (NE 3); irreversível, permanente ou intermitente, conseqüente à ablação da junção atrioventricular (NE 3).
Grau B - B1 conseqüente à cirurgia cardíaca, assintomático, persistente >15 dias, com QRS estreito ou ritmo de escape nodal e boa resposta cronotrópica (NE 3); B1 conseqüente à cirurgia cardíaca sem perspectiva de reversão antes de 15 dias (NE 4); B1 congênito assintomático, com QRS estreito, má resposta cronotrópica, sem cardiomegalia, com arritmia ou QT longo (NE 3); B2 congênito, com QRS estreito, boa resposta cronotrópica, sem cardiomegalia, com arritmia ou QT longo (NE 3).
Grau C - Congênito, assintomático, QRS estreito, com aceleração adequada ao exercício e sem cardiomegalia, arritmia ou QT longo (NE 3); transitório por ação medicamentosa, processo inflamatório agudo, cirurgia cardíaca, ablação ou outra causa reversível (NE 3).
Escolha do modo de estimulação
Grau A - DDDC/R átrio estável; VDDC átrio estável com função sinusal normal; VVIC/R com fibrilação atrial permanente.
Grau B - DDDC/R átrio instável; VVIC/R sem condução retrograda.
Grau C - AAIC/R; VVIC/R com condução retrograda.
C) Bloqueio intraventricular
A prevalência dos bloqueios intraventriculares em indivíduos normais é baixa. Na presença de cardiopatia ou sintomas de baixo fluxo cerebral o prognóstico é pior e pode estar relacionado com maior incidência de BAVT e morte súbita. Dependendo da situação clínica, a indicação de marcapasso exige investigação criteriosa.
Grau A - Bloqueio de ramo alternante com síncopes, pré-síncopes ou tonturas recorrentes (NE 3).
Grau B - Intervalo HV ³70ms ou com bloqueio intra ou infra-His induzido por estimulação atrial e/ou teste farmacológico, em pacientes com síncopes, pré-síncopes ou tonturas sem causa determinada (NE 4); pacientes assintomáticos com intervalo HV ³100ms (NE 3); bloqueio bifascicular, associado ou não a BAV de 1º grau, com episódios sincopais sem documentação de BAVT paroxístico, e afastadas outras causas dos sintomas (NE 4); bloqueio de ramo alternante, assintomático (NE 3).
Grau C - Bloqueios uni ou bifasciculares assintomáticos, de qualquer etiologia (NE 3).
Escolha do modo de estimulação
Grau A - DDDC/R átrio estável; VDDC átrio estável sem com função sinusal normal; VVIC/R com fibrilação atrial permanente.
Grau B - DDDC/R átrio instável; VVIC/R sem condução retrógrada.
Grau C - AAIC/R; VVIC/R com condução retrógrada.
D) Fibrilação atrial paroxística
Embora a indicação de marcapasso em pacientes com fibrilação atrial paroxística ainda permaneça controversa, alguns pequenos estudos sugerem que a estimulação atrial pode melhorar sintomas, reduzir número de episódios de FA e a necessidade do uso de drogas antiarrítmicas e antitrombóticas 56-59.
As vantagens do marcapasso atrial ou atrioventricular sobre o ventricular na redução da incidência de FA nos pacientes com DNS estão bem estabelecidas 60-62. Esses resultados, baseados apenas em estudos retrospectivos, estão relacionados às vantagens hemodinâmicas da estimulação crônica sincronizada. Sparks e cols., demonstraram que a estimulação atrial a longo prazo promove o remodelamento atrial, um importante componente na eletrogênese da FA 63. Estudos randomizados, entretanto, são necessários para que esses achados sejam confirmados e considerados definitivos 64-67.
Pequenos estudos não-randomizados, sugerem que a estimulação multi-sítio pode ser útil em pacientes com FA paroxística e importante distúrbio de condução interatrial 56,57,68.
Recomendações de marcapasso para profilaxia da FA paroxística
Grau A - Nenhuma.
Grau B - B1- recorrente, com qualquer cardiomiopatia, de causas não reversíveis refratária à medicação, comprovadamente relacionada a bradicardia (NE=3); B2- recorrente, com qualquer cardiomiopatia, de causa não reversível, refratária às drogas antiarrítmicas e à ablação do foco arritmogênico, não relacionada à bradicardia, mas com comprovação de atraso de condução atrial por EEF ou ECGAr (NE=3).
Grau C - Responsiva a terapêutica clínica e/ ou ablação; associada a causas reversíveis.
Modo de Estimulação
Grau A - Nenhum.
Grau B - B1 FE elevada (>70ppm) (Nível 3): AAIR (ausência de DCAV); DDDR - IAV longo; B1 FE elevada (>70) (Nível 3): biatrial (presença de DCAV); biatrial Ventricular - IAV longo; DDDR programação overpace.
Grau C - VVIC/R.
E) Cardiomiopatia hipertrófica obstrutiva
O marcapasso é uma das alternativas terapêuticas não-farmacológicas da cardiomiopatia hipertrófica obstrutiva. Está indicado nos casos refratários ao tratamento medicamentoso (betabloqueadores, bloqueadores de canal de cálcio, etc.). A estimulação artificial atrioventricular, modo DDD, com cabos-eletrodos posicionados, respectivamente, no apêndice atrial e ponta do ventrículo direito é capaz de diminuir o gradiente intraventricular. O resultado clínico tem sido muito discutido, sendo considerado tempo-dependente 69-72.
Os objetivos primordiais do tratamento da cardiomiopatia hipertrófica (CMH) são alívio dos sintomas e prevenção de morte súbita. Para tal, as opções farmacológicas disponíveis são os betabloqueadores, bloqueadores dos canais de cálcio, amiodarona e a disopiramida. As alternativas terapêuticas não-farmacológicas são miotomia, alcoolização seletiva de artéria septal e a estimulação cardíaca artificial. Esta tem sido indicada através de marcapasso definitivo (MPD) atrioventricular, modo DDD em pacientes sintomáticos, refratários ao tratamento farmacológico, com importante gradiente na via de saída do ventrículo esquerdo (VE) 73.
As primeiras observações sobre a estimulação cardíaca artificial na CMH foram realizadas na década de 70. Em 1975, Johnson e Daily descreveram um caso de estenose subaórtica hipertrófica que desenvolveu bloqueio atrioventricular total 74.Surpreendentemente, após o implante de MPD, ocorreu melhora dos sintomas relacionados à doença de base. Nessa mesma época, foram descritas, na Europa, várias evidências de redução gradiente na via de saída do VE correspondente à melhora subjetiva de sintomas, com o uso de estimulação ventricular deflagrada por onda P e intervalo AV curto 75.
A partir dessas observações iniciais, muitos estudos contribuíram para a compreensão dos possíveis fatores interativos do MPD com a CMHO, considerando os aspectos fisiopatológicos. Entretanto, o verdadeiro papel terapêutico do MPD ainda está sendo avaliado através de estudos randomizados.
A estimulação com um cabo-eletrodo posicionado na ponta do ventrículo direito (VD) determina uma bizarra seqüência de ativação contrátil dos ventrículos, porque tem orientação de baixo para cima e da direita para a esquerda. Ocorre movimentação paradoxal do septo interventricular, que se afasta da parede posterior do ventrículo esquerdo durante a sístole, aumentando o diâmetro da câmara ventricular e reduzindo o gradiente em sua via de saída.
A redução do gradiente pressórico pode ser observada ainda nos primeiros instantes de estimulação artificial, porém reduções ainda mais importantes podem ocorrer na fase tardia. Sakai e cols. 76 estudaram 14 casos de CMHO com gradiente médio de 106mmHg que, após implante de marcapasso provisório, apresentaram redução do gradiente para valores médios de 62mmHg. Marcapasso definitivo atrioventricular modo DDD, foi implantado em 11 pacientes resultando em um gradiente médio de 17mmHg após um ano de seguimento. Por outro lado, a descontinuação da estimulação ventricular (reprogramação para modo AAI) determinou retorno do gradiente aos níveis próximos dos basais em poucas semanas 77. Estas observações têm implicações clínicas importantes, uma vez que o gradiente basal tem sido utilizado como parâmetro de indicação do MPD, e o gradiente pós-implante, como preditor de resposta terapêutica. Em pacientes com a forma não-obstrutiva da doença, ou com gradiente <30mmHg não se observou melhora hemodinâmica objetiva 78.
Estudos recentes randomizados como o M-PATCHY e estudo PIC, não demonstraram vantagens clinicas do uso de marcapasso DDD em portadores de CMHO refratária a tratamento clínico, entretanto, revelaram redução evidente do gradiente na via de saída do VE 79,80.
O marcapasso modo DDD é, portanto, uma opção terapêutica para um grupo restrito de pacientes. Os portadores de CMHO refratária ao tratamento clínico com gradiente na via de saída do VE >30mmHg em repouso ou >55mmHg (teste provocativo) são candidatos a esse tratamento alternativo. O benefício clínico é tempo-dependente, tendendo a ser mais expressivo, ao final de um ano.
Recomendações de marcapasso em pacientes com CMHO
Grau A - Nenhuma.
Grau B1- Nenhuma.
Grau B2 - Pacientes sintomáticos, com gradiente médio (Eco) de repouso ³30 ou ³55mmHg (teste provocativo) refratários ao tratamento farmacológico, quando não houver indicação primária de CDI (NE 3).
Recomendação C - Pacientes com a forma não-obstrutiva (NE 3); pacientes assintomáticos ou controlados por terapêutica farmacológica (NE 3); pacientes com indicação de CDI (NE 3).
Modo de estimulação
Grau A - DDD,C/R - IAV pré-excitação máxima (NE 3); VVI, C/R- FA permanente.
Grau B Nenhuma.
Grau C - AAIC/R ou VVIC/R em ritmo sinusal.
A otimização da programação por ECO, TE ou HOLTER deve-se basear nas seguintes recomendações:
Grau A - Ecocardiograma IAV semestral.
Grau B - TE/ Holter avaliação de captura.
Grau C - Nenhuma.
F) Síndromes neuromediadas
O coração e os vasos sangüíneos recebem grandes contingentes de fibras eferentes simpáticas e parassimpáticas do centro vasomotor. Em situações especiais, uma grande variedade de estímulos, originados nos pressorreceptores, no sistema nervoso visceral ou periférico ou mesmo no córtex cerebral atinge o sistema cardiovascular pelas vias eferentes do centro vasomotor. Trata-se de uma resposta reflexa, predominantemente parassimpática, resultando em tonturas, pré-síncope e síncope, caracterizando as síndromes neuro-mediadas 81. O quadro clínico decorre de uma redução súbita do fluxo sangüíneo cerebral em conseqüência de uma vasodilatação (forma vasodepressora), de uma bradicardia severa ou assistolia (forma cardioinibitória) ou pela associação das duas respostas (forma mista) 82. A síncope neurocardiogênica 83, a síndrome do seio carotídeo 84 e as síncopes situacionais 85,86 são os principais exemplos das síndromes neuromediadas, em ordem decrescente de freqüência. O marcapasso cardíaco, eficaz no tratamento das formas cardioinibitórias, tem sua eficácia questionável na medida em que predomina a vasodilatação. Não obstante, diversos marcapassos modernos apresentam programas especiais, que aumentam a freqüência cardíaca, de forma automática e transitória, acima dos valores normais, permitindo compensar a vasodilatação de forma a reduzir a sintomatologia.
Síncope neurocardiogênica
Também conhecida como síncope vasovagal, é uma das formas mais freqüentes de síncope. Sua incidência é maior em pacientes jovens, do sexo feminino. Apesar de ter bom prognóstico, mesmo sem tratamento, a síncope neurocardiogênica traz o indesejável risco de acidentes e de queda com eventuais traumatismos, insegurança e a inaptidão para realizar atividades de risco pessoal ou coletivo 81. A fisiopatologia ainda é complexa e ainda não totalmente esclarecida, mas o mecanismo principal parece ser de origem reflexa 87. As condições que favorecem seu aparecimento são: redução do retorno venoso, aumento do tônus simpático, aumento da contratilidade miocárdica, baixa resistência periférica 88. A associação destes fatores favorece o estímulo dos mecanorreceptores intra-miocárdicos, que deflagram a reação reflexa caracterizada por acentuada resposta vagal e redução do tônus simpático. O resultado é uma vasodilatação periférica, freqüentemente, associada a bradicardia ou assistolia. Conseqüentemente, ocorre hipotensão arterial que pode ser suficientemente severa a ponto de ocasionar redução crítica do fluxo cerebral e perda súbita da consciência.
Tipicamente a reação é autolimitada. Na maior parte dos casos, o colapso hemodinâmico ocorre por vasodilatação associada a bradicardia (forma mista). As outras formas de apresentação são somente vasodilatação (forma vasodepressora) e vasodilatação associada a assistolia (forma cardioinibitória). O diagnóstico é realizado através do teste de inclinação 89. A maioria dos casos responde a medidas dietéticas e a tratamento farmacológico (betabloqueadores, midodrine, mineralocorticóide, inibidores da recaptação da serotonina), entretanto foi demonstrado que uma parcela dos casos de síncope neurocardiogência, especialmente a cardioinibitória, pode beneficiar-se da estimulação cardíaca artificial 90,91.
Diversos estudos estão avaliando o seu papel no tratamento da síncope neurocardiogênica: o North American Vasovagal Pacemaker Study 92 1 e 2 (VPS-1, VPS-2), e o Syncope: Diagnosis and Treatment Study (SYDIT). O VPS-1 já foi concluído e mostrou uma redução de 85% no risco relativo de síncope com o uso de marcapasso com função rate drop response, quando comparado à ausência de tratamento em pacientes com pelo menos seis episódios de síncope prévios e bradicardia relativa ao teste de inclinação. O Vasovagal Syncope International Study (VASIS) 93 demonstrou benefício do marcapasso DDI em um grupo de pacientes com síncopes recorrentes e a forma cardioinibitória ao teste de inclinação. A estimulação com função rate-drop-response está sendo investigada pelos estudos VPS-2 e SY DIT. Permite que o marcapasso detecte não somente a queda da freqüência cardíaca mas, principalmente, a velocidade dessa queda, e responda com um aumento na freqüência de estimulação, que, além de prevenir a bradicardia, supostamente poderia compensar parte da hipotensão decorrente da vasodilatação 94.
Até o momento, a indicação de marcapasso para portadores de síncope neurocardiogênica baseia-se nas recomendações abaixo:
Recomendação A - Nenhuma.
Recomendação B1 - Nenhuma.
Recomendação B2 - Síncope associada a importante componente cardioinibitório, documentado por teste de inclinação (tilt-test), claramente refratária ao tratamento farmacológico (NE 3).
Recomendação C - Boa resposta ao tratamento clínico.
Síndrome do seio carotídeo
Esta condição é semelhante à síncope neurocardiogênica, porém acomete pessoas mais idosas que apresentam, freqüentemente, comprometimento esclero-degenerativo do sistema cardiovascular. O paciente idoso que tem síncopes relacionadas a certos movimentos do pescoço constitui o exemplo mais típico deste grupo. O diagnóstico pode ser facilmente realizado através da manobra de massagem do seio carotídeo. A indução de pausas >3s, seja por bloqueio AV ou por parada sinusal, é considerada diagnóstica. Pausas menores estão dentro dos limites da normalidade. Também, de forma análoga, existem as formas cardioinibitória (bradicardia), vasodepressora (vasodilatação) e mista (associação de assistolia com vasodilatação). Apesar do diagnóstico ser realizado de forma fácil é fundamental que seja confirmada a relação entre a bradicardia e os sintomas, pois pausas ou bradicardia sem significado clínico, podem ser facilmente induzidas pela massagem do seio carotídeo em pacientes idosos ou que estão em uso de digital, betabloqueadores, etc. O implante de marcapasso é atualmente o tratamento mais eficaz para eliminar os sintomas da síndrome do seio carotídeo, nos casos onde existe componente cardioinibidor 27. O componente vasodepressor deve ser avaliado e, se possível, quantificado, em cada caso, para que a programação do marcapasso e o tratamento clínico coadjuvante sejam corretamente ajustados. O estudo Syncope and Falls in the Elderly-Pacing and Carotid Sinus Evaluation 2 (SAFE PACE 2) 28 está em andamento, avaliando o benefício do marcapasso em idosos com quedas recorrentes de origem indeterminada e manobra vagal positiva.
A indicação de marcapasso para portadores de síndrome do seio carotídeo hipersensível baseia-se nas recomendações abaixo:
Recomendação A - Síncope recorrente originada por condições que envolvem situações cotidianas que estimulam o seio carotídeo em pacientes com assistolia >3s por MSC na ausência de medicamentos depressores da função sinusal e condução AV (NE 3).
Recomendação B1 - Síncope recorrente sem história clínica sugestiva de hipersensibilidade do seio carotídeo, mas com resposta hipersensível cárdio-inibidora a MSC (NE 4).
Recomendação C - Importante resposta cárdio-inibidora a MSC na ausência de sintomas clínicos síncopes ou quedas (NE 4).
A escolha do modo de estimulação para portadores de síndromes neuromediadas baseia-se nas recomendações abaixo:
Recomendação A - DDDC/R com função RDR; DDIC/R; DDDC/R com funções especificas.
Recomendação B - B1 Nenhuma; B2 VVIC/R.
Recomendação C - AAICR.
G) Insuficiência cardíaca
O alargamento do intervalo QRS decorrente do bloqueio completo do ramo esquerdo ou da estimulação ventricular endocárdica clássica provoca disfunção sistólica e diastólica e favorece a regurgitação mitral 95. A contração e o relaxamento das células miocárdicas e dos músculos papilares em intervalo de tempo maior que o normal parecem ser fatores decisivos no grau de disfunção resultante (discinesia eletromecânica) 96. Ademais, o ponto inicial de ativação ventricular também contribui nesta disfunção. Aparentemente, as estimulações septal ou da via de saída do ventrículo direito têm rendimento hemodinâmico ligeiramente superior que a estimulação na via de entrada ou na ponta do ventrículo direito 97.
A estimulação cardíaca com intervalo AV curto se mostrou útil em casos de cardiomiopatia dilatada com insuficiência cardíaca, PR normal e sem bradiarritmia 98. Brecker, entretanto, demonstrou resultados divergentes e efeitos contrários desse procedimento 99.
Vários estudos têm demonstrado as vantagens da estimulação multi-sítio no tratamento de portadores de cardiomiopatia dilatada e BCRE que demonstraram o papel dessa técnica, na ressincronização dos ventrículos através de avaliações clínicas, hemodinâmicas e funcionais 100-105. A expectativa atual se dirige aos resultados do estudo Miracle, em andamento, cujo tamanho amostral relevante e promissora avaliação da longevidade prometem revelar o valor definitivo dessa técnica de estimulação 106. As evidências atuais, portanto, são suficientes para justificar a inclusão, ainda com discretas reservas, desse procedimento no conteúdo dessas diretrizes.
A indicação de estimulação biventricular na cardiomiopatia dilatada baseia-se nas recomendações abaixo:
Recomendação A - Nenhuma.
Recomendação B - B1 - Cardiomiopatia dilatada com insuficiência cardíaca grave e BRE, em condições clínicas estáveis nos últimos dois meses sob tratamento medicamentoso otimizado (NE 3); B1: cardiomiopatia dilatada com insuficiência cardíaca grave, em condições clínicas estáveis nos últimos dois meses sob tratamento medicamentoso otimizado em dependente de MP convencional ou situações em que se comprova que a estimulação convencional é deletéria (NE 4); B2: cardiomiopatia dilatada com insuficiência cardíaca grave, em condições clínicas estáveis nos últimos dois meses sob tratamento medicamentoso otimizado, com BAV de 1º grau responsável por comprometimento hemodinâmico (NE 3).
Recomendação C - Cardiomiopatia dilatada e insuficiência cardíaca com boa resposta clínica e/ou não documentação de dissincronismo AV ou IV (NE 4).
Modo de estimulação
Recomendação A - DDDC/R ou VDDC/R com estimulação biventricular - VVIC/R com estimulação biventricular em presença de FA.
Relação custo/benefício - Redução significativa do número de internações hospitalares (NE 3).
Otimização por ecocardiograma e gated
Recomendação A - Programação guiada por Eco-Dopplercardiograma semestral.
Recomendação B - Avaliação semestral de sincronismo intraventricular por Gated.
Recomendação C - Nenhuma.
Remoção de cabo-eletrodo de marcapasso e cárdio-desfibrilador implantável
Remoção de cabo-eletrodo é um termo genérico utilizado para procedimentos em que cateteres de estimulação cardíaca artificial são retirados do paciente, independentemente da técnica cirúrgica utilizada.
Explante de cabo-eletrodo é o termo usado para especificar remoções realizadas pela mesma via pela qual o cabo-eletrodo foi implantado, sem o uso de ferramentas especiais, realizando apenas tração manual sobre o cabo-eletrodo. Este é o procedimento habitualmente aplicado a cabos-eletrodo transvenosos implantados há menos de um ano.
Extração de cabo-eletrodo tem sido utilizado nas seguintes situações: 1) procedimentos realizados com ferramentas especiais como dilatadores mecânicos, radiofreqüência, raios laser, etc.; 2) procedimentos realizados por outra via que não a utilizada para o implante; 3) remoção de cabos implantados há mais de um ano.
Três tipos de abordagem para a retirada de eletrodos transvenosos têm sido utilizadas: 1) tração direta externa dos cabos, que apresenta baixo índice de sucesso e alto risco de laceração das estruturas cardíacas e venosas; 2) cardiotomia, habitualmente realizada com o auxílio da circulação extracorpórea; 3) contra-tração interna, realizada com bainhas de teflon ou de polipropileno, que apresenta bom índice de sucesso 107,108. A contratração interna consiste na técnica transvenosa e, portanto, menos invasiva que a cardiotomia, e tem sido a abordagem preferida pela maioria dos serviços. Requer, entretanto, a introdução de uma bainha, que libera o cabo a ser removido, e avança através da veia, envolvendo o cabo-eletrodo até a câmara cardíaca onde o eletrodo está implantado, a fim de servir de apoio junto ao miocárdio para a remoção do cateter. A introdução dessa bainha pode ser realizada utilizando-se ou dilatadores mecânicos que rompem o tecido fibroso ao longo do trajeto do eletrodo, ou o excimer laser que corta a frio esta fibrose. Altas taxas de sucesso com as técnicas de contratração com dilatadores mecânicos têm sido relatadas na literatura 109-111.
Nos cinco últimos anos, grande esforço tem sido realizado no sentido de sistematizar, aperfeiçoar e aferir os resultados da remoção de cabos-eletrodos de marcapassos e desfibriladores implantáveis. Estudos multicêntricos prospectivos realizados em nos EUA e Europa, têm demonstrado elevado índice de sucesso na remoção de eletrodos com as técnicas laser-assistidas 112,113.
Embora a maioria dos cabos-eletrodos seja removida integralmente, partes do cateter podem permanecer in situ. Em muitas situações essa permanência pode significar ter sido alcançado o objetivo como, por exemplo, manter o local de implante do gerador de pulsos, preservar uma via de acesso, ou tratar um processo infeccioso localizado. Dessa forma, podemos fundamentar o sucesso do procedimento através de:
a) Resultado radiológico (para cada cabo-eletrodo): sucesso completo - Remoção de todo o cateter do sistema venoso; sucesso parcial: permanência de parte do cateter no paciente que pode ser: apenas o eletrodo distal; 4cm ou menos do condutor e/ou revestimento; ou a combinação de ambas as alternativas anteriores.
Falha - Abandono de parte significante do cabo-eletrodo (mais do que quatro cm) após tentativa de removê-lo.
b) Resultado clínico (para todo o procedimento): sucesso - Quando são atingidos todos os objetivos referentes à indicação do procedimento, como: 1) resolução do problema clínico que indicou o procedimento, por exemplo, eliminação da infecção de uma incisão cirúrgica; 2) obtenção de acesso venoso para o implante de um novo eletrodo, caso todos os acessos estejam obstruídos; 3) em casos de troca eletiva por recall do fabricante que implique em risco de vida para o paciente; 4) controle da condição de estimulação cardíaca artificial.
Falha - Impossibilidade de atingir todos os objetivos clínicos.
Requisitos mínimos para remoção de cabo eletrodo
As complicações intra e peri-operatórias observadas durante remoções de eletrodos incluem eventos como hemotórax e tamponamento cardíaco, responsáveis por cerca de 1% de mortalidade.
Para adequado atendimento dessas complicações, são considerados requisitos fundamentais para os centros em que se proceda a remoção de cabo-eletrodo: 1) serviço de cirurgia cardíaca; 2) laboratório de hemodinâmica; 3) profissional adequadamente treinado em técnica de remoção transvenosa de cateteres; 4) cirurgião cardiovascular disponível no momento do procedimento; 5) anestesista com equipamento de anestesia na sala do procedimento; 6) conjunto completo de instrumentos para remoção de eletrodos; 7) fluoroscopia de alta qualidade; 8) ecocardiografia transtorácica e esofágica; 9) equipo de monitoração invasiva ou não invasiva de pressão arterial e saturação de oxigênio; 10) material para pericardiocentese disponível e médico treinado na técnica; 11) material para toracotomia disponível para uso imediato; 12) marcapasso temporário e desfibrilador/cardioversor na sala do procedimento; 13) drogas vasopressoras e outras medicações de emergência na sala do procedimento.
Recomendações essenciais antes do procedimento
1) Informações ao paciente sobre o procedimento: riscos, benefícios e outras alternativas; 2) minuciosa história clínica e exame físico; 3) coleta de informações sobre o sistema implantado; 4) definição do grau de dependência à estimulação cardíaca artificial e necessidade de marcapasso temporário; 5) aplicação de eletrodos adesivos para estimulação e desfibrilação transcutânea; 6) avaliação laboratorial básica e testes de coagulação; 7) tipagem sangüínea e reserva de hemoderivados; 8) registro de imagens radiográficas dos eletrodos, da vasculatura e do coração, incluindo as veias do território ilíaco-femoral; 9) monitoração contínua da pressão arterial, preferencialmente invasiva; 10) acesso venoso que permita infusão rápida de volume; 11) anestesia geral para conforto do paciente (preferência por ventilação controlada por intubação endo-traqueal); 12) tricotomia; anti-sepsia e colocação de campos cirúrgicos que permitam a exposição completa do esterno e do hemitórax ipsilateral ao procedimento.
As indicações para remoção de cabos-eletrodos de marcapasso e desfibrilador devem se basear nas seguintes recomendações:
Recomendação A - Sepsis, inclusive endocardite, com decorrência de infecção de qualquer componente do sistema de estimulação ou quando porções intravasculares do cabo-eletrodo não podem ser assepticamente isoladas da loja; arritmias graves secundárias a fragmentos de eletrodo retidos; cabo-eletrodo, fragmento ou parte de ferramenta de remoção retidos e que implique em risco de vida ao paciente; eventos trombo-embólicos com importância clínica, provocados por fragmentos ou cabos-eletrodo retidos; obstrução de todos os acessos venosos em casos de implante de novo cabo-transvenoso; cabo-eletrodo que interfira com desfibrilador ou marcapasso implantados.
Recomendação B1 - Infecção de loja localizada, erosão de pele que não envolva o segmento transvenoso do sistema de estimulação, quando o cabo-eletrodo possa ser isolado e retirado através de uma incisão limpa, totalmente isolada da região infectada; infecção oculta cuja fonte específica não-identificada por avaliação minuciosa; dor crônica na loja do marcapasso ou inserção do cabo-eletrodo que cause sério desconforto ao paciente, não controlável com medicação ou sem remoção do cabo-eletrodo, cabos-eletrodo que interfiram com o tratamento de neoplasia; lesão traumática no local de inserção do cabo-eletrodo, cuja presença implique em dificuldade para a reconstrução da lesão; cabos-eletrodo que prejudiquem a via de acesso para a instalação de outro aparelho; cabos-eletrodo considerados sem função em pacientes jovens.
Recomendação B2 - Presença de calcificação visível pelo estudo radiológico do tórax envolvendo o cabo-eletrodo no átrio ou na veia cava superior; impossibilidade de contar com o equipamento necessário; paciente sem condições para toracotomia de salvamento; conhecimento prévio de que o eletrodo está posicionado fora do sistema venoso (artéria subclávia, espaço pericárdico, etc.).
Recomendação C - Qualquer situação onde o risco da remoção é maior que o benefício; um único eletrodo abandonado em paciente idoso; qualquer cabo-eletrodo normofuncionante que possa ser reutilizado no momento de troca de gerador de pulsos, com histórico de performance confiável.
Interferências sobre marcapassos e cárdio-desfibriladores implantáveis
São consideradas interferências sobre marcapassos e CDI, a presença de sinais elétricos ou fenômenos mecânicos extrínsecos capazes de provocar modificações funcionais nos dispositivos. A natureza dessas fontes pode ser, portanto, eletromagnética ou mecânica 114.
As interferências eletromagnéticas (IEM) podem ser do tipo conduzidas, irradiadas e radiadas. As IEM conduzidas têm como característica fundamental a propagação através de um meio físico, já as irradiadas podem se propagar na ausência desse meio. Por outro lado, as IEM radiadas podem ser do tipo ionizantes, como é o caso dos raios gama ou não-ionizantes, como as ondas de rádio.
Os efeitos da IEM ainda podem ser classificados como permanentes (disfunções definitivas de gerador) ou transitórios e quanto à origem em endógenas (miopotenciais) ou exógenas.
As interferências mecânicas podem ser decorrentes de vibrações ou por variações de temperatura. Nesses casos, resultam em variações inapropriadas da freqüência de estimulação com relação de causa-efeito freqüentemente fácil de caracterizar.
Classificação de interferências sobre sistemas de estimulação conforme o grau de risco: aceitável - segura e inofensiva, não há riscos de provocar danos; aceitável com precauções: pode provocar danos e os riscos são conhecidos; sob cuidados específicos de proteção há segurança; aceitável com riscos: pode provocar danos e não há consenso sobre riscos e segurança, mesmo sob cuidados específicos de proteção; inaceitável: há consenso geral de que são prejudiciais. Exceto em condições muito especiais são proibitivas.
Aceitável
1) Eletrodomésticos em geral - Podem causar danos se estiverem em más condições funcionais e de aterramento. Terapia inapropriada pode ser deflagrada por CDI devido a choque elétrico causado por esses aparelhos.
Recomendação - Evitar contato direto do eletrodoméstico com o local de implante (N3).
2) Fenômenos tribo-elétricos - São causados por energia eletrostática, principalmente em clima seco. Há a possibilidade teórica de inibição ou deflagração de um pulso extra sem expressão clínica.
3) Escadas rolantes e portas automáticas - Não há evidências de que possam causar qualquer interferência (N4).
4) Automóveis, ônibus, aviões.
5) Recomendações - Não é recomendado aproximar o tórax ao local onde está instalado o motor do automóvel, quando em funcionamento. Com relação a aviões, o portador de sistema de estimulação cardíaca artificial não deve permanecer na cabine de comando pelo risco de interferência sobre os dispositivos de radiocomunicação (N3).
Aceitável com riscos
6) Colchões magnéticos - Os imãs podem modificar o comportamento dos geradores de marcapasso, que passam a operar em modo assíncrono, e dos CDIs que desativam a terapia antitaquicardia (Nível 4).
Recomendações - Pode-se considerar o uso apenas para os geradores, cujo comportamento não seja assincrônico, em modo magnético.
7) Telefones celulares - Os analógicos causam menos interferências que os digitais. Os de tecnologia TDMA e CD MA têm potencialidade de interferência crescente 113.
Recomendações - Devem ser utilizados no ouvido contralateral a localização do gerador, respeitando uma distância mínima de 15cm. Não deve ser carregado no bolso superior da camisa ou casaco (implante torácico) ou na cintura (implante abdominal). Não deve ser mantido entre o ombro e a cabeça nos casos de implante peitoral. (Nível 3).
8) Eletrocautério
Recomendações - No portador de marcapasso, pode ser usado desde que o paciente esteja monitorizado (ECG) e, preferencialmente, com programação assíncrona, com freqüência de estimulação superior à própria do paciente. A utilização do imã fica restrita apenas aos geradores que desativam o circuito de sensibilidade sob efeito magnético e que não ativem mecanismo de busca de limiar de estimulação. Alguns geradores abrem o circuito de telemetria sob influência magnética, possibilitando reprogramações espúrias. O local da placa indiferente deve ser o mais distante possível do gerador e de tal forma que a alça elétrica (placa-bisturi) não passe sobre ele. A aplicação do bisturi deve ser intermitente, em pulsos de curta duração. Sistemas com sensibilidade unipolar apresentam maior probabilidade de interferências. Deve-se buscar alternativas como o uso de bisturi bipolar ou ultrassônico 115. (Nível 3).
No portador de CDI, deve-se desativar os mecanismos antitaquicardia.
9) Radiação terapêutica
Recomendações - Pode ser realizada desde que se limite o local de atuação, protegendo o gerador com chumbo e reprogramando-o para modo assíncrono. A dose de radiação é cumulativa e nos casos de tratamento prolongado deve-se indicar troca do local da loja do gerador e avaliações mais freqüentes. (Nível 3).
10) Desfibrilação externa
Recomendações - As pás do desfibrilador devem ser colocadas perpendicularmente ao eixo gerador-eletrodo, respeitando uma distancia mínima de 15cm da unidade geradora. A utilização do imã sofre as mesmas restrições descritas anteriormente. Para procedimentos eletivos, recomenda-se a reprogramação do marcapasso para modo assíncrono e desativação das terapias antitaquicardia nos CDIs. Após o procedimento, reprogramar o sistema e avaliar o seu funcionamento (Nível 4).
11) Ablação por radiofreqüência (RF)
Recomendações - A aplicação de RF não deve ser realizada a uma distância inferior a 2cm da ponta do eletrodo. O gerador deve ser programado em modo assíncrono.
12) Litotripsia
Recomendações - Os geradores bicamerais devem ser programados para modo unicameral assincrônico. O gerador não deve estar sob o foco da onda de choque. (Nível 3).
13) Aparelhos que produzem vibração mecânica
Recomendações - Pacientes com geradores de pulso dotados de sensores de movimento devem evitar o uso de furadeiras elétricas, barbeadores, escovas elétricas, aparadores de grama porque podem causar aceleração indevida da freqüência de estimulação. (Nível 4).
14) Sistemas de detecção de metais e antifurto: as publicações são controversas. Demonstram que dependendo do modo de estimulação, da sensibilidade, do modelo do gerador, assim como da distância, intensidade e do tempo de exposição ao campo, interferências fugazes e assintomáticas podem ocorrer. Os efeitos são ainda mais deletérios quando a sensibilidade é unipolar e o tempo de exposição maior. Na prática, esse tipo de interferência não provoca sintomas, pois o tempo de exposição a esses campos eletromagnéticos costuma ser curto.
Recomendação - Quando o tipo e a intensidade do campo gerado por detetores de metais não é conhecido, os pacientes devem permanecer o menor tempo possível sob a ação destes, devendo ultrapassá-los rapidamente 115-118(Nível 3).
15) Estimulação transcutânea, eletro-acupuntura
Recomendações - Devem ser evitados na região torácica, no membro superior homolateral ao gerador e em sistemas com sensibilidade unipolar (Nível 4).
16) Radares de navegação, radares militares: a interferência é diretamente proporcional à sua potência e à proximidade com o marcapasso e CDIs. Apenas grandes dispositivos são reconhecidos como responsáveis por interferências significativas.
Recomendações - Deve-se orientar os pacientes para guardar distância considerável de radares de grande porte (Nível 3).
17) Torres de transmissão de energia elétrica, rádio-bases de telefonia celular: o campo eletromagnético que circunda estas fontes de emissão apresenta grande potencial de interferência sobre os marcapassos e CDIs.
Recomendações - Sugere-se um perímetro de segurança mínimo de quatro metros 117(Nível 4).
18) Campos eletromagnéticos gerados por grandes fontes (geradores de energia a óleo), amplificadores de som e caixas acústicas de grande porte - Podem interferir nos marcapassos e CDIs, porém não há perímetro de segurança definido.
Recomendações - A orientação deve ser individualizada, evitando sempre contato próximo e afastamento do local no caso de sintomas de baixo débito cerebral (Nível 4).
19) Campos eletromagnéticos gerados por subestações de transformação, linhas de transmissão de alta tensão são locais de intenso campo eletromagnético (Nível 3).
Recomendações - Alguns estudos demonstram proteção desses profissionais através do uso de roupas isolantes que permitem trabalho em estações de até 400KV, desde que guardada distância mínima de 4m.
20) Profissionais da área de montagem de televisores e uso de equipamentos de solda por radiofreqüência - Sujeitos a interferências temporárias.
Recomendações - Devem ser obedecidas rigorosamente as regras de segurança elétrica (Nível 4).
21) Esportes e esforços físicos em geral
Recomendações - Podem ser realizados com segurança por portadores de sistemas de estimulação cardíaca desde que não se utilize a musculatura peitoral com grande intensidade e/ou estejam programados com sensibilidade bipolar. Esportes de contato físico devem ser desaconselhados.
22) Mecânicos de automóveis - Sistema de ignição e caixa de ignição eletrônica interferem diretamente sobre marcapassos e CDIs.
Recomendação: guardar distância mínima de 50cm da fonte.
23) Aparelhos de diatermia dental - Podem causar interferência.
Recomendação - Deve ser respeitada distância mínima de 35cm de sua fonte (Nível 3).
Inaceitável
Ressonância magnética - Pode provocar movimentação do gerador e cabo-eletrodo, ativação ou dano da chave magnética, reprogramação espúria e inibição ou reversão assíncrona do gerador, indução de corrente através dos cabos-eletrodo, estimulação em freqüência e energia determinada pelo campo e aquecimento do sistema.
Recomendações - O portador de sistema de estimulação cardíaca artificial não deve ultrapassar os limites da linha de segurança classicamente definida como campo magnético estático de 0,5 mT (5 Gauss). Em situações especiais, em que o exame seja imprescindível (risco de vida) deve-se considerar com muito rigor a relação custo-benefício (Nível 3).
Deve ser sumariamente desaconselhado, sem maiores considerações, aos portadores de marcapassos ou CDIs, o contato com as seguintes fontes de interferência: 1) litotripsia em portadores de unidades abdominais (Nível 3); 2) irradiação terapêutica sobre o local onde se encontra a unidade geradora (Nível 3); 3) colchões magnéticos em portadores de desfibriladores (Nível 4); 4) diatermia sobre a unidade geradora (Nível 3); 5) diatermia por ondas curtas (Nível 3); 6) dispositivos de solda elétrica (arco voltaico) com porte acima de 300A (Nível 3).
Referências
1. Furman S, Hayes D, Holmes Jr DR. A Practice of Cardiac Pacing. Mount Kisco: Futura Publishing Co. Inc., 1986.
2. Mond HG. Implantation Techniques Part I: Normal Pacemaker Function. In: The Cardiac Pacemaker Function And Malfunction. Grune & Stratton, 1983: 191-232.
3. Ferrer MI. Sick Sinus Syndrome. In: Atrial Disease. JAMA 1968; 206: 645.
4. Shaw DB, Holman RR, Gowers JI. Survival. In: Sinoatrial Disorder (Sick Sinus Syndrome). Br Med J 1980; 280: 139.
5. Gann D, Tolentino A, Samet P. Electrophysiological evaluation of elderly patients with sinus bradycardia. Ann Intern Med 19; 90: 24.
6. Marneffe M, Gregore M, Waterschoot P, Kestmont P. The sinus node function: normal and pathological. Eur Heart J 1993, 14: 649-54.
7. Lee WJ, Wu ML, Lue HC. Sinus node disfunction. In: Children. Acta Paediatrics Sin 1992; 33: 159.
8. Caralis DG, Varghese PJ. Familial sinoatrial node dysfunction: Increased vagal tone A possible aetiology. Br Heart J 1976; 38: 951-2.
9. Celiker A, Oto A, Ozme S. Familial sick sinus syndrome in two siblings. Turk J Pediatr 1993; 35: 5.
10. Shullman VA, Nikulina SI, Puzyrev VP, Saliukov VB, Matiushin GV, Kusaev VV. The etiological aspects of the sick sinus syndrome. Ter Arkh 1993; 5: 38.
11. Gillette P, Wampler DC, Shannon C, Ott D. Use of atrial pacing in a young population. PACE 1985; 8: 94.
12. Kay MD, Estioko M, Wiener I. Primary sick sinus syndrome as an indicator for chronic pacemaker therapy in young adults: incidence, clinical features, and long-term evaluation. Am Heart J 1982; 103: 338.
13. Shaw DB. The etiology of sinoatrial disorder (sick sinus syndrome). Am Heart J 1976; 92: 539.
14. Nieminski KE, Kay RH, Rubin DA. Current concepts and management of the sick sinus syndrome. Heart & Lung 1984,13: 675-80.
15. Andrade ZA, Câmara EJN, Sadigursky M, Andrade SG. Envolvimento do nódulo sinusal na doença de Chagas. Arq Bras Cardiol 1988; 50: 153.
16. Benchimol CB, Kreuzig R, Ginefra P, Schlesinger P, Benchimol AB. A disfunção do nódulo sinusal na cardiopatia chagásica crônica. Arq Bras Cardiol 1977; 30: 337.
17. Shaw DB, Linker NJ, Heaver PA, Evans R. Chronic sinoatrial disorder (sick sinus syndrome): A possible result of cardiac ischaemia. Br Heart J 1987; 58: 598.
18. Fukushima Y, Kanno Y, Itoh T, Watanabe S, Hirokawa M, Miura AB. Sick sinus syndrome in a patient with myeloma-associated amyloidosis. Rinsho Ketsueki 1992; 33: 969.
19. Wang TL, Chen WJ, Liau CS, Lee YT. Sick sinus syndrome as the early manifestation of cardiac hemochromatosis. J Electrocardiol 1994; 27: 91.
20. Szatmary LJ, Solti F, Albared JL, Pisapia A. Intrinsic and extrinsic sinus node dysfunction: diagnostic problems. Cor Vasa 1989; 31: 216.
21. Bhandari S, Talwar KK, Kaul U, Bhatia ML. Value of physical and pharmacological tests in predicting intrinsic and extrinsic sick sinus syndrome. Int J Cardiol 1986; 12: 203.
22. Delon W, Facc SY, Fung-Chung L, Chun-Chieh W, Wen-Jin C. Sinus automaticity and sinoatrial conduction in severe symptomatic sick sinus syndrome. J Am Coll Cardiol 1992; 19: 355.
23. Szatmáry L, Czakó E, Szabó Z. Autonomic sinus node dysfunction and its treatment. Acta Cardiologica 1984; 39: 209-20.
24. Karagueuzian HS, Jordan JL, Sugi K, et al. Appropriate diagnostic studies for sinus node dysfunction. PACE 1985; 38: 242-54.
25. Sauerwein HP, Ruos JC, Becker AE, Dunning AJ. The sick sinus syndrome. Acta Med Scand 1976; 199: 467.
26. Lousada N, Catarino C, Antunes E, et al. Arrhythmic profiles evaluated by Holter's technique in sick sinus syndrome. Rev Port Cardiol 1991; 10: 427.
27. Sutton R, Kenny R. The natural hystory of sick sinus syndrome. PACE 1986; 9: 1110.
28. Simon AB, Janz N. Symptomatic brady-arrhythmias in the adult. Natural history following ventricular pacemaker implantation. PACE 1982; 5: 372.
29. Benditt DG, Benson DW Jr, Kreitt J, et al. Electrophysiologic effects of theophylline in young patients with recurrent symptomatic bradiarrhythmias. Am J Cardiol 1983; 52: 1223.
30. Sgarbossa EB, Pinski SL, Maloney JD, et al. Chronic atrial fibrillation and stroke in paced patients with sick sinus syndrome-relevance of clinical characteristics and pacing modalities. Circulation 1993; 88: 1045.
31. Alboni P, Ratto B, Cappato R, Rossi P, Gatto E, Antonioli GE. Clinical effects of oral teophilline in sick sinus syndrome. Am Heart J 1991; 122: 1361.
32. Saito D, Matsubara K, Yamanari H, et al. Effects of oral teophilline on sick sinus syndrome. J Am Coll Cardiol 1993; 21: 1199.
33. Yang YJ. The natural history of sick sinus syndrome. Chest 1993; 21: 94.
34. Scheibelhofer W, Kaliman J, Laczkovics A, Steinbach K. Rhythm complications in atrial programmed pacing. In: Feruglio G (Ed.). Cardiac Pacing, Electrophysiology And Pacemaker Technology, 1982: 665.
35. Lien WP, Lee YS, Chang FZ, Lee SY, Chen CM, Tsai HC. The sick sinus syndrome. (Natural history of dysfunction of the sino-atrial node). Chest 1977; 72: 628.
36. Rosenqvist M, Brandt J, Schüller H. Atrial versus ventricular pacing in sinus node disease: a treatment comparison study. Am Heart J 1986; 11: 292.
37. Alpert MA, Curtis JJ, Sanfelippo JF, et al. Comparative survival following permanent ventricular and dual-chamber pacing for patients with chronic symptomatic sinus node dysfunction with and without congestive heart failure. Am Heart J 1987; 113: 958.
38. Sasaki Y, Shimotori M, Akahane K. Long-term follow-up of patients with sick sinus syndrome: a comparison of clinical aspects among unpaced, ventricular inhibited paced and physiologically paced groups. PACE 1988; 11: 1575.
39. Curzi GF, Mocchegianni R, Ciampani N, Pasetti L, Berrettini U, Purcaro A. Thromboembolism During VVI Permanent Pacing In Cardiac Pacing. In: Gomez FP, (Ed.). Electrophysiology and Tachyarrhythmias. Madrid: Editorial Grouz, 1985: 1203-6.
40. Hluchy J, Milovsky V, Pavlovic M, Uhliarikova H, Makovini M. Parasympathetic overactivity and its evaluation in patients with sinus nodal dysfunction. Int J Cardiol 1991; 33: 357.
41. Mandel WJ, Hayakawa H, Allen HN, Danzig R, Kermaler A. Assessment of sinus node function in patients with the sick sinus syndrome. Circulation 1972; 46: 761-9.
42. The Conduction System Of The Heart. In: Davies MJ, Anderson RH, Becjer AE. London: Butterworth Publishing, 1993.
43. Ruschaupt DG, Khoury L, Thilenius OG, Replogle LR, Arcilla RA. Electrophysiologic abnormalities of children with ostium secundum atrial septal defect. Am J Cardiol 1984; 53: 1643.
44. Akhtar M, Foster JR, Damato AN, Kilne LE, Ruskin JN. Congenitally corrected transposition of the great vessels: localization of the site of ventricular AV block using His-bundle electrograms. Am J Cardiol 1976; 38: 383.
45. Rassi A, Lorga AM, Rassi SG. Abordagem diagnóstica e terapêutica das arritmias na cardiopatia chagásica crônica. In: Germiniani H. Diagnóstico e Terapêutica das Arritmias Cardíacas. Rio de Janeiro: Guanabara Koogan SA, 1990: 225-44.
46. Pedrosa AAA, Martinelli Fº M, Nishioka SAD, et al. Bloqueio atrioventricular de QRS estreito adquirido: comportamento em seguimento tardio. Arq Bras Cardiol 1995, 65: 27.
47. Langerdorf R, Cvohen H, Gozo EG. Observations on second degree atrioventricular block, including new criteria for the differential diagnosis between type I and type II block. Am J Cardiol 1972; 29: 111.
48. Alpert MA, Curtis JJ, Sanfelippo JF, et al. Comparative survival after permanent ventricular and dual chamber pacing for patients with chronic high degree atrioventricular block with and without preexistent congestive heart failure. J Am Coll Cardiol 1986; 7: 925-32.
49. Barlow M, Kerr CR, Connollu SJ. Survival quality-of-life, and clinical trials in pacemaker patients. In: Ellenbogen KA, Kay GN, Wilkoff BL, (Eds). Clinical Cardiac Pacing and Defibrillation. 2nd Ed. Philadelphia: WB Saunders, 2000.
50. Bernstein AD, Parsonnet V. Survey of cardiac pacing in the United States In 1989. Am J Cardiol 1992; 69: 331-8.
51. Brady PA, Shen WK, Neubauer AS, et al. Pacing mode and long-term survival in eldery patients with congestive heart failure: 1980-1985. J Interv Cardiovasc Electrophysiol 1997; 1: 193-201.
52. Clarke M, Sutton R, Ward D, et al. Recommendations for pacemaker prescription for symptomatic bradicardia. Br Heart J 1991; 66: 185-91.
53. Connolly SJ, Kerr C, Gent M, et al. Dual-chamber versus ventricular pacing: critical appraisal of current data. Circulation 1996; 94: 578-83.
54. Martinelli M, Nishióka SD, Lopes H, et al. Cardiac pacemakers controlled by autonomic nervous system-driven sensor and related neurohumoral aspects. Progress in biomedical research 2001; 6: 312-7.
55. Martinelli M, Nishióka SD, Lopes H, et al. Neurohumoral behavior in recipients of cardiac pacemaker patients controlled by a closed loop autonomic nervous system-driven sensor. PACE 2000, 23: 1778-82.
56. Delfaut P, Prakash A, Giorgberidze I, et al. Continuous overdrive pacing prevents recurrent atrial fibrillation during single and dual site righ atrial pacing. J Am Coll Cardiol 1998; 32: 1900-8.
57. Fitts FM, Hill MRS, Mehra R, et al, For The DAPPAF Phase I Investigators: Design and Implementation of the Dual Site Atrial Pacing to Prevent Atrial Fibrillation (DAPPAF) Clinical Trial. J Interven Cardiac Electrophysiol 1998; 21: 139-44.
58. Saksena S, Delfaut P, Prakash A, et al. Multisite electrode pacing for prevention of atrial fibrillation. J Interven Cardiac Electrophysiol 1998; 9: S155-S162.
59. Saksena S, Prakash A, Hill M, et al. Prevention of recurrent atrial fibrillation with chronic dual-site right atrial pacing. J Am Coll Cardiol 1996; 28: 687-94.
60. Andersen HR, Nielsen JC, Thomsen PEB, et al. Long-term follow-up of patients from a randomized trial of atrial versus ventricular pacing for sick sinus syndrome. Lancet 1997; 350: 1210-6.
61. Attuel P, Pellerin D, Mugica J, et al. DDD Pacing: An effective treatment modality for recurrent atrial arrhythmias. PACE 1998; 11: 1647-54.
62. Charles RF, Mccomb JM. Systematic trial of pacing to prevent atrial fibrillation. Heart 1997; 78: 224-5.
63. Sparks PB, Mond HG, Vohra JK, et al. Electrical remodeling of the atria following loss of atrioventricular synchrony: a long-term study in humans. Circulation 1999; 100: 1894-900.
64. Bailin SJ, Johnson WB, Hoyt R. A prospective randomized trial of bachman's bundle pacing for prevention of atrial fibrillation. J Am Coll Cardiol 1997; 29: 74A.
65. Bailin SJ, Johnson WB, Sorrentino D, et al. Permanent pacing for bachmann's bundle: impact on P-wave duration. PACE 1998; 21: 974.
66. Flaker CG, Blackshear JL, Mcbride R, et al, For the stroke prevention in atrial fibrillation investigators: antiarrhythmic drug therapy and cardiac mortality in atrial fibrillation. J Am Coll Cardiol 1992; 20: 527-32.
67. Garrigue S, Barold SS, Cazeau S, et al. Prevention of atrial arrhythmias during DDD pacing by atrial overdrive. PACE 1998; 21: 1751-9.
68. Daubert C, Mabo P, Berder V, et al. Atrial tachyarrhythmias associated with a high degree of interatrial block: prevention by permanent atrial resynchronization. J Cardiovasc Pacing Electrophysiol 1994; 4: 35-44.
69. Amitzur G, Manor D, Pressman A, et al. Modulation of the arterial coronary blood flow by asynchronous activation with ventricular pacing. PACE 1995, 18: 697-710.
70. Fananapazir L, Epstein ND, Curiel RV, et al. Long-term results of dual-chamber (DDD) pacing in obstructive hypertrophy cardiomyopathy: evidence for progressive symptomatic and hemodynamic improvement and reduction of left ventricular hypertrophy. Circulation 1994; 90: 2731-42.
71. Jeanrenaud X, Goy J-J, Kappenberger L. Effects of dual-chamber pacing in hypertrophic obstructive cardiomyopathy. Lancet 1992; 339: 1318-23.
72. Slade AKB, Sadoul N, Shapiro L, et al. DDD pacing in hypertrophic cardiomyopathy: a multicentre clinical experience. Heart 1996; 75: 44-9.
73. Maron BJ. Hypertrophic cardiomyopathy. Lancet 1997, 350: 127-33.
74. Johnson AD, Daily PO. Hypertrophic subaortic stenosis complicated by high degree heart block: successful treatment with atrial synchronous ventricular Pacemaker. Chest 1975; 674: 91-4.
75. Hassenstein P, Storch HH, Schmitz W. Results of electrical pacing in patients with hypertrophic obstruction cardiomyopathy. Thorax Vask Chir 1975; 23: 496-8.
76. Sakai Y, Kawakami Y, Hirota Y, Ito T, Shimada S. Dual-chamberpacing in hypertrophic obstructive cardiomyopathy: a comparison of acute and chronic effects. Jpn Circ J 1999; 63: 971-5.
77. Gadler F, Linde C, Rydén L. Rapid return of left ventricular outflow tract obstruction and symptoms following cessation of long-term. atrioventricular synchronous pacing for obstructive hypertrophic cardiomyopathy. Am J Cardiol 1999; 83: 553-7.
78. Cannon R, Tripodi D, Dilsizian V, Fananapazir L. Results of permanent dual-chamber pacing in symptomatic nonobstructive hypertrophic cardiomyopathy. Am J Cardiol 1994; 73: 571-6.
79. Kappenberger L, Linde C, Daubert C, et al. Pacing in hypertrophic obstructive cardiomyopathy: a randomized crossover study. Europ Heart J 1997; 18: 1249-56.
80. Maron BJ, Nishimura RA, Mckenna WJ, et al. Assessment of permanent dual-chamber pacing as a treatment for drug-refractory symptomatic patients with obstructive hypertrophic cardiomyopathy: a randomized double-blind, cross-over study (M-PATHY). Circulation 1999; 99: 2927-33.
81. Pachón-M JCE Pachón-M EI. Síncope epidemiologia e mecanismos fisiopatológicos. Rev Soc Cardiol Est. São Paulo 1999; 9: 163-74.
82. Abboud FM. Neurocardiogenic syncope. N Engl J Med 1993; 15: 1117.
83. Strasberg B, Sagie A, Erdman S, et al. Carotid sinus hypersensivity and the carotid sinus syndrome. Prog Cardiovasc Dis 1989; 5: 379.
84. Kapoor WN, Peterson J, And Karpf M. Micturition Syncope. JAMA 1985; 253: 796.
85. Kapoor WN, Peterson J, Karpf M. Defecation syncope. A symptom with multiple etiologies. Arch Intern Med 1986; 146: 2377.
86. Waxman MB, Cameron DA, Wald RW. Role of ventricular vagal afferents in the vasovagal reaction. J Am Coll Cardiol 1993; 21: 1138.
87. Mark AL. The Bezold-Jarisch reflex revisited: clinical implications of inhibitory reflexes originating in the heart. Br Med J 1982; 285: 1599-601.
88. Hachul D, Sosa EA, Consolim F, et al. Reprodutibilidade do teste de inclinação em pacientes com sincope neurocardiogênica. Arq Bras Cardiol 1994; 62: 297-300.
89. Kosinski DJ, Grubb BP, Elliott L, Dubois B. Treatment of malignant neurocardiogenic syncope with dual chamber cardiac pacing and fluoxetine hydrochloride. Pacing Clin Electrophysiol 1995; 18: 1455-7.
90. Connolly SJ, Sheldon R, Roberts RS, Gent M. The north american vasovagal pacemaker study (VPS). a randomized trial of permanent cardiac pacing for the prevention of vasovagal syncope. J Am Coll Cardiol 1999; 33: 16-20.
91. Martinelli M, Moreira HB. Marcapassos em pacientes com síncope neurocardiogênica. Rev Soc Cardiol do Est São Paulo 1999; 9: 244-51.
92. Sutton R, Brignole M, Menozzi C, et al. Dual-chamber pacing in the treatment of neurally mediated tilt-positive cardioinhibitory syncope: pacemaker versus no therapy: A Multicenter Randomized Study. The Vasovagal Syncope International Study (VASIS) Investigators. Circulation 2000; 102: 294-9.
93. Abe H, Iwami Y, Nagatomo T, Miura Y, Nakashima Y. Treatment of malignant neurocardiogenic vasovagal syncope with a rate drop algorithm in dual chamber cardiac pacing. Pacing Clin Electrophysiol 1998; 21: 1473-5.
94. Katritsis D, Ward DE, Camm AJ. Can we treat carotid sinus syndrome? PACE 1991; 14: 1367.
95. De Nardo D, Antolini M, Pitucco G, et al. Effects of left bundle branch block on left ventricular function in apparently normal subjects. study by equilibrium radionuclide angiocardiography at rest. Cardiology 1988; 75: 365-71.
96. Grines CL, Bashore TM, Boudoulas H, et al. Functional abnormalities in isolated left bundle branch block. the effect of interventricular asynchrony. Circulation 1989; 79: 845-53.
97. Kolettis TM, Kyriakides ZS, Tsiapras D, et al. Improved left ventricular relaxation during short-term right ventricular outflow tract compared to apical pacing. Chest 2000; 117: 60-4.
98. Hochleitner M, Hörtnagel H, Ng CK, et al. Usefulness of physiologic dual-chamber pacing in drug-resistant idiopathic dilated cardiomyopathy. Am J Cardiol 1990; 66: 198-202.
99. Brecker SJ, Xiao HB, Sparrow J, et al. Effects of dual-chamber pacing with short atrioventricular delay in dilated cardiomyopathy. Lancet 1992; 340: 1308-12.
100. Gras D, Mabo P, Tang T, et al. Multisite pacing as a supplemental treatment of congestive heart failure: preliminary results of the Medtronic Inc. Insync Study. Pacing Clin Electrophysiol 1998; 21: 2249-55.
101. Serge Cazeau, Christophe Leclercq, Thomas Lavergne, et al. For The Multisite Stimulation In Cardiomyopathies (MUSTIC) Study Investigators. Effects of multisite biventricular pacing in patients with heart failure and intraventricular conduction delay. N Engl J Med 2001; 344: 873-80.
102. Pachon Mateos JC, Albornoz RN, Pachon Mateos EI, et al. Right ventricular bifocal stimulation in the treatment of dilated cardiomyopathy with heart failure. Arq Bras Cardiol 1999;73: 485-98.
103. Pachon JC, Pachon EI, Albornoz RN, et al. Ventricular endocardial right bifocal stimulation in the treatment of severe dilated cardiomyopathy heart failure with wide QRS. Pacing Clin Electrophysiol 2001; 24: 1369-76.
104. Martinelli M, Pedrosa A, Costa R, et al. Biventricular pacing improves clinical behavior and reduces prevalence of ventricular arrhythmia in patients with heart failure. Arq Bras Cardiol 2002; 78: 110-3.
105. Galvão Fº SS, Vasconcelos JTM, Barcelos CB, et al. Ressincronização ventricular através de estimulação cardíaca biventricular no tratamento da insuficiência cardíaca refratária da miocardiopatia dilatada. Arq Bras Cardiol 2002; 78: 39-44.
106. Abraham WT. Rationale and design of a randomized clinical trial to assess the safety and efficacy of cardiac resynchronization therapy in patients with advanced heart failure: The Multicenter Insync Randomized Clinical Evaluation (MIRACLE). J Card Fail 2000; 6: 369-80.
107. Byrd CL, et al. Lead extraction: indications and techniques. Cardiol Clin 1992; 10: 735-48.
108. Wilhelm, et al. Cardiac pacemaker infection: surgical management with and without extracorporeal circulation. Ann Thorac Surg 1997; 64: 1707-12.
109. Smith HJ. Five-years experience with intravascular lead extraction. US Lead Extraction Database. Pacing Clin Electrophysiol 1994; 17: 2016-20.
110. Byrd CL. Intravascular extraction of problematic or infected permanent pacemaker leads: 1994-1996. US Extraction Database, MED Institute. PACE 1999; 22: 1348-57.
111. Kantharia BK, Kutalek SP. Extraction of pacemaker and implantable cardioverter defibrillator leads. Curr Opin Cardiol 1999; 14: 44-51.
112. Wilkoff BL, et al. Pacemaker lead extraction with the laser sheath: results of the Pacing Lead Extraction With The Excimer Sheath (PLEXES) Trial. J Am Coll Cardiol 1999; 33: 1671-6.
113. Kennergren C. Excimer laser assisted extraction of permanent pacemaker and ICD leads present experiences of a Europen Multi-Centre Study. Eur J Cardiothorac Surg 1999; 15: 856-60.
114. McIvor ME, Reddinger J, Floden E, et al. Study of pacemaker and implantable cardioverter defibrillator triggering by electronic article surveillance devices (SPICED TEAS). PACE 1998; 21: 1847-61.
115. Epstein MR, Mayer JE, Duncan BW. Use of an ultrasonic scalpel as an alternative to electrocautery in patients with pacemakers. Ann Thorac Surg 1998; 65: 1802-4.
116. Gauch PRA, Halperin C, Galvão SS, et al. Orientações a respeito das interferências sobre marcapassos cardíacos. DECA-DAEC-1996. Arq Bras Cardiol 1997; 68: 135-42.
117. Interactions between electronic article surveillance systems and implantable cardioverter- defibrillators. Circulation 1999; 100: 387-92.
118. Greenberg S, et al. The effects of electronic article surveillance systems on implanted cardiac pacemakers. Eur J C P E 1996; 6: 231.
Parte VI
Cardioversor e Desfibrilador Automático Implantável
Introdução
O cardioversor e desfibrilador automático implantável (CDI) é a terapêutica mais efetiva para evitar a morte súbita em pacientes com taquiarritmias ventriculares 1-6. Várias séries clínicas e ensaios prospectivos randomizados concluídos (AVID, MADIT, MUSTT) mostraram, de modo convincente, que em casos selecionados o CDI é superior às drogas antiarrítmicas na redução da morte súbita cardíaca e melhora da sobrevida 7-12. Os avanços tecnológicos simplificaram o implante do CDI tornando-o parecido com o do marcapasso (MP) antibradicardia 13, o que justifica o aumento dos implantes de CDI em todo o mundo 14.
A utilização dos CDI, para manter uma relação custo/benefício apropriada, requer diretriz adequada às condições de saúde e sócio-econômicas da população. Estas recomendações são transitórias, já que o avanço tecnológico e a finalização de diversos ensaios prospectivos randomizados em curso (SCD-HeFT, MADIT II, DEFINITE, BEST+ICD, IRIS, DINAMIT) poderão expandi-las ou modificá-las 15-17.
A) Caraterísticas do centro médico
Recursos hospitalares: a) Cirurgia cardíaca; b) laboratório de hemodinâmica; c) laboratório de eletrofisiologia; d) unidade de avaliação e programação de MP e CDI.
Obs: os recursos citados devem estar autorizados e equipados de acordo com as exigências das respectivas Sociedades, Departamentos e Organismos reguladores de Saúde Pública e outros especificados neste documento, nos respectivos locais.
Equipamentos necessários - São os essenciais para o bom funcionamento dos setores considerados nos Recursos Hospitalares. Com relação à unidade de avaliação e programação de MP e CDI, a mesma deve contar com acesso rápido aos respectivos programadores.
Recursos humanos - Os responsáveis pelos setores considerados nos recursos hospitalares devem ser médicos autorizados pelas respectivas Sociedades, Departamentos e Organismos reguladores de Saúde Pública, envolvidos nos implantes e seguimento dos CDIs. As tarefas podem estar concentradas numa única pessoa ou distribuídas entre os integrantes do serviço. Profissionais não médicos, devidamente treinados e autorizados pelos órgãos acima, poderão auxiliar nos procedimentos.
B) Avaliação clínica e eletrofisiológica antes do implante
Avaliação clínica - Composta de anamnese, exame físico e exames complementares relacionados no item "recursos hospitalares", que permitam diagnosticar e classificar o paciente como candidato ao implante de CDI.
Grau de recomendação = A; nível de evidência = 4.
Estudo eletrofisiológico invasivo
Grau de recomendação = A; a) Avaliar a formação e condução do impulso elétrico cardíaco identificando transtornos da função sinusal e/ou da condução AV com necessidade de estimulação antibradicardia - Nível 4; b) detectar arritmias cuja presença ou caracterização possam influir na escolha do modo de estimulação e/ou terapêuticas associadas - Nível 4; identificar taquicardias supraventriculares e/ou ventriculares passíveis de tratamento definitivo (exemplos: reentrada nodal, reentrada por via anômala, flutter atrial comum, TV por reentrada ramo a ramo, etc.) - Nível 2; c) avaliar o risco arrítmico em pacientes com taquicardia ventricular não sustentada (TVNS) - ver item de profilaxia primária - Nível 2; d) avaliar a eficácia terapêutica antiarrítmica - farmacológica ou cirúrgica - para decidir sobre a necessidade adicional de CDI - Nível 2; e) propiciar informação adicional objetivando a programação das terapias antitaquicardia - Nível 2.
C) Característica do procedimento
Monitoração - Como o implante é realizado em centro médico com cirurgia cardíaca e laboratório de eletrofisiologia, os recursos de monitorização disponíveis no local deverão ser utilizados. A monitorização mínima deve incluir o ritmo cardíaco, a pressão arterial e a saturação de O2.
Anestesia - O procedimento deve ser feito sob anestesia geral.
Acesso para o implante - O desenvolvimento tecnológico dos CDIs tem permitido o implante sem toracotomia (transvenoso) em quase todos os pacientes. Quando necessário utilizar técnicas de implante com toracotomia, que deverão ser realizados por um cirurgião cardíaco habilitado.
Avaliação eletrofisiológica mínima - São medidas obrigatórias: a) amplitude do potencial elétrico da onda P e onda R; b) Slow rate da onda R; c) limiares de estimulação atrial e ventricular; d) impedância de estimulação; e) impedância de desfibrilação; f) limiar de desfibrilação - recomenda-se que a desfibrilação deva ser obtida com 10 joules abaixo da capacidade máxima do gerador.
Grau de recomendação = A; nível de evidência = 4.
Relatório mínimo - Inclui: a) preenchimento do registro brasileiro de CDI, publicado no Diário Oficial com a Portaria nº 725, de 06-12-1999; b) cópia da programação no fim do procedimento, impressa pelo programador utilizado.
Grau de recomendação = A; nível de evidência = 4.
D) Pós-operatório
Período de internação - A possibilidade de implante transvenoso (sem toracotomia) em quase todos os pacientes, e a crescente disponibilidade de recursos para facilitar a avaliação eletrofisiológica através do próprio CDI - por telemetria - reduziram o período mínimo de internação para 1 a 2 dias. Nos casos em que a toracotomia se fizer necessária, esse período poderá ser de até cinco dias.
Grau de recomendação = B1; nível de evidência = 3.
Avaliação e programação do CDI pré-alta hospitalar a)Avaliação clínica geral, exame cuidadoso da ferida operatória e loja do CDI, eletrocardiograma de repouso e radiografia de tórax para verificar o posicionamento do(s) cabo(s)-eletrodo(s); b) avaliação e programação do CDI (intra ou pós-operatória): programação dos parâmetros antibradicardia e terapia antitaquicardia, indução da seqüência fibrilação/desfibrilação e checagem dos parâmetros de desfibrilação de acordo com as características de cada caso.
Grau de recomendação = A; nível de evidência = 4.
Riscos e complicações possíveis - a) Morbidade: substancialmente menor na técnica transvenosa em comparação àquela com toracotomia. Nos implantes endocárdicos as complicações são raras, podendo ocorrer em 1 a 3% dos casos, e geralmente assemelham-se àquelas do implante de marcapasso anti-bradicardia convencional: relacionadas com acesso venoso ou com a loja subcutânea/subpeitoral, infecção, deslocamento de cabo-eletrodo e perfuração miocárdica. Nos implantes epimiocárdicos as complicações são mais freqüentes e incluem alterações pulmonares (atelectasia, derrame pleural e pneumonia) e pericárdicas (empiema e síndrome de Dressler); b) mortalidade: menor que 1% nos implantes transvenosos e 3 a 5% naqueles por toracotomia.
Grau de recomendação = A; nível de evidência = 1.
Recomendações aos pacientes após o implante do CDI a) Paciente deve ser orientado em relação aos cuidados com a ferida operatória, evitar movimentos exagerados do membro superior relacionado ao implante por cerca de 30 dias e retornar, após este período, às atividades cotidianas (envolvendo ou não exercício físico) de acordo com a orientação do seu médico; b) a condução de veículos automotores deve ser proibida por pelo menos 6 meses pós-implante ou após o último evento sintomático significativo. Após esse período, a condução de veículos - sempre em caráter não profissional - deverá ser avaliada de acordo com cada caso e com a legislação pertinente; c) os pacientes devem se orientados quanto ao uso de equipamentos eletrônicos, sobre as possíveis interferências e, finalmente, quanto à necessidade das avaliações e programações periódicas do CDI; d) cada paciente deve, obrigatoriamente, receber manual de instruções e carteira de identificação de portador de CDI, confeccionados sob a responsabilidade do fabricante. A informação básica sobre cada modelo de CDI, interferências, garantia, longevidade etc., devem estar contidas neste manual.
Grau de recomendação = B1; nível de evidência = 4.
Avaliação ambulatorial clínica e eletrônica
A avaliação periódica é estabelecida de acordo com cada caso. Recomenda-se: a) a primeira avaliação deve ocorrer entre 10 a 14 dias após o implante, com o intervalo entre as avaliações variando de um a quatro meses, de acordo com o modelo do CDI e condições clínicas do paciente; b) após cada evento sintomático significativo e/ou ativação de terapia, deve ser realizada uma avaliação, até que se estabeleça um padrão aceitável de sintomas/tolerância do paciente, e o comportamento do CDI seja considerado confiável, seguro e efetivo. Grau de recomendação = A; nível de evidência = 3; c)as avaliações devem contemplar aspectos clínicos e eletrônicos. Os exames complementares devem ser solicitados de acordo com a necessidade de cada caso. Do ponto de vista eletrônico, os seguintes itens devem ser checados e programados na medida do necessário: histórico das terapias, parâmetros de estimulação antibradicardia, parâmetros relacionados aos eletrodos, estado da bateria, parâmetros indicativos de troca do sistema e, especialmente, parâmetros de sensibilidade, de detecção de arritmias e parâmetros de terapia antitaquicardia e cardioversão/desfibrilação. Grau de recomendação = A; nível de evidência = 4; d) o estudo eletrofisiológico de controle pode ser necessário para complementar à avaliação e/ou terapêutica. Grau de recomendação = B1; Nível de evidência = 4.
Indicações para implante de CDI
Recomendações para implante de CDI - Prevenção secundária (E) e prevenção primária (F)
Para estabelecer a relação custo-benefício são necessários dados estatísticos de diversas formas de tratamento de arritmias cardíacas. As indicações publicadas na literatura internacional foram feitas levando-se em conta dados estatísticos existentes no local de origem. Como sabemos, no nosso meio não existem dados e, portanto, serão utilizados os já publicados na literatura internacional, em particular os referentes à cardiopatia isquêmica e não isquêmica, excluída a cardiopatia chagásica crônica. Esta cardiopatia, endêmica em várias regiões do Brasil, disputa e às vezes supera a demanda para tratamento de arritmias malignas no nosso meio. Não existem dados estatísticos para elaborar uma relação custos benefícios. Assim, a indicação de um CDI deverá resultar da adequação consensual das relações existentes para outras cardiopatias.
E) Prevenção secundária
A prevenção secundária ou profilaxia da recorrência da parada cardíaca com CDI pode ser considerada nas seguintes condições 10-12, 18-22:
Grau de recomendação = A - 1) Parada cardíaca devido à taquicardia ou fibrilação ventricular de causa não reversível, com FE £ 35% (Nível 2); 2) taquicardia ventri-cular sustentada, espontânea, de causa não reversível, com FE £ 35% (Nível 2).
Grau de recomendação B1 - 1)Parada cardíaca devido à taquicardia ou fibrilação ventricular de causa não reversível, com FE > 35% (Nível 2); 2) taquicardia ventricular sustentada, espontânea, de causa não reversível, com FE > 35% se refratária a outras terapêuticas (Nível 2); 3) síncope de origem indeterminada com indução de taquicardia ventricular sustentada, hemodinamicamente instável ou fibrilação ventricular, clinicamente relevante, quando o tratamento medicamentoso não é efetivo, tolerado ou preferido (Nível 2); 4) síncope recorrente em portadores de síndrome do QT longo congênito apesar do uso de betabloqueador (Nível 3); 5) síncope associada à síndrome de Brugada com alterações eletrocardiográficas espontâneas ou induzidas (Nível 4).
Grau de recomendação B2 - 1) Síncope de origem indeterminada em pacientes com miocardiopatia dilatada idiopática, com FE £ 35% e estimulação ventricular programada negativa. (Nível 3); 2) sintomas graves atribuídos a taquiarritmias ventriculares sustentadas em pacientes esperando transplante cardíaco (Nível 4).
Grau de recomendação C - 1) Pacientes com taquiarritmias ventriculares devidas a causas transitórias (fase aguda de infarto do miocárdio), reversíveis (distúrbio hidro-eletrolítico, drogas) ou curáveis (Wolff-Parkinson-White, taquicardia ventricular em coração normal) (Nível 2); 2) taquicardia ventricular incessante (Nível 4); 3) expectativa de vida menor que um ano por outras condições clínicas (Nível 4); 4) doença psiquiátrica passível de agravamento pelo implante/utilização do CDI (Nível 4).
F) Prevenção primária
A prevenção primária ou profilaxia da parada cardíaca com CDI deve ser considerada nas seguintes condições 8,14,18-22:
Grau de recomendação= B1 TVNS com IM prévio, disfunção ventricular esquerda (FE £ 40%) com TVS/FV indutível com estimulação ventricular programada. (Nível 2).
Grau de recomendação= B2 1) Cardiomiopatia hipertrófica assimétrica com uma ou mais das seguintes características: síncope prévia, presença de TVNS sintomática, história de morte súbita na família e espessura do VE > que 30mm. (Nível 3); 2) síndrome de Brugada assintomática com história familiar de morte súbita e alterações eletrocardiográficas espontâneas. (Nível 3); 3) insuficiência cardíaca com classe funcional da NYHA II-III, de origem isquêmica, com disfunção ventricular com FE £ 40%, TVNS espontânea e indução de TVS/FV no EEF. (Nível 3).
G) Seleção dos sistemas implantáveis
1) Nos casos com taquicardias atriais paroxísticas é recomendável a escolha de dupla câmara, para reduzir choques inapropriados 12. Grau de recomendação = B1; nível de evidência = 3.
2) Nos casos com necessidade de tratamento antibradicardia recomenda-se CDI dupla câmara. Grau de recomendação = B1; nível de evidência = 3.
3) Em presença de insuficiência cardíaca grave estabilizada com tratamento clínico otimizado e QRS largo (QRS> 0,14s) pode-se considerar estimulação biventricular 23. Grau de recomendação = B2; nível de evidência = 3.
4) Nos casos com indicação de CDI, não enquadrados nos itens anteriores recomenda-se CDI unicameral ventricular. Grau de recomendação = A; nível de evidência = 4.
5) Nos casos de FA permanente, o modo é obrigatoriamente ventricular. Grau de recomendação = A; nível de evidência = 4.
H) Drogas antiarrítmicas e CDI: interação e limiar
As drogas antiarrítmicas podem provocar modificações nos limiares de sensibilidade, comando e desfibrilação do CDI 24-26.
No quadro XX estão listadas as principais drogas e seus efeitos sobre os limiares de desfibrilação ventricular.
Referências
1. Singer I. Implantable Cardioverter Defibrillator. New York: Futura, 1997: 777.
2. Wood MA, Stambler BS, Damiano RJ, et al. Lessons learned from data logging in a multicenter clinical trial using a late-generation implantable cardioverter-defibrillator. J Am Coll Cardiol 1994; 24: 1692-99.
3. Fetter JG, Stanton MS, Benditt DG, Trusty J, Collins J. Transtelephonic monitoring and transmission of stored arrhythmia detection and therapy data from an implantable cardioverter defibrillator. PACE 1995; 18: 1531-9.
4. Epstein AE, Miles WM, Benditt DG, et al. Personal and public safety issues related to arrhythmias that may affect consciousness: implications for regulation and physician recommendations. A medical/scientific statement from the AHA And the NASPE. Circulation 1996; 94: 1147-66.
5. Jung W, Lüderitz B. European policy on driving for patients with implantable cardioverter defibrillators. PACE 1996; 19: 981-4.
6. Gregoratos G, Cheitlin MD, Conill A, et al. ACC/AHA Guidelines For Implantation of Cardiac Pacemakers and Antiarrhythmia Devices. J Am Coll Cardiol 1998; 31: 1175-1209.
7. Buxton AE, Lee KL, Fisher JD, et al. A Randomized Study of the Prevention of Sudden Death in Patients with Coronary Artery Disease. N Engl J Med 1999; 341: 1882-90.
8. Moss AJ, Hall WJ, Cannom DS, Daubert JP, et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. N Engl J Med 1996; 335: 1933-40.
9. Klein HU, Reek S. The MUSTT Study: Evaluating, testing and treatment? J Interv Cardiac Electrophysiol 2000, 4: 45-50.
10. The antiarrhytmics versus implantable defibrillator investigators. A comparison of antiarrhytmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Eng J Med 1997; 337: 1576-83.
11. Kuck KH, Cappato R, Siebels J, Rüppel R, For The CASH Investigators. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest (CASH). Circulation 2000; 102: 748-54.
12. Connolly S, Gent M, Roberts R, et al. For The CIDS Investigators. Canadian Implantable Defibrillator Study (CIDS): A Randomized Trial of the Implantable Cardioverter Defibrillator Against Amiodarone. Circulation 2000; 101: 1297-302.
13. Trappe HJ, Achtelik M, Pfitzner P, et al. Single-chamber versus dual-chamber implantable cardioverter defibrillators: Indications and clinical results. Am J Cardiol 1999; 83: 8D-16D.
14. Winter SL, Packer DL, Marchlinski FE, et al. Consensus statement on indications, Guidelines for Use, and Recommendations for Follow-Up of Implantable Cardioverter Defibrillators. PACE 2001; 24: 262-9.
15. Böcker D, Breithardt G. Evaluating AVID, CASH, CIDS, CABG-Path and MADIT: are they concordant? J Interv Cardiac Electrophysiol 2000; 4: 103-8.
16. Ravielli A, Bongiorni MG, Brignole M, et al. Which strategy is "best" after myocardial infarction? The Beta-Blocker Strategy Plus Implantable Cardioverter Defibrillator Trial: Rationale And Study Design. Am J Cardiol 1999; 83(5B): 104D-111D.
17. Klein H, Auricchio A, Reek S, Geller C. New Primary Prevention Trials of Sudden Cardiac Death in Patients With Left Ventricular Dysfunction: SCD-HEFT And MADIT-II. Am J Cardiol 1999; 83: 91D-97D.
18. Knight B, Goyal R, Pelosi F, et al. Outcome of patients with nonischemic dilated cardiomyopathy and unexplained syncope treated with an implantable defibrillator. J Am Coll Cardiol 1999; 33: 1964-70.
19. Maron BJ, Shen WK, Link MS, et al. Efficacy of implantable cardioverter-defibrillators for the prevention of sudden death in patients with hypertrophic cardiomyopathy. N Engl J Med 2000; 342: 365-73.
20. Priori SG, Napolitano C, Gasparini M, et al. Clinical and genetic heterogeneity of right bundle branch block and ST-segment elevation syndrome. A prospective evaluation of 52 families. Circulation 2000; 102: 2509-15.
21. Takenaka S, Kusano KF, Hisamatsu K, et al. Relatively benign clinical course in asymptomatic patients with brugada-type electrocardiogram without family history of sudden death. J Cardiovasc Electrophysiol 2001; 12: 2-6.
22. Moss AJ, Zareba W, Jallj, Schwartz PJ, et al. Effectiveness and limitations of b-blocker therapy in congenital long-QT syndrome. Circulation 2000; 101: 616-23.
23. Walker S, Levy S, Rex S, Brant S, Paul V. Preliminary results with the simultaneous use of implantable cardioverter defibrillators and permanent biventricular pacemakers: implications for device interaction and development. PACE 2000; 23: 365-72.
24. Farré J, Asso A, Romero J, et al. Antiarrhythmic drugs in patients with an automatic implantable defibrillator. PACE 1995; 18: 579-91.
25. Brode SE, Schwartzman D, Callans DJ, et al. ICD-antiarrhythmic drug and ICD-pacemaker interactions. J Cardiov Electrophysiol 1997; 8: 830-42.
26. Pelosi F Jr, Oral H, Kim MH, et al. Effect of chronic amiodarone therapy on defibrillation energy requirements in humans. J Cardiovasc Electrophysiol 2000; 11: 736-40.
Datas de Publicação
-
Publicação nesta coleção
17 Mar 2003 -
Data do Fascículo
2002